Практическая химия белка - А. Дарбре 1989
Фрагментация полипептидов химическими методами
Расщепление по остатку метионина
Бромоциан
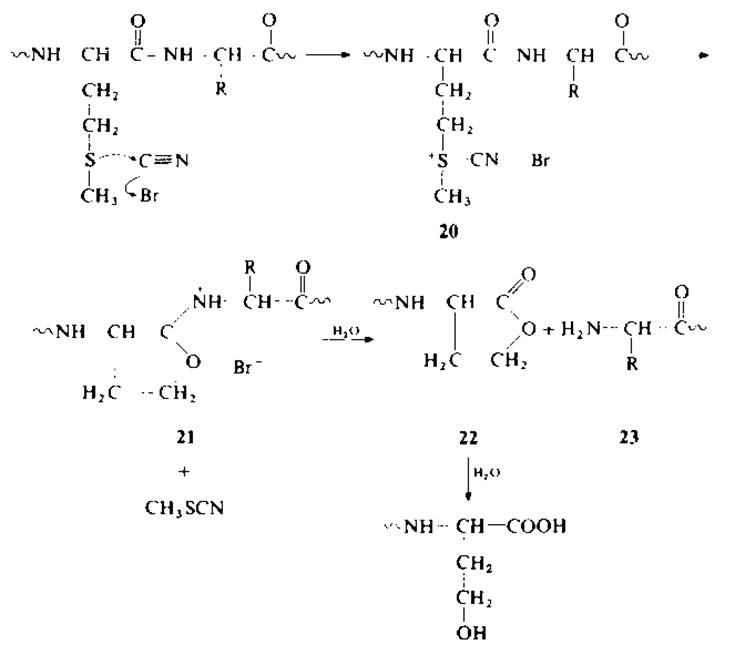
Расщепление пептидной связи по карбоксильной группе метионина основано на взаимодействии бромоциана с тиоэфирной группой с образованием гомосерина, гомосеринлактона и метилтиоцианата [68].
Цианогруппа реагента электрофильно атакует атом серы, образуя промежуточную цианосульфониевую соль (20). Нуклеофильная атака кислородом карбонильной группы метионина у-углеродного атома цианосульфониевой соли приводит к освобождению метилтиоцианата и образованию иминолактона (21). Промежуточный иминолактон гидролизуется с образованием пептидилгомосеринлактона (22) и соответствующего пептидилгомосерина, а также «аминопептида» (23) [67—69].
После первоначального успешного применения бромоциана при исследовании рибонуклеазы [69] эта реакция получила самое широкое применение [67, 181]. В оптимальных условиях бромоциан расщепляет пептидную связь метионина многих белков, причем часто с количественным выходом. Наиболее длинный полипептид, который удалось расщепить с помощью бромоциана, ß-галактозидаза Е. coli, включающая 1021 аминокислотный остаток [55]. Метод удобен в практическом отношении, поскольку реагент и побочные продукты реакции летучи и легко удаляются при лиофилизации. Поскольку метионин принадлежит к относительно редким аминокислотам, реакция расщепления бромоцианом позволяет получить крупные фрагменты, которые удобны как объекты для автоматического секвенирования.
Все получаемые фрагменты имеют на С-конце гомосеринлактон, исключение составляет С-концевой пептид белка. При аминокислотном анализе гомосеринлактон элюируется в области основных аминокислот, обычно между аммиаком и аргинином. Гомосерин элюируется вместе с глутаминовой кислотой, однако известны условия, позволяющие элюировать их раздельно [67]. Гомосеринлактон гидролизуют в гомосерин путем обработки 0,1 М NaOH в течение 1 ч [172] или в буфере пиридин — уксусная кислота (pH 6,5) при 105°С в течение 1 ч [2].
По данным количественного определения гомосерина [67] и метилтиоцианата [90] можно сделать ошибочный вывод относительно степени прохождения реакции расщепления. Показано, что гомосерин может образоваться совсем по иному механизму, без расщепления связей метионина. Принято считать, что побочная реакция идет через образование шестичленного цикла (25→26) и может конкурировать с реакцией образования пятичленного иминолактона (27→28) [22].
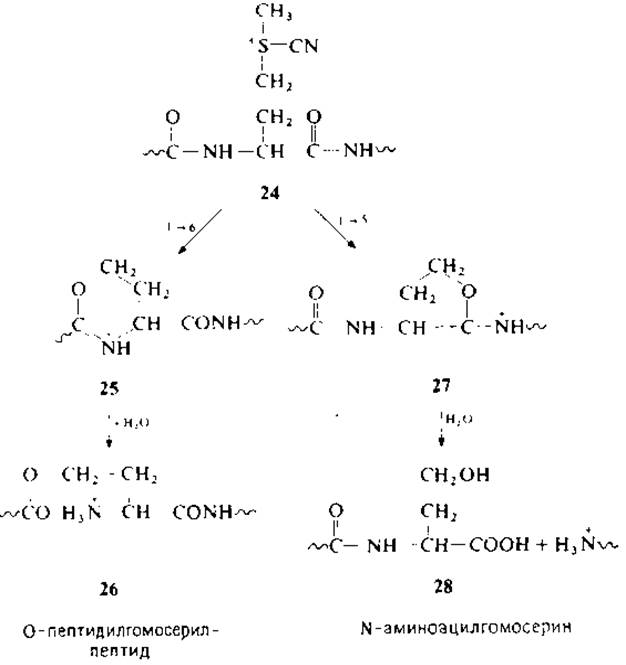
После нейтрализации реакционной среды О-пептидилгруппа мигрирует к атому азота гомосерина (разд. 2.3.2). Степень протекания этой побочной реакции, по всей видимости, варьирует в зависимости от природы двух аминокислотных остатков, граничащих с метионином.
В ряде случаев низкий выход реакции расщепления бромоцианом объясняется присутствием наиболее устойчивых фрагментов Met-Thr или Met-Ser [167, 191], причем промежуточный иминолактон атакуется соседним гидроксилом треонина или серина с образованием гомосерил-О-треонил- или гомосерил-О-серилпептидов (29→33); бициклическая структура (30) распадается с образованием боковой цепи гомосерина (31) и с раскрытием цикла, давая соединения (32) или (33) со сложноэфирной или пептидной связью соответственно.
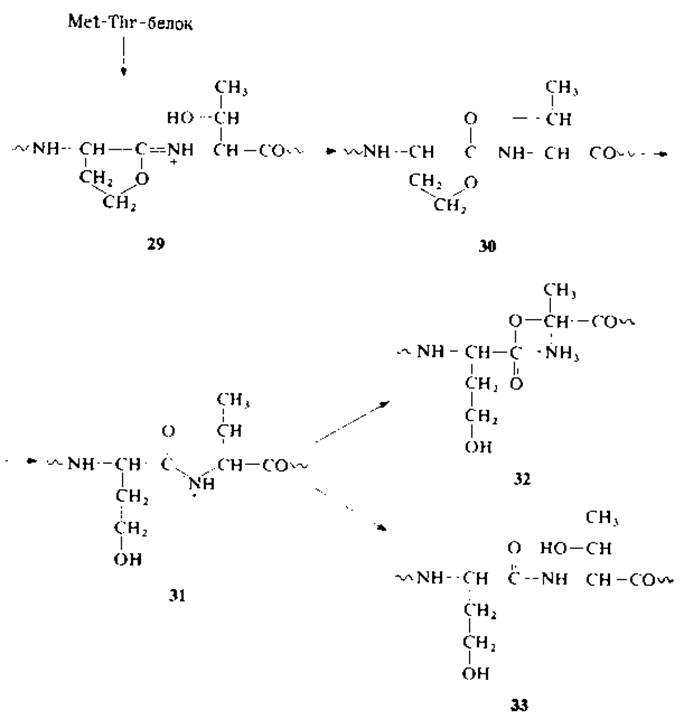
Показано, что расщепление фрагментов Met-Thr или Met-Ser целесообразно проводить в водной трифтороуксусной кислоте (ТФУ). Как сильная кислота ТФУ может препятствовать протеканию побочной реакции благодаря протонированию гидроксильных групп и иминолактона [167, 191].
Пептидные связи метионин-S-оксида и метионин-S,S-диоксида не расщепляются бромоцианом [67]. Недавно появилось сообщение [51] о том, что при большом избытке (1000 экв.) бромоциана в 70%-ной муравьиной кислоте метионин окисляется до метионин-S-оксида. Это наблюдение позволяет объяснить устойчивость пептидных связей метионина при большом избытке реагента [134, 135]. Известно, что в присутствии бромоциана идет окисление цистеина до цистина [56] и с меньшей скоростью до цистеиновой кислоты [67]. Кроме того, при избытке бромоциана идет бромирование остатков тирозина [51] и расщепление пептидной связи триптофана (разд. 2.4.2).
Реакцию проводят в 0,1 М соляной, водных муравьиной или трифтороуксусной кислоте. В настоящее время как растворитель наиболее часто применяют 70%-ную муравьиную кислоту. В кислой среде ε-аминогруппы и другие основные группировки находятся в протонированной форме, благодаря чему исключается их взаимодействие с бромоцианом. Кроме того, в водной муравьиной кислоте как сильном денатурирующем агенте остатки метионина становятся более «экспонированными», т. е. более доступными для реагента.
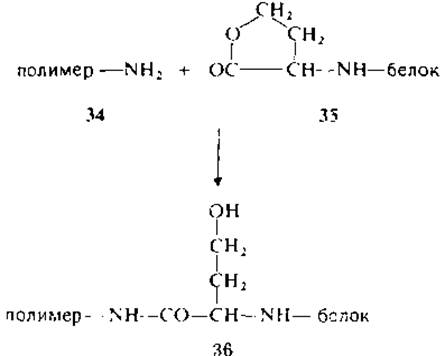
Реакция с бромоцианом находит и иное применение. Пептидные фрагменты, полученные при расщеплении бромоцианом и несущие С-концевой гомосеринлактон, можно вводить в реакцию конденсации (с высоким выходом) с аминогруппами полимеров (34→36). Этот метод позволяет избирательно фиксировать фрагменты через С-концевой аминокислотный остаток на нерастворимом носителе с целью твердофазного секвенирования [86].
Полагают, что фрагменты 1—65 и 66—104 цитохрома с сердца лошади, полученные расщеплением бромоцианом в водной среде, способны к самосборке с реконструкцией пептидной связи [34]. Аналогичным образом самопроизвольно происходит конденсация фрагментов (1—52 и 53—58) панкреатического ингибитора трипсина [41]. Иными словами, циклическая структура С-концевого гомосеринлактона находится в достаточно активированном состоянии, чтобы в мягких условиях вступать в реакцию аминолиза с а-аминогруппой N-концевой аминокислоты. Благодаря этому удается осуществить синтез цитохрома с и трипсинового ингибитора из соответствующих фрагментов [173]. Другая область применения реакции метионина с бромоцианом удивительным образом связана с генноинженерным синтезом некоторых гормонов. С помощью этой реакции ведут расщепление гибридного белка «гал-Меl;-соматотропина» из Е. coli с образованием белка-носителя ß-галактозидазы и целевого тетрадекапептида соматотропина [93].
24.1.1. Методика. Навеску белка растворяют (10—20 мг/мл) в 70%-ной муравьиной кислоте и добавляют твердый бромоциан (2 мг/мг белка или 20— 100-мольный избыток в расчете на метионин). Инкубацию ведут при комнатной температуре без доступа света в течение 18—20 ч. По завершении реакции реакционную смесь разбавляют 5—10 объемами воды и высушивают лиофильно. Продукты реакции разделяют гель-фильтрацией. Продолжительность реакции может быть существенно меньше. Например, 0,5 мк/моль пептида/мл обрабатывали бромоцианом (5 мг/мл) при комнатной температуре в течение 4 ч [101, 200].