Практическая химия белка - А. Дарбре 1989
Дисульфидные связи
Принципиальная схема анализа
Принципиальная схема определения связанных между собой остатков полуцистина остается неизменной с того времени, когда она была впервые разработана Райли при исследовании бычьего инсулина [36]. Эта методика включает следующие этапы:
1) частичный гидролиз белка в условиях, исключающих перегруппировку дисульфидных связей;
2) фракционирование полученной смеси с целью выделения цистинсодержащих пептидов также в условиях, исключающих дисульфидный обмен;
3) расщепление цистинсодержащих пептидов на цистеинилпептиды;
4) выделение отдельных цистеинилпептидов;
5) идентификация полученных пептидов.
В более подробном виде постадийный план анализа приведен на рис. 4.1.
Для однозначной идентификации положения дисульфидных связей важно, чтобы каждый из цистинсодержащих пептидов включал только один дисульфидный мостик. Предварительно необходимо установить число и положение в полипептидной цепи остатков цистеина; поэтому к анализу приступают лишь после определения полной аминокислотной последовательности полипептидной цепи или цепей исследуемого белка. Число дисульфидных связей можно определить с помощью различных методов. Для этого наряду с установлением первичной структуры проводят исследование физико-химических свойств белка. Данные относительно внутри- и межцепочечных дисульфидных связей могут быть получены с помощью физико-химических методов. Продемонстрируем сказанное на следующем примере [13, 19].
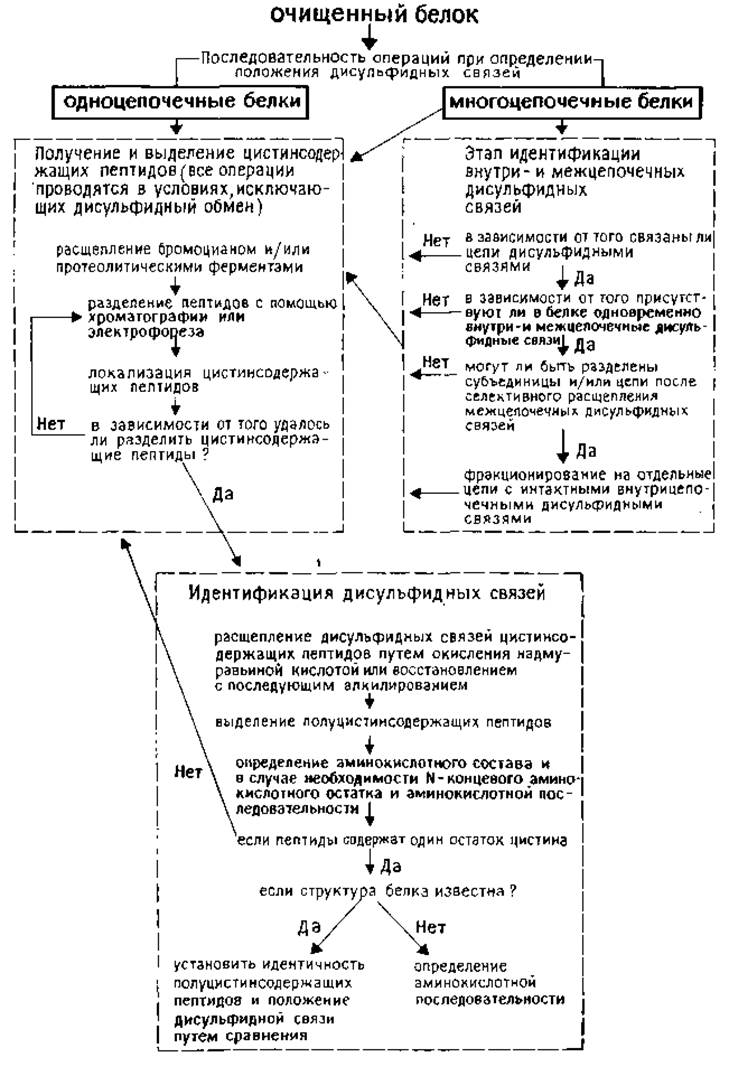
РИС. 4.1. Общая схема определения положения дисульфидных связей в очищенных белках и пептидах.
После восстановления в мягких условиях дитиотреитом молекула человеческого иммуноглобулина IgG присоединяет 8 молей [14С] иодоацетамида, в то время как нативный белок присоединяет всего 0,5 моля этого реагента. Поскольку восстановление проводят в условиях, обеспечивающих полную диссоциацию полипептидных цепей, это означает, что молекула иммуноглобулина имеет не более четырех межцепочечных дисульфидных мостиков. Следовательно, остальные 26 остатков полуцистина, найденные по данным аминокислотного анализа, образуют внутрицепочечные связи. Более того, распределение меченых остатков в отдельных цепях свидетельствует о том, что каждая легкая цепь связана с тяжелой одной дисульфидной связью, а две тяжелые цепи соединены двумя дисульфидными мостиками.
При анализе белков со сложной четвертичной структурой целесообразно разделять их на составляющие субъединицы или полипептиды. В случае иммуноглобулинов для диссоциации полипептидных цепей проводили избирательное восстановление межцепочечных дисульфидных связей [44, 46]. Для получения крупных, хорошо идентифицируемых фрагментов, пригодных для дальнейшего расщепления до коротких цистинсодержащих пептидов, нативные белки расщепляют бромоцианом или протеолитическими ферментами [19, 28, 42, 46, 47].
Для оценки соответствия цистинсодержащих пептидов структуре нативного белка существенное значение имеет выход пептидов. Действительно, выделение пептида с высоким выходом служит наиболее убедительным доказательством того, что два остатка полуцистина связаны между собой в нативном белке. Считается вполне удовлетворительным, если выход составляет 50%, однако выход может быть занижен из-за механических потерь и неколичественного протекания реакции расщепления. Низкий выход пептидов не исключает иного распределения дисульфидных связей, и, следовательно, полученные данные могут быть признаны убедительными лишь при отсутствии противоречивых сведений, например если не будет найден цистинсодержащий пептид, включающий один из идентифицированных остатков полуцистина.