ЕКОЛОГІЧНА БІОХІМІЯ - Навчальний посібник - В. М. Ісаєнко 2005
Розділ 8. СТІЙКІСТЬ ТА АДАПТАЦІЯ РОСЛИН І ТВАРИН
8.3. Стійкість та адаптація тварин до умов існування
8.3.4. Адаптація до зміни тиску
Зміна тиску безпосередньо впливає на біохімічні процеси в клітинах. Механізми адаптації до різного тиску охоплюють анатомічні, фізіологічні та біохімічні механізми, вони позв’язані з іншими факторами, зокрема кількістю доступного для дихання оксигену.
Варто зазначити, що більшість організмів мешкають на суходолі й у верхніх шарах води, за умов помірного тиску, який мало змінюється. Навіть на найвищій точці Землі (гора Еверест) атмосферний тиск лише в чотири рази нижчий, ніж на рівні моря (табл. 8.10).
Таблиця 8.10
АТМОСФЕРНИЙ ТИСК НА РІЗНІЙ ВИСОТІ Й ТИСК ВОДИ НА РІЗНИХ ГЛИБИНАХ
Місце |
Абсолютний тиск |
||
Па |
атм |
мм рт. ст. |
|
На вершині гори Еверест |
2,34 • 104 |
0,25 |
190 |
На рівні моря |
1,013 • 105 |
1,0 |
760 |
На глибині води 5км |
5,065 • 107 |
500 |
3,8 • 105 |
На глибині води 10км |
1,013 • 108 |
1000 |
7,6 • 105 |
У морі та глибоких озерах тиск води стає фактором, який різнобічно впливає на організм. Морські організми не тільки живуть в умовах величезних тисків, але деякі з них здатні пристосовуватися до великих змін тиску за короткий час, навіть у межах кількох годин. Так, наприклад, риби родини Myctophidae кожного дня роблять вертикальні міграції на 300 — 500 м. Деякі риби (Stomias, Ectreposebastes та ін.) і кальмари здатні вертикально мігрувати ще на більші відстані — 1000 — 2500 м. Певні форми бентосу мають стадії личинок, для яких різниця тиску на різних етапах життєвого циклу може бути ще значнішою. Організми, здатні до вертикальної міграції у воді, зазнають також впливу зміни температури, як правило, у межах 10—15 °С, а також розчиненого у воді оксигену.
Ефекти, пов’язані з впливом тиску на організм, можна розділити на дві гірупи: 1) ті, що визначаються з впливом тиску на метаболічні процеси; 2) структурні ефекти, пов’язані зі зміною структури, що залежить від «слабких» зв’язків (див. підрозд. 3.3.3). Ці ефекти частково перекриваються.
Вплив тиску на білки та ферментативні реакції. Одним з основних факторів, від яких залежить вплив тиску на швидкість реакцій, є зміна об’єму під час утворення активованого комплексу ферментів із субстратами. Рівняння, яке описує залежність зміни від тиску, має такий вигляд:
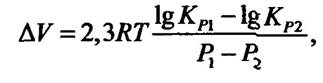
де ∆V — зміна об’єму в результаті реакції; R — газова стала; Т — абсолютна температура; КР1 і К Р2 — константи рівноваги реакції за тиску Р 1 і Р2.
Коли об’єм активованого комплексу дорівнює середньому об’єму його компонентів, то швидкість реакції під впливом тиску не змінюється. Якщо об’єм цього комплексу більший за середній об’єм його компонентів до активації, то тиск гальмує швидкість реакції, і навпаки — тиск прискорює швидкість реакції, коли об’єм активованого комплексу менший за об’єм речовин, які взаємодіють у реакції. Для ферментативних реакцій існує певний оптимум тиску, який визначається: 1) швидкістю дифузії реагуючих речовин за зміни в’язкості середовища, що залежить від тиску; 2) можливою денатурацією ферментів за високого тиску. Ці два фактори залежать також від температури.
За конкуренції двох чи більше ферментів за один загальний субстрат ефекти тиску можуть визначати напрями реакцій. Прикладом такого процесу може бути вплив тиску на можливі реакції перетворення глюкозо-6-фосфату (рис. 8.4):
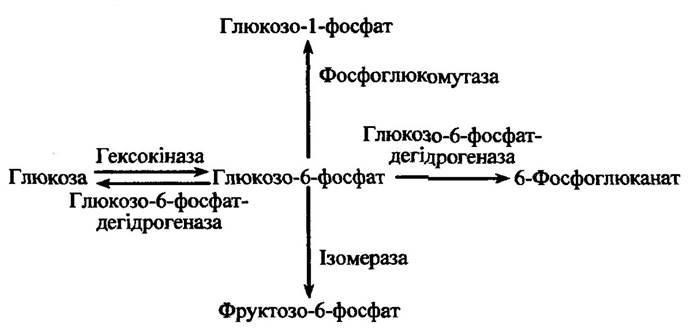
Рис. 8.4. Шляхи перетворення глюкозо-6-фосфату в печінці хребетних
У випадку великої відносної активності гексогеназу переважає напрям реакції перетворення глюкози в глюкозо-6-фосфат (рис. 8.4). Реакції перетворення різняться за: 1) напрямом вихідних реакцій; 2) своїм механізмом; 3) проміжними компонентами активованих комплексів тощо.
Зміни структури в молекулах, які викликаються тиском, можна віднести до двох категорій: 1) переходи між твердим, рідким і газоподібним станами, які впливають на функції макромолекул, зокрема ферментів; 2) зміни структури макромолекул, безпосередньо пов’язані з функціональними властивостями.
Кожній ферментативній системі притаманні специфічні реакції на тиск, які залежать від: 1) кількості «слабких» зв’язків, які здатні утворюватись або розриватися під дією тиску; 2) типу зв’язків, які здатні змінюватися; 3) конкретної ролі цих зв’язків у підтримуванні загальної структури макромолекул.
Як уже зауважувалося, у визначенні конформації і стану агрегації молекул істотну роль відіграють водневі, іонні та гідрофобні взаємодії, тобто сукупність «слабких» зв’язків. Порушення водневих і гідрофобних зв’язків у молекулах білків, що призводить до їх денатурації (зміни третинної і четвертинної структур), зумовлює зменшення сумарного об’єму системи «білок — вода». Це викликано впливом гідрофобних та іонних груп на структуру води — амінокислотні залишки білків із цим типом зв’язків створюють щільнішу упаковку молекул води порівняно з їхнім розміщенням у суцільному шарі води. Як уже зазначалося, об’єм системи залежить від тиску.
Тиск впливає не тільки на об’єм води, в якій містяться білки, а й на щільність упаковки поліпептидних ланцюгів, тобто на четвертинну структуру — за підвищення тиску зменшується об’єм білків. У глибоководних організмів, які живуть за різного тиску, білки не змінюють свого об’єму в разі виникнення високого тиску.
Прикладом впливу тиску на полімеризацію білків, яка визначається в основному гідрофобними взаємодіями, є утворення фібрилярного білка F-актину (скоротливого елементу м’язів) з мономерних одиниць G-актину (рис. 8.5).

Рис. 8.5. Схема полімеризації за низького тиску та деполімеризації за високого тиску F-актину
Впливає тиск також на полімеризацію міозину (рис. 8.6):

Рис. 8.6. Схема полімеризації за низького тиску та деполімеризації за високого тиску полімеру міозину
Прикладом залежного від тиску фазового переходу зі стану золя (справжні розчини) у стан гелю (утворення агрегатів) білків є утворення аномального гемоглобіну S (HbS) у крові хворих серпоподіб- ноклітинною анемією. У молекулі HbS залишок глутамінової кислоти в положенні 6-Р-ланцюга нормального гемоглобіну (HbS) заміщений валіном. Це приводить до утворення гідрофобних взаємодій цього залишку валіну із залишками валіну в 1-му і 5-му положеннях Р-ланцюга. Подібні валін-валінові взаємодії залежать від тиску: за температури 37 °С і тиску до 50 атм (5,065 • 106 Па) гемоглобін перебуває в стані золю і ймовірність утворення валін-валінових взаємодій мала.
Крім впливу на структуру білків і утворення білкових структур, тиск може також змінювати взаємодію білків із ліпідами, нуклеїновими кислотами тощо.
Вплив тиску на процеси транскрипції та трансляції. Взаємодія між нуклеїновими кислотами малочутлива до дії тиску. Так, наприклад, дволанцюгова ДНК, структура якої підтримується головним чином гідрогенними зв’язками, денатурує за надзвичайно високого тиску — 2000 — 3000 атм (1,52 • 109 — 2,28 • 109 Па). Процеси транскрипції та трансляції здатні змінюватися за дещо менших тисків. У дослідах на Echerichia coli під час вивчення синтезу Р-галактозидази встановлено, що синтез цього ферменту припиняється за дії тиску в 680 атм (6,89 • 107 Па). Після припинення тиску відновлюється синтез цього ферменту. У клітинах, очевидно, існує інформаційна РНК, готова після припинення дії високого тиску брати участь у процесі трансляції. Негайне відновлення синтезу Р-галактозидази після зняття впливу тиску свідчить, що синтез ферменту блокується тиском на рівні трансляції.
У разі дії високого тиску відбувається також порушення структури рибосом і полісом. В інфузорії Tetrahymena piriformis новоутворені полісоми відносно легко руйнуються за високого тиску, тимчасом як уже функціонуючі полісоми залишаються майже незмінними. Тож до дії тиску чутливий тільки етап ініціації трансляції, яка закодована в інформаційний РНК.
Вплив тиску на структуру мембран. Біологічні мембрани, як відомо, теж стабілізуються «слабкими» зв’язками. Основою їхньої структури є подвійний ліпідний шар із гідрофобною внутрішньою ділянкою і полярними зовнішніми «головками» фосфоліпідів. Мембрани перебувають у рідинно-кристалічному стані. За низьких температур (0—20 °С) мембрани багатьох організмів переходять у «твердий» стан у результаті кристалізації аліфатичних ланцюгів фосфоліпідів (див. підрозд. 3.3.3). Температура переходу з «рідинного» стану у «твердий» змінюється під дією тиску.
У насичених вуглеводів температура такого фазового переходу зростає приблизно на 20 °С за підвищення тиску на 1000 атм (1,013 • 108 Па). Наприклад, у додекану (С^-вуглеводень) точка переходу з «рідкого» стану у «твердий» за 1 атм (1,013 • 105 Па) відповідає за температури -10 °С, а за тиску 1000 атм (1,013-108 Па) -— за температури 15 °С; у октакетану (Сів-вуглеводень) — відповідно 27 °С і 50 °С.
Варто зауважити, що в морських організмів, навіть за порівняно невеликих тисків, більшість ліпідів мембран може перебувати у «твердому» стані. Проте це не відбувається, тому, що властивості мембран, які визначають їхні фазові переходи, «узгоджуються» з дією високого тиску.
Фазові переходи мембран значною мірою визначаються довжиною вуглеводневого ланцюга, кількістю (парною чи непарною) атомів карбону, ступенем насиченості тощо. Наприклад, в аліфатичних вуглеводів із непарною кількістю атомів карбону точка фазового переходу нижча, ніж у тих, які мають парну кількість. Це зумовлено слабшою здатністю вуглеводів із непарною кількістю атомів карбону упаковуватися в кристалах.
Тиск впливає також на функціональну активність біологічних мембран, які визначаються мембранними білками. Прояв дії цих білків пов’язаний з білок-ліпідними взаємодіями, які залежать від чутливих до дії тиску, як уже зазначалося, «слабких» сил. Зміна тиску також впливає на в’язкість мембран, збільшення якої за підвищення тиску зменшує дифузію. Якщо швидкість реакції лімітується дифузією речовин, які беруть у ній участь, до ферменту, то можливе уповільнення реакції за дії підвищеного тиску. Зменшення дифузії викликає також пригнічення транспорту речовин через мембрани.
Зауважимо, що на відміну від органічних рідин в’язкість води з підвищенням тиску від 1 атм (1,013 • 10s Па) до 1000 атм (1,013 • 108Па) зменшується. За вищого тиску, а також за наявності у воді розчинених речовин її в’язкість збільшується, але значно менше, ніж за дії тиску на органічні рідини.
Адаптація ферментів до тиску в морських тварин. Адаптація морських тварин до тиску залежить від того, мешкають вони постійно на великих глибинах, де високий тиск, чи здатні кожного дня чи протягом певних життєвих циклів вертикально мігрувати в товщі води.
При порівнянні активності ферменту фруктозодифосфатази, який відіграє основну роль у регуляції глюконеогеназу (каталізує реакцію фруктозодифосфат →фруктозо-6-фосфат+Фн), у форелі та глибоководної риби довгохвоста родини Coryphaenoides встановлено, що активність цього ферменту за фізіологічних концентрацій субстрату і за дії високого тиску у форелі знижується, а в довгохвоста незначно підвищується. Таке незначне збільшення активності фруктозодифосфатази в довгохвоста свідчить про те, що активність цього ферменту майже не залежить від тиску. Це відбувається тому, що посилення швидкості каталізованої реакції, яке спостерігається за підвищення тиску, компенсується зниженням активності ферменту, яке зумовлене зменшенням спорідненості ферменту із субстратом.
Тиск впливає не тільки на спорідненість ферментів із субстратами, а також із кофакторами, інгібіторами або активаторами тощо. Так, наприклад, для тієї ж фруктозодифосфатази змінюється спорідненість із Mg2+, який бере участь у каталізованій реакції. За високого тиску й низьких концентрацій Мg2+-залежна активність цього ферменту у форелі інгібується, а за високого тиску й концентрацій Mg2+ — активується. У довгохвоста спорідненість ферменту із Mg2+ за зміни тиску майже не змінюється. Аналогічні ефекти спостерігаються також за взаємодії фруктозодифосфатази з регулятором її активності — внутрішньоклітинним АМФ.
В обміні глюкози важливу роль відіграє ще один фермент — піруваткіназа, який каталізує таку реакцію:
![]()
Швидкість цієї реакції за дії високого тиску знижується.
Глибоководні риби (наприклад, довгохвіст Coryphaenoides) і мешканці середніх глибин здатні до вертикальної міграції (приміром, морський окунь Ectreposebastes imus), значно менш чутливі до підвищеного тиску, ніж поверхневі (наприклад, райдужна форель). У перших гальмування швидкості піруваткіназної реакції, викликане високим тиском, компенсується протилежними ефектами. Основні з них: збільшення спорідненості ферменту із субстратом, зняття інгибуючого ефекту високого тиску, зниження вмісту АТФ за рахунок активуючої дії фруктозодифосфату.
Подібний ефект, який виражається сумарним результатом протилежних змін у загальній каталітичній здатності ферменту, притаманний не тільки фруктозодифосфатазам і піруваткіназам, а й багатьом ферментам глибоководних організмів.