БИОХИМИЯ И МОЛЕКУЛЯРНАЯ БИОЛОГИЯ - В. ЭЛЛИОТ - 2002
ГЛАВА 15. МЕТАБОЛИЗМ АМИНОКИСЛОТ
При нормальном пищевом рационе переваривание белков в тонком кишечнике приводит к всасыванию довольно большого количества аминокислот. Эти аминокислоты поступают в воротную вену и доставляются кровотоком прямо в печень. Все клетки, за исключением некоторых высокоспециализированных (таких, например, как эритроциты), используют аминокислоты для синтеза белков и множества других веществ: компонентов мембран, нейромедиаторов, гема и т. п. Поэтому все клетки обладают специальными системами транспорта аминокислот, поскольку последние в ионизированном состоянии не могут преодолеть липидный бислой плазматических мембран.
Какой-либо специальной формы хранения аминокислот, подобно высокомолекулярным полисахаридам, которые при необходимости расщепляются до мономеров, не существует. Поэтому резервными для аминокислот веществами служат все функциональные белки, но основными здесь являются белки мышц, поскольку их больше всего. Однако эти белки участвуют в сократительной деятельности мышц, и при их интенсивном использовании для удовлетворения потребностей в аминокислотах, например, при глюконеогенезе в печени, наблюдается мышечная атрофия. Такая ситуация чревата для человека неприятностями, поскольку в ходе эволюции мы утратили способность синтезировать половину (10 из 20) аминокислот (их называют незаменимыми). Любопытно, что к их числу относятся и те аминокислоты, синтез которых включает особенно много стадий и требует большого числа специализированных ферментов, кодируемых многими генами. Иными словами, речь идет об аминокислотах, которые «дороги» в производстве.
Почему так получилось, можно только гадать. Возможно, что это - чисто экономическая мера, так как выгоднее получать самые сложные аминокислоты с пищей, самостоятельно производя лишь самые простые. В то же время, если бы человек получал все необходимые продукты от дикой природы, его пищевой рацион, вероятно, содержал бы все необходимые аминокислоты. В подобном случае неспособность синтезировать отдельные аминокислоты не так уж страшна по сравнению с отсутствием пищи, как таковой.
Развитие сельского хозяйства предоставило быстро размножающемуся человеческому роду источник химической энергии в виде растительных углеводов.
Растительная пища позволяет людям выжить, но далеко не всегда удовлетворяет их потребности в незаменимых аминокислотах, поскольку белки некоторых культивируемых растений, например, кукурузы, бедны лизином и триптофаном. Однако даже при длительном употреблении пищи, богатой полноценными белками, человек не может отложить про запас незаменимые аминокислоты. Лишь незначительная их доля используется по назначению, а невостребованная часть просто окисляется или перерабатывается в жиры или гликоген. В некоторых ситуациях это равносильно сжиганию бриллиантов ради обогрева.
Результатом неадекватного пищевого рациона, недостаточного даже по одной незаменимой аминокислоте, является патологическое состояние, называемое квашиоркор. Так как практически все белки содержат полный набор аминокислот, недостаток любой из них приведет к синтезу неполноценных белковых молекул. Это вызывает истощение, апатию, недостаточный рост, а также снижение уровня сывороточных белков в крови. Последнее обуславливает уменьшение онкотического давления крови и, по-видимому, является непосредственной причиной отеков.
Возникает порочный круг. Выстилающие тонкий кишечник клетки должны постоянно обновляться и производить пищеварительные ферменты. При квашиоркоре их способности к этому существенно снижены. В результате даже та пища, которая доступна, плохо переваривается и всасывается. От квашиоркора особенно страдают дети, поскольку растущему организму нужно синтезировать много белков.
Получается, что утрата в ходе эволюции способности к синтезу некоторых аминокислот и отказ от запасания их излишков оборачиваются для человека крупными неприятностями. Нельзя, правда, исключить, что у эволюции были на то серьезные причины. Например, промежуточные продукты биосинтеза незаменимых аминокислот могут быть токсичными для высших организмов. В частности, они могут нарушать развитие или работу мозга.
Баланс азота в организме
Аминокислоты участвуют в поддержании азотистого баланса в организме. Если организм потребляет азота столько же (главным образом в виде аминокислот),
сколько выделяет, то такое стационарное состояние называют сбалансированным по азоту. В период роста или при заживлении ран азота потребляется больше, чем выделяется - баланс считается положительным. Баланс азота становится отрицательным, если азота потребляется меньше, чем выделяется; это наблюдается, например, при голодании, когда мышечные белки перерабатываются в глюкозу, а азот выводится с мочой. У животных белки находятся в состоянии непрерывного кругооборота: они постоянно расщепляются и ресинтезируются. Хотя большая часть аминокислот, высвобождающихся при расщеплении белков, вовлекается в последующий синтез белка, мы ежедневно теряем в виде мочевины около 0,3% азота нашего организма.
Незаменимыми считаются аминокислоты, удаление которых из диеты приводит к отрицательному азотному балансу и, как результат, к остановке роста экспериментальных животных. Некоторые из таких аминокислот являются абсолютно незаменимыми: для человека это лизин, фенилаланин и триптофан. Ниже приводится список заменимых и незаменимых аминокислот для человека.
Заменимые аминокислоты |
Незаменимые аминокислоты |
Аланин |
Аргинин* |
Аспаргин |
Гистидин |
Аспаргиновая кислота |
Изолейцин |
Цистеин** |
Лейцин |
Глутаминовая кислота |
Лизин |
Глутамин |
Метионин |
Глицин |
Фенилаланин |
Пролин |
Треонин |
Серин |
Триптофан |
Тирозин*** |
Валин |
* Требуется лишь во время роста.
** Может синтезироваться из фенилаланина.
*** Может синтезироваться из метионина.
Тирозин не является абсолютно незаменимой аминокислотой, поскольку он может быть получен из фенилаланина, если тот поступает в организм в достаточном количестве. Точно так же млекопитающие могут синтезировать цистеин из другой незаменимой аминокислоты - метионина. В целом нельзя сформулировать четкие правила, которым подчинялась бы потребность организма в аминокислотах. «Первоклассные» белки богаты незаменимыми аминокислотами, а в растительных белках некоторых незаменимых аминокислот мало. Поскольку аминокислотный состав разных белков сильно различается, вегетарианская диета заведомо должна быть более разнообразной.
Общий метаболизм аминокислот
Общая схема метаболизма аминокислот представлена на рис. 15.1.
Рис. 15.1. Катаболизм аминокислот. Некоторые аминокислоты отчасти кетогенны, а отчасти глюкогенны
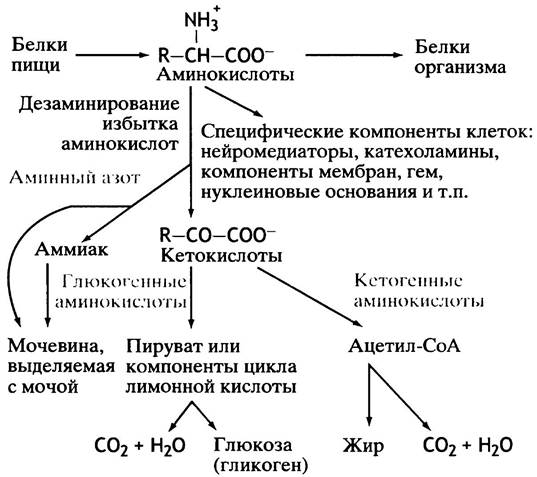
Аспекты метаболизма аминокислот
Избыток аминокислот (не использованных в синтезе белка и на другие специфические нужды) расщепляется для производства энергии или создания энергетических запасов (жиров или гликогена). Возникает ряд существенных вопросов, которые необходимо рассмотреть отдельно: как организм синтезирует заменимые аминокислоты? Как некоторые аминокислоты превращаются в другие физиологически важные низкомолекулярные соединения? В этой главе мы коснемся следующих проблем.
1. Как из аминокислот удаляются аминогруппы (иными словами, как происходит дезаминирование). Хотя все аминокислоты отличаются по строению, большинство из них дезаминируется сходным образом, что значительно упрощает изучение этой проблемы.
2. Что происходит с кетокислотами (углеродными скелетами), образующимися при дезаминировании аминокислот. У каждой из них своя собственная метаболическая судьба, и здесь мы рассмотрим лишь отдельные примеры, особо интересные или важные для понимания метаболизма в целом.
3. Как удаленный из аминокислот азот перерабатывается в мочевину.
4. Как синтезируются аминокислоты. У животных это касается, естественно, только заменимых аминокислот. Если есть соответствующая кетокислота (т. е. углеродный скелет аминокислоты), синтез часто сводится к обращению дезаминирования. Мы рассмотрим лишь несколько таких примеров. В бактериях и растениях все аминокислоты синтезируются по индивидуальным планам, а исходные вещества поступают из реакций общего метаболизма. Синтетические возможности животных ограничены существованием незаменимых аминокислот. Изучение путей биосинтеза всех аминокислот - это гигантский объем информации. Мы ограничимся здесь лишь наиболее интересными примерами.
5. Некоторые превращения аминокислот весьма любопытны и важны для создания целостной картины аминокислотного метаболизма. Часть из них также будет рассмотрена в этой главе.
Дезаминирование аминокислот
Сначала немного химии. Шиффовы основания образуются в результате обратимой реакции между карбонильной группой альдегида или кетона со свободной аминогруппой:
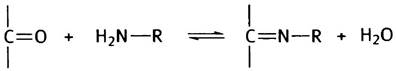
Эта реакция обратима, следовательно, Шиффово основание легко гидролизуется. Если R = Н, то в результате гидролиза высвободится аммиак (NH3). Таким образом, отщепление двух атомов водорода от аминокислоты приведет к дезаминированию, а связывание пары атомов водорода - к синтезу аминокислоты из кетокислоты и аммиака (для простоты приведены неионизированные формы соединений):
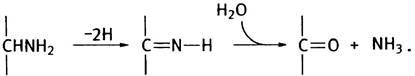
Теперь вернемся к биологическому дезаминированию. Одной из важнейших в метаболизме аминокислот является глутаминовая кислота, дезаминирование
которой катализирует глутаматдегидрогеназа. Она использует в качестве окислителя либо NАD+, либо NАDР+ (при физиологических значениях pH NH3 протонирован и находится в ионизированной форме - NН4+):
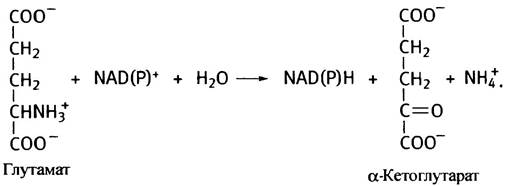
Глутаматдегидрогеназа - ключевой фермент дезаминирования, участвует в окислении многих аминокислот. Она аллостерически ингибируется АТР и GTP (это индикаторы высокого уровня энергии: запасы энергии большие - топлива не нужно) и активируется ADP и GDP. Увеличение содержания последних свидетельствует о необходимости окислительного фосфорилирования (энергетические запасы малы - нужно топливо).
α-Кетоглутарат участвует в цикле лимонной кислоты, что делает возможным окисление глутаминовой кислоты (после дезаминирования) до Н2O и СO2 Поскольку α-кетоглутарат может превращаться в оксалоацетат (см. рис. 8.12), глутаминовая кислота при определенных условиях может участвовать в синтезе глюкозы (см. главу 11, рис. 11.3). Таким образом, глутаминовая кислота принадлежит к числу глюкогенных аминокислот.
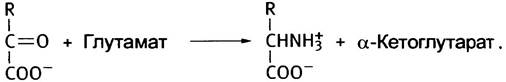
Для других аминокислот не существует соответствующих дегидрогеназ. Как же они дезаминируются? Для этого есть несколько специальных механизмов, но большинство из них основано на переносе аминогруппы с аминокислот на α-кетоглутарат, в результате чего образуется соответствующая кетокислота и глутамат. Последний дезаминируется глутаматдегидрогеназой. Иными словами, дезаминирование других аминокислот протекает в две стадии. Первая называется трансаминированием (или переаминированием), а вторая - дезаминированием.
Стадия трансаминирования может быть представлена следующим образом:
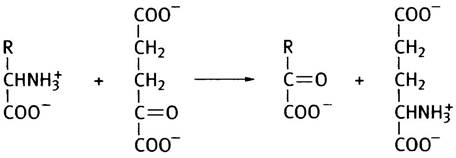
Предположим, что R = CH3, следовательно, аминокислота - аланин. Дезаминирование аланина происходит в соответствии со следующей схемой:
Аланин + α-Кетоглутарат —> Пируват + Глутамат (1)
Глутамат + NAD+ + Н2O —> α-Кетоглутарат + NADH + NH+4 (2)
Итого:
Аланин + NAD+ + Н2O —> Пируват + NADH + NH+4.
В совокупности обе стадии этого процесса - транс- аминирование и дезаминирование глутамата - по понятной причине называют трансдезаминированием. Ферменты, катализирующие трансаминирование, называют трансаминазами, или аминотрансферазами. Известно много трансаминаз, специфичных к различным аминокислотам, и большинство из них может быть дезаминировано с их участием.
Обратимость трансаминазной реакции означает, что аминокислоту можно синтезировать из соответствующей кетокислоты (однако кетокислоты соответствующих незаменимых аминокислот не синтезируются в организме). Примером трансаминирования может служить малат-аспартатный челнок (см. с. 116), в котором задействована обратимая реакция:
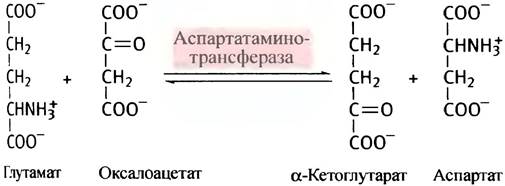
Механизм реакций трансаминирования (переаминирования)
В активных центрах всех трансаминаз имеется прочно связанный кофермент пиридоксаль-5'-фосфат (ПФ). Он участвует во многих ферментативных превращениях аминокислот, выступая в качестве электрофильного интермедиата. Его главные функции заключаются в том, чтобы сначала в качестве акцептора принять аминогруппу от аминокислоты, а затем в качестве донора передать ее кетокислоте. Все это происходит при участии одного фермента. Как это часто бывает, кофермент оказывается
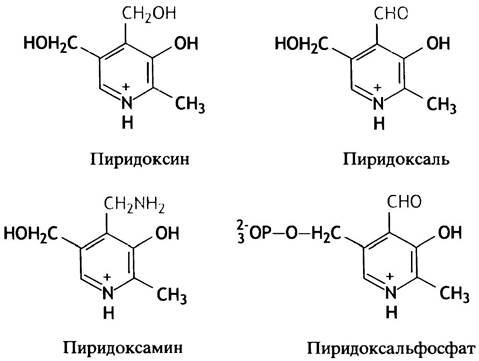
I производным витамина (в данном случае В6). В действительности группа витамина В6 включает три родственных вещества: пиридоксапь, пиридоксин и пиридоксамин. Все они в организме превращаются в пиридоксальфосфат (рис. 15.2).
Рис. 15.2. Структура соединений группы витамина В6 и кофактора трансаминазы — пиридоксальфосфата
«Рабочей группой» пиридоксальфосфата служит альдегидная группа -СНО. Реакция трансаминирования в общем виде может быть представлена следующим образом:
Е-ПФ + аминокислота 1 <-> Е-ПФ-NН2 + кетокислота 1
Е-ПФ-NН2 + кетокислота 2 <-> Е-ПФ + аминокислота 2
Здесь ПФ - пиридоксальфосфат, а ПФ-NH2 - пиридоксаминфосфат.
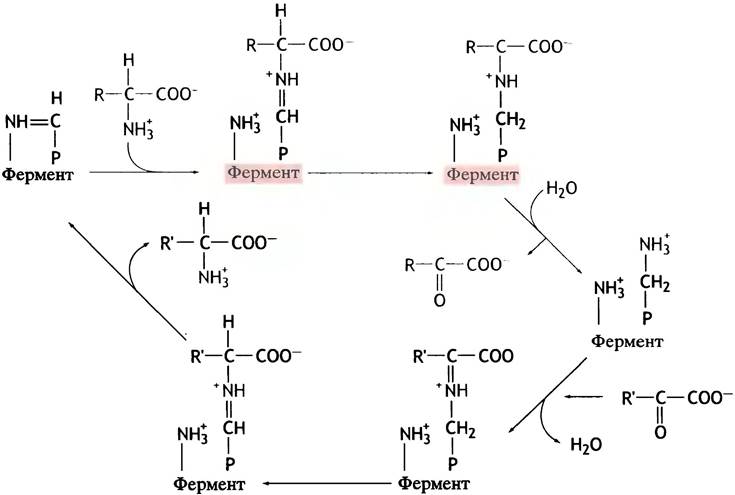
Механизм этой реакции показан на рис. 15.3. Обе реакции протекают в активном центре трансаминазы, а пиридоксальфосфат и пиридоксаминфосфат прочно связаны с этим ферментом.
Рис. 15.3. Механизм трансаминирования (упрощенное изображение). Р-СН = NН- - комплекс пиридоксальфосфата с аминогруппой остатка лизина белка. Р-СН2-NН3+ - пиридоксальфосфат. Прямая реакция (красные стрелки) приводит к превращению аминокислоты в кетокислоту, а пиридоксальфосфата - в пиридоксаминфосфат. Обратная реакция (черные стрелки) представляет собой переаминирование между кетокислотой и аминокислотой
Рассмотренный путь трансдезаминирования является наиболее общим для аминокислот, однако некоторые из них теряют свои аминогруппы по-другому.
Особые механизмы дезаминирования
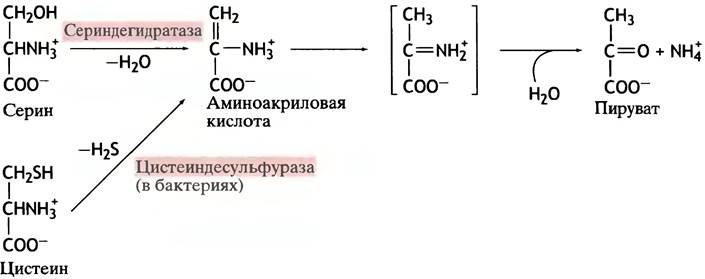
Серин (гидроксилсодержащая аминокислота) дезаминируется в ходе реакции дегидратации, катализируемой специфической дегидратазой. Цистеин, отличающийся от серина тем, что содержит тиольную группу вместо гидроксильной, дезаминируется после отщепления Н2S. В обоих случаях продуктом реакции является пируват (рис. 15.4).
Рис. 15.4. Превращение серина и цистеина в пируват
Судьба кетокислоты, или углеродных скелетов дезаминированных аминокислот
Учитывая роль аминокислот в общем метаболизме, некоторые из них называют глюкогенными, а другие - кетогенными. Термин кетогенная аминокислота означает, что в ходе ее метаболизма образуется ацетил-СоА, который далее превращается в кетоновые тела. Такое определение внешне противоречит утверждению, что кетоновые тела возникают лишь в условиях чрезмерного метаболизма жиров (см. с. 85), а в нормальных условиях ацетил-СоА не расходуется на их синтез. В действительности термин кетогенные возник очень давно, когда на голодающих животных в качестве тест-системы изучали судьбу полученных ими с пищей аминокислот. Именно в этих условиях любое повышение уровня ацетил-СоА сопровождалось нарастанием в крови легко обнаруживаемых кетоновых тел. В нормальных условиях кетоновые тела из кетогенных аминокислот не образуются, а истинный смысл термина в том, что эти аминокислоты превращаются не в пируват, а в ацетил-СоА. Глюкогенные аминокислоты стимулируют повышение уровня глюкозы в крови (у диабетиков - в моче).
Аспарагиновая кислота дезаминируется в оксалоацетат — один из метаболитов цикла лимонной кислоты, который может превращаться в глюкозу. Следовательно, аспарагиновая кислота - глюкогенная аминокислота. Сюда же относятся глутаминовая кислота и аланин, которые превращаются в α-кетоглутарат и пируват, а также серин, цистеин и ряд других аминокислот.
Некоторые аминокислоты являются одновременно и кетогенными, и глюкогенными. Так, при метаболизме фенилаланина образуется и ацетил-СоА, и фумарат, участвующий в цикле лимонной кислоты. Из 20 аминокислот только две - лейцин и лизин - исключительно кетогенные. О расщеплении изолейцина, метионина, треонина и валина см. на стр. 136.
Метаболизм фенилаланина
Фенилаланин - ароматическая аминокислота, избыток которой в норме превращается в тирозин ферментом фенилаланингидроксилазой (рис. 15.5). Этот фермент интересен тем, что два атома водорода в реакции поставляются донором электронов - коферментом тетрагидробиоптерином.
Рис. 15.5. Нормальный и аномальный метаболизмы фенилаланина. RН4 - тетрагидробиоптерин; RН2 - дигидробиоптерин
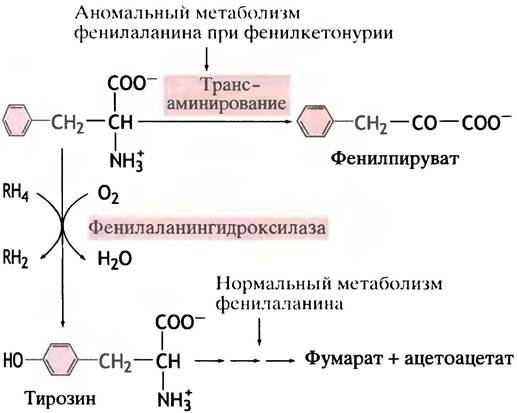
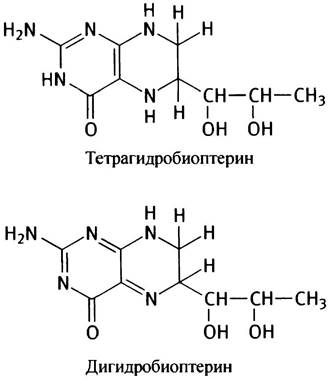
Может показаться странным, что для данной реакции необходимы как кислород, так и восстанавливающий агент, но такое явление достаточно распространено, и мы еще будем с ним встречаться. Дело в том, что один атом кислорода используется здесь для образования гидроксильной группы в ароматическом кольце. Второй атом кислорода восстанавливается в молекулу Н2O, причем два атома водорода поставляются ему тетрагидробиоптерином. Специальная ферментная система, использующая NАDН в качестве восстановителя, превращает дигидробиоптерин в исходный тетрагидробиоптерин, так что последний действует как катализатор.
Фенилаланингидроксилаза принадлежит к классу ферментов монооксигеназ (они вводят в субстрат один атом кислорода) или к классу оксигеназ смешанного действия, так как оксигенируются два соединения - аминокислота и пара атомов водорода (см. с. 210, где обсуждаются различия между окислением - удалением электронов, и оксигенированием - введением в молекулу атома кислорода).
Сам фенилаланин в норме не подвергается дезаминированию; предварительно он должен превратиться в тирозин. Известен сравнительно часто встречающийся генетический дефект, при котором превращение фенилаланина в тирозин затруднено или полностью блокировано из-за недостатка фермента или, реже, тетрагидробиоптерина. Накапливающийся при этом фенилаланин вынужденно подвергается дезаминированию в аномальный метаболит - фенилпируват, который сразу выводится из организма с мочой (см. рис. 15.5). Это заболевание называют фенилкетонурией (ФКУ). Оно особенно опасно для младенцев, поскольку фенилпируват необратимо повреждает их мозг и вызывает раннюю смерть. Если болезнь выявлена сразу после рождения (по анализу мочи, а еще лучше - по анализу крови на наличие фенилпирувата), ребенку назначают диету, бедную фенилаланином, но содержащую достаточное количество тирозина. Это позволяет предотвратить заболевание и нормализовать развитие. Почему фенилпируват так разрушительно действует на мозг, пока неизвестно.
Довольно любопытно еще одно генетическое нарушение, которое называют болезнью кленового сиропа. При нем в организме накапливаются кетокислоты, соответствующие трем алифатическим аминокислотам: лейцину, изолейцину и валину. Это заболевание, получившее столь странное название по характерному запаху мочи, также сопряжено с нарушениями биохимических превращений в мозге. Оно встречается гораздо реже, чем фенилкетонурия.
Еще одно генетическое заболевание - алкаптонурия внешне проявляется в том, что моча, оставленная на воздухе, быстро чернеет. Причиной является нарушение расщепления тирозина, при котором в организме накапливается один из промежуточных продуктов - гомогентизиновая кислота. Она представляет собой дифенол, который, окисляясь кислородом воздуха, превращается в черный пигмент.
Метионин и перенос метильных групп
Метионин - одна из незаменимых аминокислот.
![]()
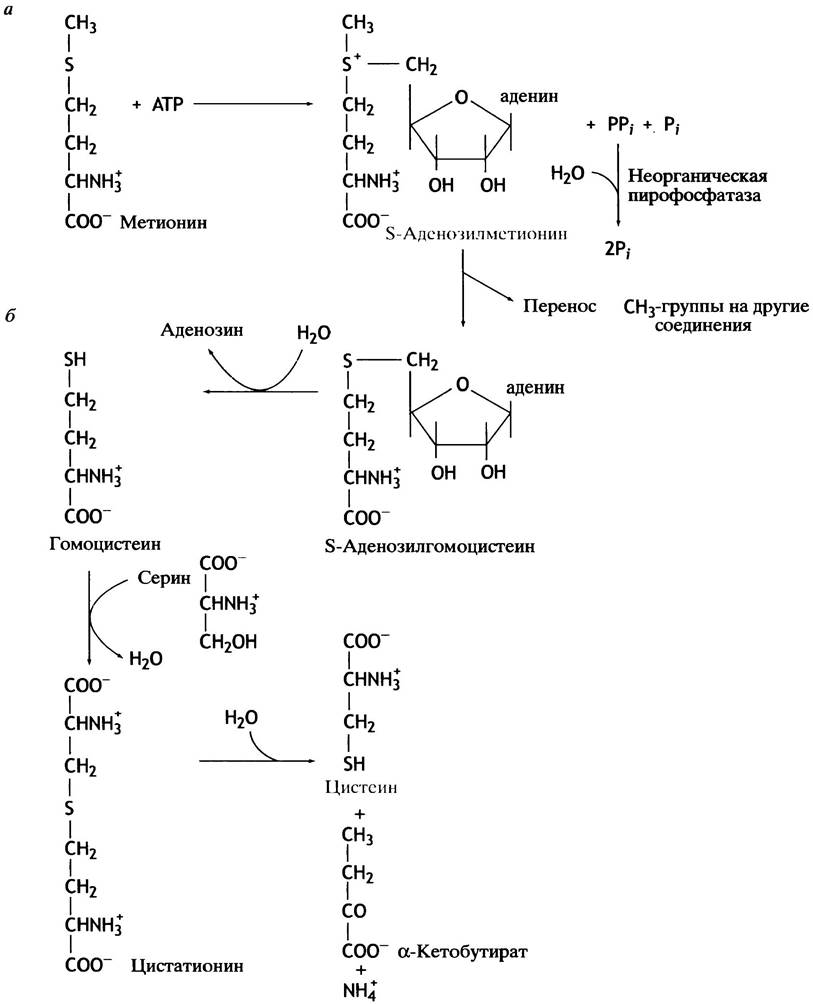
Самая важная часть метионина - метальная группа. Эти группы играют огромную роль в жизни клетки. Многие соединения подвергаются метилированию, причем именно метионин служит донором метальной группы, которая переносится на другие вещества. Сам метионин представляет собой устойчивое соединение и не может служить метилирующим агентом. Однако его метальная группа активируется, когда метионин, реагируя с АТР, превращается в сульфониевый катион S-аденозилметионин, или SAM(рис. 15.6).
Наличие группы, обладающей повышенной реакционной способностью, делает термодинамически благоприятным ее перенос с этого вещества на другие соединения. Три фосфатные группы АТР, обеспечивающего синтез S-аденозилметионина энергией, превращаются в пирофосфат РРi и неорганический Рi, а затем РРi расщепляется до двух молекул Рi. (см. рис. 15.6). Перенос метильной группы с S-аденозилметионина на другие соединения катализируют трансметилазы. При этом S-аденозилметионин превращается в S-аденозилгомоцистеин. Последний гидролизуется в гомоцистеин - метионин, у которого вместо S-CH3-группы появляется - SH-группа. Далее тиольная группа с гомоцистеина переносится на серин с образованием цистеина (см. рис. 15.6). Промежуточное соединение в этом процессе (цистатионин) при определенном генетическом дефекте накапливается в организме и выводится из него с мочой. Это заболевание называют цистатионурией.
Рис. 15.6. Синтез S-аденозилметионина из метионина (а), а цистеина — из гомоцистеина (б)
Куда переносятся метильные группы?
Продуктами метилирования S-аденозилметионином являются креатин (см. с. 380), фосфатидилхолин (см. с. 55), адреналин (см. с. 200), азотистые основания нуклеиновых кислот (кроме тимина).
Синтез аминокислот
В организме синтезируются только заменимые аминокислоты. Мы не будем здесь касаться всех деталей этих процессов, химия которых столь же разнообразна, сколь и специфична. Наша задача - рассказать о наиболее интересных и важных аспектах этой проблемы и продемонстрировать, как аминокислоты синтезируются из промежуточных соединений гликолиза и цикла лимонной кислоты.
На самом деле всего пять таких соединений - 3-фосфоглицерат, фосфоенолпируват, пируват, оксалоацетат и α-кетоглутарат, вместе с двумя моносахаридами пентозофосфатного пути, служат предшественниками всех 20 аминокислот, которые синтезируются в бактериях и растениях.
Синтез глутаминовой кислоты
Дезаминирование глутаминовой кислоты осуществляется глутаматдегидрогеназой, кофакторами которой служат NАD+ или NАDР+. Реакция обратима, но, по-видимому, для животных образование глутамата из аминокислоты - процесс менее существенный, чем трансаминирование α-кетоглутарата. Донорами аминогруппы при этом служат другие аминокислоты, например, аланин или аспарагиновая кислота. У прокариот существует и другой путь аминирования α-кетоглутарата, который реализуется при малых концентрациях NН4+ и требует притока энергии.
Синтез аспарагиновой кислоты и аланина
Эти аминокислоты образуются в клетках при транс- аминировании оксалоацетата (R = -СН2СОО-) и пирувата (R = -СН3):
Синтез серина
Серин синтезируется в три стадии из промежуточного вещества гликолиза - 3-фосфоглицерата. Сначала 3-фосфоглицерат окисляется в кетокислоту - 3-фосфогидроксипируват:
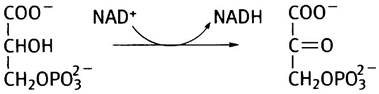
Затем эта кетокислота подвергается трансаминированию глутаминовой кислотой и превращается в 3-фосфосерин, который далее гидролизуется до серина и Рi.
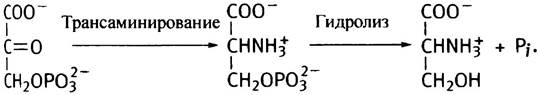
Синтез глицина
Глицин (NН3+-СН2-СОО-) - простейшая из α-аминокислот. Синтез его осуществляется путем удаления концевой гидроксиметиленовой группы серина. Реакция протекает с участием кофермента -тетрагидрофолиевой кислоты, которая служит переносчиком одноуглеродных групп. Такого рода перенос играет важную роль в синтезе нуклеотидов (см. главу 18).
Синтез других соединений из аминокислот
Широкий круг низкомолекулярных физиологически активных соединений синтезируется в организме из аминокислот. Амины образуются в результате декарбоксилирования аминокислот:
RСН2NН3+СОO- —> RСН2NН3+ + СO2.
Катехоламины, к числу которых принадлежат гормоны дофамин, адреналин и норадреналин, свое название получили за структурное сходство с катехолом - 1,2-дигидроксибензолом.
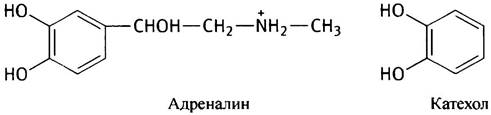
Среди соединений, образующихся из аминокислот, встречаются нейромедиаторы:y-аминобутират (GABA; от англ. Gamma AminoButyric Acid), 5-гидрокситриптамин и те же катехоламины. Гормон тироксин синтезируется из тирозина. Этот далеко не полный перечень показывает, что аминокислоты служат предшественниками многих биологически важных веществ.
Что происходит с аминогруппами после их удаления из аминокислот? Цикл мочевины
Аминный азот катаболизируемых аминокислот выводится из организма млекопитающих с мочой в виде мочевины - инертного водорастворимого нетоксичного вещества. Мочевина образуется в печени при отщеплении гуанидиновой группы от аргинина с помощью гидролитического фермента аргиназы. Попутно образуется орнитин -аминокислота, не входящая в состав белков.
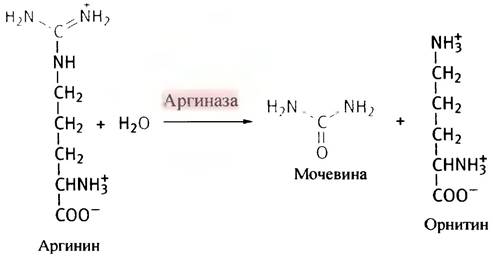
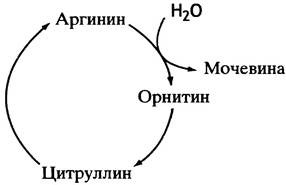
Для превращения орнитина обратно в аргинин используется атом углерода из СO2 и аминный азот, высвобождающийся в ходе превращения всех 20 катаболизируемых аминокислот. Аргинин-орнитиновый цикл стал первым из описанных метаболических циклов. Кребс (который позже открыл цикл лимонной кислоты) и Хенселейт обнаружили, что если к клеткам печени добавить аргинин, то количество образовавшейся после этого мочевины существенно превышает количество использованной аминокислоты. То же самое происходит при добавлении орнитина. Ученые заключили, что превращение обеих аминокислот - процесс циклический, и в него вовлечены как аргинин, так и орнитин.
Образование аргинина из орнитина протекает в несколько стадий. В качестве промежуточного продукта образуется еще одна аминокислота - цитруллин (как и орнитин, она не входит в состав белков).
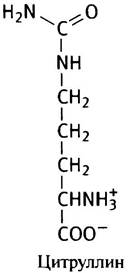
Подобно аргинину и орнитину, цитруллин стимулирует синтез мочевины клетками печени. Так был окончательно расшифрован знаменитый цикл мочевины (рис. 15.7).
Рис. 15.7. Цикл образования мочевины из аргинина. Включение в цикл азота и СO2 обсуждается в тексте
Механизм синтеза аргинина
Первый этап синтеза аргинина - образование цитруллина - протекает в митохондриальном матриксе. Он начинается с того, что из ионов аммония и СO2 образуется карбамоилфосфат, который представляет собой смешанный ангидрид карбаминовой (NН2СООН) и фосфорной кислот. Карбамоилфосфат - макроэргическое соединение, мощный ацилирующий агент.
Его синтез катализирует карбамоилфосфатсинтетаза в следующей реакции:
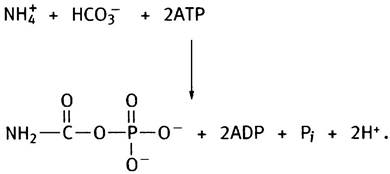
На синтез каждой его молекулы расходуются 2 молекулы АТР. Одна из них, расщепляясь до ADP и Рi, обеспечивает образование из аммония и СO2 карбамата, а вторая участвует в его фосфорилировании. Далее карбамоильная группа карбамоилфосфата с помощью фермента орнитинтранскарбамоилазы переносится на орнитин, превращая его в цитруллин (орнитин представлен в виде R-NH3+):
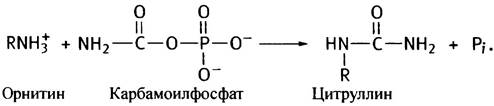
Превращение цитруллина в аргинин
Второй этап синтеза аргинина протекает в цитозоле и состоит в том, что карбонильная группа (С = O) в цитруллине превращается в имидную (C = NH) группу аргинина. Карбонил цитруллина значительно менее реакционноспособен, чем кетонный карбонил в кетокислотах, поэтому такое превращение не может быть произведено как трансаминирование. В действительности оно происходит в две стадии. На первой - цитруллин с участием АТР конденсируется с аспартатом, превращаясь в аргининосукцинат:
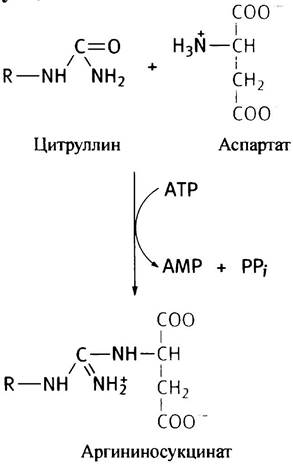
Название продукта этой реакции обусловлено тем, что его молекула по структуре напоминает аргининовое производное сукцината, хотя при его расщеплении аргининосукцинатлиазой образуются аргинин и фумарат, а не сукцинат:
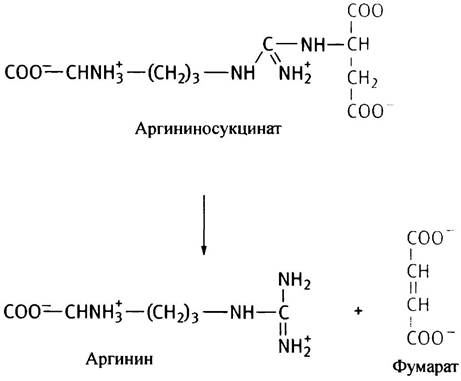
Полностью цикл мочевины представлен на рис. 15.8. В основном он регулируется путем изменения содержания ферментов. Их количество возрастает как при значительном поступлении аминокислот из пищи, так и при голодании, когда расщепляются мышечные белки.
Рис. 15.8. Ферменты цикла мочевины. Уровень ферментов коррелирует с количеством белка, потребляемого в виде пищи. Цикл аллостерически регулируется на стадии карбамоилфосфатсинтетазы (по-видимому, N-ацетилглутаматом). Орнитин преобразуется в цитруллин внутри митохондрий, тогда как другие стадии цикла протекают в цитоплазме
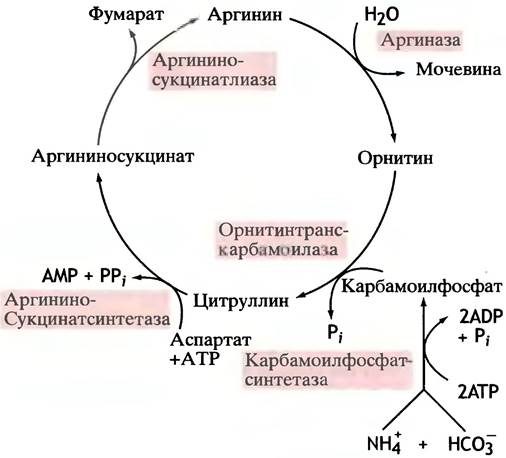
Кроме того, карбамоилфосфатсинтетаза аллостерически регулируется N-ацетилглутаматом, уровень которого коррелирует с концентрацией аминокислот.
Как аминный азот транспортируется в печень для переработки в мочевину
Глутамин-транспортная форма аммиака в крови
Аммиак, образующийся при дезаминировании аминокислот, токсичен. И потому его содержание в крови должно быть предельно мало, иначе возможно нарушение функции мозга и развитие комы. Поэтому в свободной форме в печень он не транспортируется. Аммиак взаимодействует с глутаминовой кислотой, и с помощью фермента глутаминсинтетазы образуется глутамин (амид глутаминовой кислоты). В качестве промежуточного соединения при этом появляется y-глутамилфосфат - смешанный ангидрид глутаминовой и фосфорной кислот. Это макроэргическое соединение, способное взаимодействовать с ионами аммония (обе реакции протекают в активном центре синтетазы).
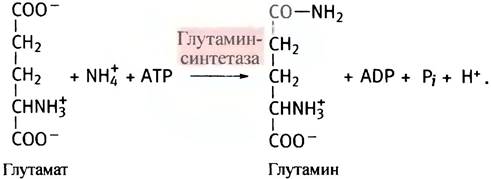
Источником глутамата при этом служит α-кетоглутарат из цикла лимонной кислоты, который подвергается трансаминированию другими аминокислотами. Глутамин переносится кровью в печень, где гидролизуется глутаминазой, а высвободившийся аммиак используется для синтеза мочевины.
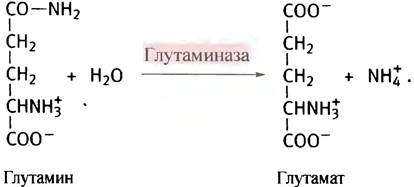
Глутаминаза есть и в почках. Там ее функция состоит в том, чтобы нейтрализовать аммиаком кислоты, выводимые из крови. Помимо того, что глутамин служит переносчиком аммиака и является одной из 20 аминокислот, входящих в состав белков, он участвует в синтезе некоторых других метаболитов. В этом случае он используется в форме глутаминамида в качестве источника азота.
Аланин - транспортная форма аминного азота в крови
Около 30% аминного азота, который поступает в печень после расщепления мышечных белков, сосредоточено в аланине. Разумеется, доля аланина в белках гораздо ниже; в основном аланин образуется при трансаминировании пирувата другими аминокислотами. Попадая в печень, аланин подвергается там дезаминированию. Аммиак используется на производство мочевины, а пируват - глюкозы. Последняя возвращается с кровью в мышцы, замыкая тем самым глюкозо-аланиновый цикл переноса аммиака (рис. 15.9).
Рис. 15.9. Глюкозо-аланиновый цикл поставляет азот (в виде аланина) из мышц в печень, а из печени возвращает в мышцы глюкозу
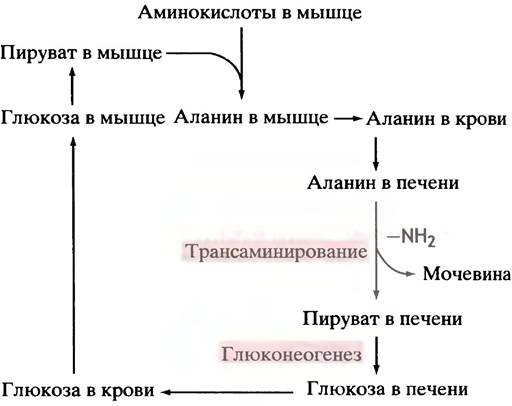
При голодании этот цикл приобретает особенно важное значение. После исчерпания запасов гликогена печень должна снабжать глюкозой мозг и другие нуждающиеся в ней ткани. Главным источником метаболитов, используемых печенью для глюконеогенеза, являются аминокислоты, образующиеся при расщеплении мышечных белков. О регуляции такого расщепления будет рассказано в главе 22. Многие аминокислоты еще в мышцах превращаются в пиру ват, который транспортируется в печень в форме аланина. Еще раз подчеркнем, что глюкозо-аланиновый цикл не увеличивает количество глюкозы, а лишь является способом разделения метаболизма аминокислот между мышцами и печенью, а также безвредным механизмом транспорта в печень аминного азота.
Вопросы к главе 15
1. Объясните, как окисление аминокислот может привести к их дезаминированию.
2. Какие аминокислоты дезаминируются посредством окисления?
3. Опишите подробно, как дезаминируется аланин.
4. Какой кофермент участвует в переаминировании? Каково его строение и как происходит переаминирование?
5. Как дезаминируются серин и цистеин?
6. Что означают термины «кетогенные» и «глюкогенные» по отношению к аминокислотам? Назовите чисто кетогенные аминокислоты.
7. Что представляет собой заболевание фенилкетонурия?
8. Какова роль тетрагидробиоптерина при гидроксилировании фенилаланина?
9. Метионин - источник метальных групп в некоторых биохимических процессах. Объясните, как активируется метионин в реакциях биологического метилирования.
10. Опишите реакции, входящие в цикл мочевины.
11. Почему содержание ферментов цикла мочевины возрастает как при обильном белковом питании, так и при голодании?
12. Как аммиак и аминный азот попадают из периферических тканей в печень для образования мочевины?