ФЛАВОНОИДЫ: БИОХИМИЯ, БИОФИЗИКА, МЕДИЦИНА - Тараховский Ю. С. - 2013
ЧАСТЬ 1. ВАЖНЕЙШИЕ ФЛАВОНОИДЫ
1.8. Халконы
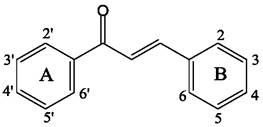
Название «халкон» было предложено польским химиком Станиславом Костанеки (Stanislaw Kostanecki). Оно происходит от греческого слова «халкос», что означает «медь». Химически халконы или 1,3-диарил-2-пропен-1-оны представляют собой флавоноиды с открытой цепью (рис. 16), в которой два ароматических кольца соединены трехуглеродной α, β-ненасыщенной карбонильной системой. Ариловые кольца в большинстве случаев гидроксилированы. Халконы могут иметь цис- и трансформы, но трансформа термодинамически более устойчива. При этом α, β-ненасыщенные кетонные группы, вероятно, ответственны за большинство наблюдаемых биологических свойств халконов, поскольку во всех биологически активных молекулах эти группы присутствуют, а их удаление сопряжено с потерей активности.
Рис. 16. Нумерация атомов углерода в молекулах халконов.
Эти вещества проявляют выраженную антиканцерогенную активность, действуя на множество различных мишеней в системе клеточной сигнализации. Кроме того, они представляют интерес как антиоксиданты, антигистаминные и противовоспалительные агенты, обладают антибактериальной активностью и убивают простейших паразитов. Особенностью халконов является сравнительная простота химического строения, что позволяет на их основе синтезировать большое разнообразие молекул, обладающих биологической активностью и, в некоторых случаях, лекарственными свойствами. Однако и среди халконов растительного происхождения много веществ, представляющих интерес для медицины (рис. 17).
Рис. 17. Некоторые халконы и дигидрохалконы, присутствующие в растениях.
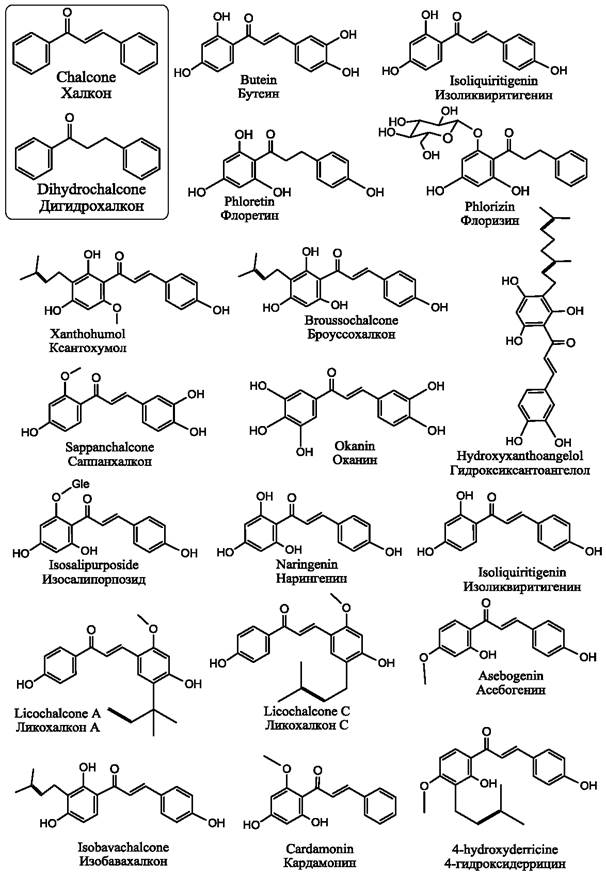
Среди наиболее изученных халконов следует назвать флоретин и его гликозид флоризин, присутствующие в листьях яблони. Эти флавоноиды давно известны как ингибиторы адсорбции глюкозы клетками кишечного эпителия и эпителия почек. Флоретин также способен ингибировать транспорт мочевины в различных клетках, включая клетки почечного эпителия, печени, эритроциты.
Большое количество исследований посвящено также бутеину, получившему название от древесного растения семейства бобовых бутея односеменная (Butea monosperma), произрастающего в Пакистане, Вьетнаме, Малайзии. Бутеин обнаружен также в тканях лакового дерева (Toxicodendron vemicifluum или Rhus verniciflua - устаревшее название), и розового дерева (Dalbergia odorífera), которые произрастают в Китае, Корее и Японии. Сок лакового дерева вызывает дерматиты, поскольку содержит токсин урушиол. Однако после затвердевания на воздухе он образует гладкую глянцевую поверхность, благодаря чему используется в качестве лака при изготовлении традиционных изделий.
Древесина розового дерева используется при изготовлении мебели, а также в народной медицине. Присутствующий в соке этих растений флавоноид бутеин является мощным антиоксидантом и противовоспалительным агентом, имеющим медицинское значение. В то же время, бутеин способен инициировать окислительный стресс в клетках злокачественных опухолей, благодаря продуцированию активных форм кислорода, что вызывает апоптоз клеток рака.
Изоликвиритигенин присутствует в корнях и корневищах солодки (Glycyrrhíza glabra), из которой изготавливают лакричные сладости. Изоликвиритигенин интенсивно исследуется в последние годы. Этот халкон известен своим действием на центральную нервную систему (на рецепторы гамма-аминомаслянной кислоты), благодаря чему, как недавно было обнаружено, может оказывать не только успокаивающее, но и снотворное действие. Он обладает также антиканцерогенной активностью, о чем будет подробнее сказано далее. В последние годы большое количество исследований посвящено также пренилированному халкону ксантохумолу, присутствующему в шишках хмеля и пиве.
1.8.1. Антиоксидантная активность
3,4-дигидроксихалконы, такие как бутеин, саппанхалкон (sappan- chalcone) и оканин, проявляют наиболее выраженную антиоксидантную активность в концентрациях 0,025-0,1 %. Присутствие гидроксильных групп при атоме углерода С-2’ в кольце А или катехольной группы в кольце В благоприятно сказывается на проявлении антиоксидантных свойств, тогда как отсутствие α, β-двойной связи снижает активность. Броуссохалкон А из японского бумажного дерева (Broussonetia papyrifera) способен ингибировать перекисное окисление липидов в гомогенате мозга крысы с IC50= 0,63 ± 0,03 мкМ, что по активности сравнимо с гидрокситолуеном. Его способность связывать радикалы может превышать активность а-токоферола. На макрофагах также было показано, что броуссохалкон А подавляет продуцирование NO с IC50= 11,3 мкМ. Другой халкон, 3-гидроксиксантоангелол, полученный из стеблей эндемического японского растения Angelica keiskei, обнаруживает еще большую активность в отношении радикалов (IC50 = 0,5±1,1 мкМ), что в десять раз выше, чем ресвератрол, используемый в качестве контроля (IC50= 5,3 мкМ). Ксантохумол и некоторые его метилированные производные, полученные из шишек хмеля и присутствующие в пиве, в концентрации 0,1-2,0 мкМ проявляли более высокую антиоксидантную активность, чем феруловая и p-кумаровая кислоты. Изосалипурпозид, полученный из цветов голубого лотоса (Nymphaea caerulea), произрастающего в Восточной Африке, Индии и Таиланде, обладает антиоксидантной активностью (IC50= 1,7 мкг/мл), превышающей активность витамина С (IC50 = 1,95 мкг/мл). Некоторые халконы способны влиять на системы клетки, ответственные за регуляцию уровня реактивных форм кислорода в цитоплазме. Так, бутеин ингибирует TNF-α- зависимое появление активных форм кислорода, что является частью противовоспалительной активности этого халкона.
1.8.2. Антиканцерогенное действие
Способность халконов проявлять антиканцерогенную активность стала причиной значительного роста числа исследований этих веществ в последние несколько лет. Поразительно, что, являясь мощными антиоксидантами в нормальных клетках, халконы проявляют выраженную прооксидантную активность в клетках опухолей, благодаря которой наблюдается ингибирование их пролиферации и апоптоз. Так, бутеин, который, как упоминалось выше, в норме оказывает противовоспалительное действие благодаря антиоксидантной активности, в клетках опухолей проявляет прооксидантные свойства, которые осуществляются через влияние на регуляторные системы клетки. Накопление в цитоплазме активных форм кислорода (ROS) наблюдалось вследствие ингибирования фактора некроза опухолей(TNF-α), активации протеинкиназы, участвующей в регуляции экстраклеточного сигнала (ERK) и митоген- активируемой протеинкиназы p38. Похожий механизм апоптоза клеток с участием ROS наблюдался при действии бутеина на клетки нейробластомы и клетки печени. Активация ROS была обнаружена также при действии ксантоангелола на клетки рака простаты и действии изоликвиритигенина на клетки рака яичников. Активация ROS также может повышать чувствительность опухоли к облучению в условиях радиотерапии, как это было показано на клеткахгепатоклеточнойкарциномы Hep2 при обработке изоликвиритигенином. Гидроксихалконы оказывают цитотоксическое действие на клетки меланомы путем индуцирования митохондриального глутатиона и расщепления АТФ.
Однако были обнаружены и другие механизмы подавления роста опухолей с участием халконов. Так, в клетках меланомы бутеин способен вызывать апоптоз посредством увеличения проницаемости мембран митохондрий, что приводит к выходу в цитоплазму цитохрома с и активации каспаз 3 и 9. Антиканцерогенный халкон нарингенин, присутствующий в цитрусовых и томатах, а также его гликозид изосалипурпозид, полученный из японского растения Angelica keiskei, проявляют токсичность против клеток нейробластомы, влияя на митохондрии, и не оказывают токсического действия в отношении нормальных клеток. Аналогичное явление увеличения проницаемости митохондрий было обнаружено при действии ксантоангелола на клетки рака матки.
На клетках мезотелиомы плевры, вызванной хроническим воспалительным процессом, например, при попадании в легкие асбестовой пыли, было обнаружено, что бутеин оказывает ингибирующее действие на регуляторы транскрипции NF-kB, а также STAT3, участвующий в экспрессии белков семейства STAT, ответственных за активацию различных киназ. Это подавляет способность клеток к миграции и продуцированию клонов. Способность бутеина препятствовать росту опухоли простаты была показана не только in vitro, но также in vivo. При этом было обнаружено влияние этого халкона на множество регуляторных систем, включая фосфатидилинозитол-3- киназы (р85, р110), фосфорилирование протеинкиназ Akt, 1кВα, влияние на регулятор транскрипции NF-kB и на другие регуляторы метаболизма.
Ксантоангелол подавлял пролиферацию клеток рака молочной железы, действуя на гистонный белок Н2А. Цитотоксическое действие ксантоангелола проявляется существенно сильнее именно на клетках опухоли по сравнению с нормальными клетками, как это было показано на клетках глиобластомы. При этом апоптоз клеток опухоли вызывается влиянием этого халкона на каспазо-зависимый путь регуляции. Другой мишенью действия ксантоангелола является рецептор хемокинов CXCR4, экспрессия которого повышается благодаря влиянию на фактор транскрипции NF-kB. Предполагается, что ксантоангелол может служить мощным лекарственным препаратом против острой лейкемии. Его действие, сопровождающееся изменением уровня протеинкиназ FAK, AKT и регулятора транскрипции NF-кВ, столь эффективно, что ожидается начало клинических испытаний этого агента.
Изоликвиритигенин останавливает деление и инициирует апоптоз клеток лимфобластомы. При этом наблюдается изменение функционирования пар нуклеотидов в комплексе мРНК-микроРНК. Предполагается, что эти нарушения приводят к существенному подавлению процесса экспрессии генов, включая регуляторный путь транскрипционного фактора р53, участвующего в регуляции клеточного деления. Изоликвиритигенин ингибирует рост клеток множественной миеломы, относящейся к разновидностям лейкоза, путем блокирования сигнального пути интерлейкина 6 (IL-6). Наблюдается значительное снижение фосфорилирования киназы ERK и активатора транскрипции STAT3. Изоликвиритигенин способен также подавлять опухолевый ангиогенез, т. е. развитие капилляров опухоли, необходимых для обеспечения опухолевого роста. Указанное действие связано с тем, что халкон активирует киназу c-Jun и ингибирует киназу ERK, в то время как при подавлении роста клеток рака простаты, наоборот, наблюдается активация киназы ERK, а также киназы AMPK.
Фактор некроза опухолей, индуцирующий апоптоз раковых клеток TRAIL, является природным противораковым агентом, не проявляющим токсичности в отношении здоровых клеток, поскольку он взаимодействует с рецепторами клеточной смерти на поверхности раковых клеток TRAIL-R1 и TRAIL-R2. Было обнаружено, что халконы ликохалкон, изобавахалкон, ксантохумол, бутеин и некоторые дигидрохалконы, включая флоретин, существенно повышают цитотоксичность TRAIL в клетках рака простаты благодаря эффекту сенситизации.
Разнообразные изменения в работе регуляторных систем, обнаруженные в исследованиях различных авторов, не позволяют представить целостную картину действия халконов на канцерогенез, но определенно свидетельствуют о перспективности исследований антиканцерогенного действия этих агентов.
1.8.3. Противовоспалительная активность
Противовоспалительная активность непосредственно связана с противораковой защитой и часто осуществляется благодаря антиоксидантным свойствам веществ. Так, халконы бутеин, ксантоангелол, 4-гидрокси-деррицин, кардамонин, 2’,4’-дигидроксихалкон, изоликвирити- генин, изосалипурпозид (флоризин) и нарингенин-халкон (флоретин) способны подавлять активность ядерного фактора NF-kB, контролирующего транскрипцию ДНК и участвующего в процессах канцерогенеза. В частности, халкон бутеин, а также ряд других полифенольных соединений из лекарственного растения бутея односеменная, подавляя белок р65, входящий в комплекс NF-kB, снижали также уровень фактора некроза опухолей TNF-α и интерлейкинов IL-6, IL-8, способствовали фосфорилированию киназы Erk1/2 MAP, ингибировали экспрессию синтазы окиси азота, что является причиной противовоспалительного действия этого растения, используемого в народной медицине. Аналогичным действием на остеокласты обладает изоликвиритигенин из лакрицы. Можно проследить, как изоликвиритигенин препятствует передаче сигнала от толл-подобных рецепторов, реагирующих на присутствие липополисахаридов бактерий, что приводит к подавлению воспалительного процесса, развивающегося, как указывалось выше, через ядерный фактор NF-kB и синтазу окиси азота. Действие изоликвиритигенина на толл-подобные рецепторы способно прервать сигнальную цепочку, ведущую к интерферону β (TRIF), активирующему Т-клетки иммунной системы, что подавляет экспрессию цитокина RANTES, участвующего в иммунном ответе лейкоцитов. Аналогичный процесс регуляции воспалительных процессов с участием моноцитов THP-1 может подавляться ксантоангелолом и его производными. Процесс регуляции
начинается с взаимодействия бактериальных липополисахаридов с толл- рецептором на поверхности лейкоцитов, что инициирует продукцию цитокинов и активирует воспалительный процесс. Предполагается, что указанные халконы способны проникать в специализированный карман белка MD-2, ответственного за распознавание липополисахаридов и активацию толл-рецептора, и благодаря этому останавливать развитие воспаления.
Важный вклад в антивоспалительное действие флавоноидов лакового дерева, включая бутеин, связан также со снижением уровня ROS, экспрессией синтазы окиси азота и циклооксигеназы (COX-2). Аналогичное влияние на уровень ROS в цитоплазме и экспрессию провоспалительных генов IL-1a, IL-6, MCP-1, ICAM-1 было обнаружено при действии ксантоангелола на клетки печени в условиях ишемии или при токсических поражениях печени, а также при заживлении ран и подавлении воспалительных процессов на поверхности кожи. При этом не только снижался уровень окислительного стресса в поврежденных тканях, но также активировался ангиогенез, необходимый для заживления ран.
Еще одной мишенью противовоспалительных агентов является деацетилаза гистонов HDAC, которая удаляет ацетильную группу с лизинов гистоновых белков, что влияет на упаковку ДНК и экспрессию определенных генов. Было обнаружено, что некоторые полифенолы, включая бутеин, способны регулировать активность HDAC, благодаря чему подавляются воспалительные процессы.
Другим ключевым звеном в развитии воспалительных процессов является лейциновый зиппер-домен bZIP белка NRF2, являющегося транскрипционным фактором, участвующим в антивоспалительных и антиоксидантных процессах в клетке. Известно, что зиппер-домены bZIP ответственны за взаимодействие белков с молекулой ДНК в процессе транскрипции. Халкон ксантоангелол способен взаимодействовать с bZIP- доменом белка NRF2, влияя на экспрессию медиаторов воспаления: синтазу азота, некоторые интерлейкины и фактор танскрипции TNF-α. Значительно повышается транскрипция НАДФН: хинон-оксидоредуктазы-1 (NQO1), гем- оксигеназы-1 (ОН-1) и уровень глютатиона - главного антиоксиданта клетки.
1.8.4. Халконы против диабета и ожирения
Халконы из растения хачитаба, используемого в японской народной медицине (Angelica keiskei), способны проявлять инсулиноподобную активность и повышать поглощение глюкозы адипоцитами, проявляя тем самым антигипергликемическую активность. Эти вещества могут рассматриваться как перспективные агенты в лечении диабета. Указанные халконы способны также препятствовать развитию метаболического синдрома (ожирению в абдомиальной области), что снижает риск развития диабета второго типа. Этот эффект достигается благодаря активации экспрессии адипонектина - гормона, участвующего в регуляции метаболизма глюкозы и жирных кислот, а также ответственного за развитие жировой ткани. Халконы, полученные из солодки (Glycyrrhíza glabra), снижали активность липазы поджелудочной железы, снижали уровень холестерина, жирных кислот и триглицеридов в крови, что препятствовало развитию метаболического синдрома.
Было обнаружено также, что сульфонамид-производные халкона можно отнести к новому классу ингибиторов α-глюкозидазы с высокой активностью (IC500,4-1,0 мкМ). Недавно исследованная серия производных халкона, получившая название чана (Chana), обладает ингибирующей активностью в отношении α-гликозидазы и способствует дифференциации адипоцитов, что препятствует накоплению жира. Метокси-замещенные халконы обладают способностью подавлять состояние гипергликемии наравне с лекарственным препаратом Лизпро- инсулином. Нафтилхалкон способен снижать уровень глюкозы в крови благодаря стимуляции секреции исулина. Было обнаружено, что для выполнения данной функции большое значение имеет положение нитрогруппы на фенильном кольце.
1.8.5. Антибиотики на основе халконов
Халконы могут быть получены синтетическим путем, благодаря чему возможно их промышленное производство (рис. 18). С помощью химических модификаций можно получать большое разнообразие производных халконов, что позволяет разрабатывать вещества с различной биологической активностью и даже получать достаточно активные антибиотики.
Рис. 18. Один из возможных путей синтеза халконов. R1 и R2 - различные заместители.
Антибактериальную активность могут проявлять как природные халконы, так и их синтетические аналоги. Так, ликохалконы А и С, выделенные из лакрицы, обнаруживают способность к защите организма от Bacillus subtilis, Staphylococcus aureus, Micrococcus luteus с минимальной концентрацией ингибирования (МКИ) 3,3-12,5 мкг/мл. Исследование аналогов ликохалкона А позволило установить, что для ингибирования роста S. aureus необходима ОН-группа в положении 4 в кольце А. Введение более длинной гексильной группы увеличивает антибактериальную активность, напротив, при удалении липофильной пренильной группы или при замене пренильной группы на пропильную наблюдается
снижение активности. Таким образом установлено, что гидрофобность молекулы существенна в антибактериальном действии этого вещества.
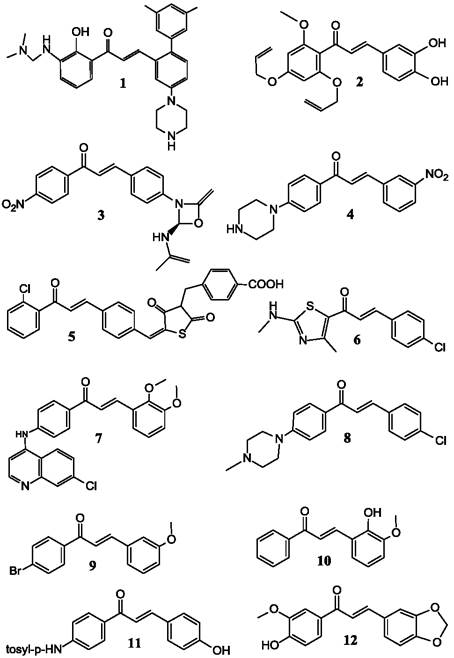
Дигидрохалкон асебогенин обнаружил способность к ингибированию роста S. aureus и метициллин-устойчивой формы S. aureus, IC50 = 10 мкг/мл и 4,5 мкг/мл соответственно. Замена гидроксильной группы 4’ на карбоксильную группу позволяет получить активное вещество с высокой растворимостью в воде. Придание катионного заряда присоединением пиперазина в положении 2 кольца В (рис. 19, формула 1) позволяет получить соединение, высокоактивное в отношении различных штаммов E. faceum и E. coli.
Халконы, содержащие две аллиокси-группы, особенно 2’,4’- аллиокси-6’-метокси-халконы (рис. 19, формула 2), обнаруживают способность к избирательному действию против трипаносомы (Trypanosoma cruzi) при концентрации ниже 25 мкМ. Прикрепление известного антибактериального агента оксазолидона к кольцу В (рис. 19, формула 3) позволяет получить вещества с повышенной антибактериальной активностью к различным штаммам S. aureus и Enterococcus faecalis, с величиной МКИ 32 мкг/мл. Халконы, содержащие пиперазин (рис. 19, формула 4), проявляли себя как активные противомикробные агенты с величиной МКИ50 в пределах 2-100 мкг/мл в отношении S. aureus и E. coli. Производные халконов, содержащие тиазолидиндион и бензоевую кислоту (рис. 19, формула 5), обнаруживали чрезвычайно высокую активность в отношении грамположительных штаммов S. aureus (МКИ 1мкг/мл), что превосходило активность известного антибиотика оксациллина и было сравнимо с антибиотиком норфлоксацином. В отношении некоторых устойчивых штаммов активность производных халконов в десятки раз превышала активность указанных антибиотиков. Замещение одного из колец халкона кольцом тиазола (рис. 19, формула 6) позволяет получить вещества, более активные, чем ампициллин.
Создание лекарственных препаратов против возбудителей туберкулеза, принадлежащих к роду Micobacterium, является одной из наиболее насущных задач, поскольку в мире ежегодно регистрируется около 2 млн случаев заболевания. На основе халконов были получены высокоактивные соединения (рис. 19, формула 7) с величиной МКИ = 3,2 мкг/мл в отношении M. tuberculosis, не обладающие токсичностью к клеткам человека. В другом исследовании серии халконов, в которых различные гидроксилы замещались на N-метил пиперазин, было получено соединение (рис. 19, формула 8) с величиной IC50 = 3,5 мкг/мл в отношении M. tuberculosis, тогда как аналогичное соединение с заместителем N, N-диметил- аминопропиламином проявляло еще большую активность (IC50 = 0,035 мкг/мл) в отношении малярийного плазмодия. Исследование серии арилокси-азолил-халконов позволило обнаружить вещества с величиной МКИ 0,78-3,12 мкг/мл в отношении M. tuberculosis и низкой токсичностью к клеткам различных органов. Эти вещества проявляли также умеренные лекарственные свойства in vivo в отношении животных, зараженных вирулентной формой M. tuberculosis. Недавно полученная серия нафтилхалконов обладала способностью ингибировать тирозинфосфатазу из клеток M. tuberculosis с очень высокой эффективностью, что позволяет создавать молекулярные модели для оптимизации взаимодействия фермента с ингибитором.
Рис. 19. Синтетические аналоги халконов.
Халконы могут проявлять также активность против других видов инфекции. Так, был синтезирован ряд производных халкона (рис. 19, формула 9), проявляющих высокую активность в отношении широкого спектра патогенных грибов, включая Microsporum canis (МКИ 25 мкг/мл), Microsporum gypseum (1,5 мкг/мл), Trichophyton mentagrophytes (МКИ 3 мкг/мл), Trichophyton rubrum (МКИ 3 мкг/мл) и Epidermophyton floccosum (МКИ 0,5 мкг/мл). Недавно была обнаружена высокая активность оксатиолон-производного халкона против патогенных грибов рода Candida. Кроме того, серия новых гуанолинил-халконов проявляет высокую активность в отношении грибов Candida, Cryptococcus gattii, Paracoccidioides brasiliensis.
Халконы способны проявлять достаточно высокую активность также против вирусной инфекции. Определенные успехи были достигнуты в борьбе с вирусом иммунодифицита человека (ВИЧ). Так, ксантохумол из шишек хмеля является селективными ингибитором антигена р24 и обратной транскриптазы вируса ВИЧ-1 с величиной МКИ 1,28 мкг/мл и 0,5 мкг/мл соответственно. Скрининг более чем 90 тыс. веществ из коллекции антивирусной программы Национального института рака (США) позволил установить, что халкон (рис. 19, формула 10) проявляет ингибирующее действие в отношении интегразы вируса ВИЧ с величиной IC50 2 мкМ в присутствии катионов Са2+ и Mg2+, которые служат кофакторами этого процесса. Учитывая, что фермент интеграза участвует в процессах репликации вируса, это открытие является существенным шагом в разработке противовирусных препаратов. Позже были обнаружены и некоторые другие производные халкона, обладающие активностью в отношении этого фермента, например, ферроценил-халкон- дифторидоборат. В настоящее время ряд аналогичных соединений, проявляющих активность в отношении интегразы вируса ВИЧ-1, проходят клинические испытания в Китае.