Химия и биология белков - Ф. Гауровитц 1953
Роль белков в реакциях иммунитета
Антитела
Присутствие антител обнаруживается по их специфической реакции с антигенами. Антитела, образовавшиеся в ответ на введение клеток или бактерий, способны агглютинировать или лизировать соответствующие клетки и бактерии. Антитела против растворимых белков образуют нерастворимые соединения с этими белками. Токсины теряют свою токсичность при соединении с антителами. Все эти феномены, в сущности, являются проявлением одной и той ж реакции — соединения антитела с антигеном. Если для иммунизации используются цельные клетки или бактерии, то образуется большое число антител, направленных против различных антигенных веществ, присутствующих в инъицированном антигенном комплексе. Положение значительно упрощается, если в качестве антигена используются растворимые вещества, например чистые белки. В подобных случаях образуются антитела только против одного антигена.
Уже давно известно, что антитела находятся в глобулиновой фракции иммунной сыворотки. Это наблюдение послужило основой для представления о том, что антитела в большей или меньшей степени рыхло связаны с сывороточными глобулинами. Если иммунную сыворотку фракционировать при помощи сернокислого аммония, то антитела обнаруживаются главным образом во фракции у-глобулинов [30]. Фракционирование глобулиновой фракции этиловым спиртом показало, что антитела присутствуют во фракциях II-1, ІІ-2 и II-3, а также во фракции ІІІ-1 [31]. Некоторые антитела осаждаются вместе с эвглобулинами при диализе против дестиллированной воды, другие же антитела обнаруживаются во фракции псевдоглобулинов [32]. Как правило, иммунная сыворотка содержит больше y-глобулинов, чем нормальная сыворотка. Кроме а-, β- и у-глобулинов, присутствующих и в нормальной сыворотке, иммунная сыворотка иногда содержит также новую фракцию (Т), которая при электрофорезе движется между ß- и у-фракциями. Т-фракция также содержит антитела [33, 34]. Исследования последних лет показали, что сыворотка многих новорожденных животных, например жеребят [35] или кроликов [36], бедна глобулинами. Это хорошо согласуется с тем фактом, что в сыворотке новорожденных животных антитела отсутствуют [37].
Физико-химические свойства антител очень близки к физикохимическим свойствам у-глобулинов нормальной сыворотки. В большинстве случаев их изоэлектрическая точка лежит около pH 6 [38]. Молекулярный вес антител крови кроликов и обезьян равен 157 000, а крови лошади, овцы и быка 920 000 [39]. При гидролизе антител получаются те же самые аминокислоты, которые удается обнаружить в гидролизате нормальных у-глобулинов [40]. В глобулинах нормальной сыворотки кролика и в антителах крови кроликов аминокислоты расположены в одной и той же последовательности. Оба белка содержат аспарагиновую кислоту, валин, лейцин, а на концах пептидных цепей находится аланин со свободной аминогруппой [41].
Для решения вопроса о том, являются ли антитела сывороточными глобулинами или же они только связаны с этой фракцией, можно использовать специфические методы очистки антител. Обычно эти методы включают два основных этапа: 1) образование преципитата антиген—антитело и 2) диссоциацию преципитата и выделение чистого антитела. Первые успешные опыты этого рода были предприняты Фелтоном [42], который преципитировал антигенные полисахариды пневмококков соответствующей иммунной сывороткой, а затем разлагал преципитат, обрабатывая его гидроокисью бария. При такой обработке антитела переходят в раствор, нерастворимые же бариевые соли полисахаридов остаются в осадке. Гейдельбергер и его сотрудники успешно расщепляли подобные преципитаты, обрабатывая их концентрированными растворами хлористого натрия [43, 44]. В лаборатории автора для получения чистых антител преципитаты азобелков обрабатывались разведенными кислотами в присутствии нейтральных солей. При этом большая часть антител отщеплялась и переходила в раствор, а антиген и недиссоциированная часть антител оставались в осадке [45]. Растворы антител, полученные при помощи этих методов, содержат глобулины, не отличающиеся по свойствам от описанных выше нормальных глобулинов. Дальнейшие исследования показали, что больше 90% выделенных подобным образом глобулинов осаждается соответствующим антигеном. Это весьма убедительно подтверждает, что данные глобулины действительно идентичны с настоящими антителами.
Антитела отличаются от нормальных сывороточных глобулинов, а также друг от друга своей специфичностью. Каждое антитело соединяется только с тем антигеном, при помощи которого производилась иммунизация, и не соединяется ни с каким другим антигеном. Для объяснения этой специфической способности антител соединяться с соответствующим антигеном Брейнл и автор настоящей книги выдвинули теорию, согласно которой антитела являются глобулинами, имеющими молекулы, конфигурация которых геометрически дополняет конфигурацию детерминирующих групп молекул антигена [46]. Авторы этой теории предполагают, что полярные группы антигена оказывают влияние на процесс образования глобулинов из аминокислот, в результате чего нормальный ход этого процесса изменяется и образуются молекулы глобулина, имеющие иную пространственную конфигурацию [46—48].
Дополнительная форма поверхности антигена определяется, повидимому, с одной стороны, способом скручивания пептидной цепи [50], а с другой — присутствием ионных групп противоположного знака на том участке молекулы антитела, который непосредственно соединяется с антигеном (фиг. 46). Место образования нормальных сывороточных глобулинов до сих пор еще окончательно не выяснено, однако большинство исследователей считает, что антитела образуются в ретикулоэндотелиальных клетках или в макрофагах печени, костного мозга и селезенки [51]. Было найдено, что при инъекции кролику такого мощного антигена, как арсанилазоглобулин, наибольшее количество антигена накапливается в печени и костном мозге подопытных животных [29]. При введении кроликам фосфовителлина, меченного Р32, радиофосфор быстро захватывается тканями печени и легких [52]. Это наблюдение свидетельствует о том, что данные органы играют существенную роль в процессе образования антител.
В то время как плазма крови кроликов и лошадей содержит большие количества растворимых антител, в плазме других животных, например морских свинок, растворимые антитела присутствуют лишь в небольших количествах (даже в том случае, если эти животные сенсибилизируются растворимыми антигенами). Аллергическое состояние у этих животных выявляется сильным анафилактическим шоком, возникающим при повторной инъекции того же самого антигена. Антитела у этих животных, повидимому, не могут проникать из тканей, где они образуются, в кровяную плазму, так как они представляют собой нерастворимые белки. Повидимому, и здесь существует соответствие между пространственной конфигурацией антител и антигенов, которое определяет высокую избирательность реакции между ними [53]. Некоторым исследователям удалось экстрагировать антитела из лимфатических клеток. В связи с этим было высказано предположение, что часть антител образуется в лимфатических клетках [54, 55, 56] или же в плазмацитах [57]. По мнению автора данной книги, антитела могут образовываться во всех тех клетках, в которых синтезируются белки, если только эти клетки способны связывать молекулы инъицированного антигена [58].
На основании опытов с аминокислотами, меченными N15, можно сделать заключение, что образование антител в организме происходит примерно с той же самой скоростью, с которой образуются нормальные сывороточные глобулины. Период полураспада антител составляет около двух недель [59]. Большой интерес представляют эксперименты, в которых неиммунизированным кроликам вводились взятые от другого иммунизированного животного кроличьи антитела против бактериальных полисахаридов и одновременно аминокислоты, меченные N15. Оказалось, что N15 не включается в предобразованные антитела [59]. Однако другие исследователи, пользуясь аналогичной методикой, показали, что при пассивной иммунизации происходит включение в антитела лейцина, меченного С14 [60]. Ввиду противоречивости литературных данных до сих пор еще не ясно, могут ли молекулы антитела, введенного в организм другого животного, подвергаться в нем какой-либо перестройке.

Фиг. 46. Соединение м-азофенилсульфопроизводного белка (слева) с антителом (справа) [49].
Образование антител точно так же, как и образование других белков, зависит от питания организма. У животных, питающихся полноценной пищей, образуется значительно больше антител, чем у животных, содержащихся на неполноценной диэте [61]. У лягушек тигр антисыворотки зависит от температуры тела: при 20° он значительно выше, чем при 8°. Снижение температуры вызывает адсорбцию антител клетками печени с соответствующим понижением титра антисыворотки [62].
Некоторые авторы пытались объяснить специфичность антител тем, что при формировании молекулы антитела в ее состав входит детерминирующаяся группа антигена. Они предлагали поэтому рассматривать антитела как природные глобулины, включившие в состав своей молекулы указанную группу [63]. Это предположение опровергается тем, что антитела против иодированных и бромированных белков, арсанилазобелков и фосфобелков не содержат ни иода, ни брома, ни мышьяка, ни фосфора [64]. Известно также, что одна молекула антигена способна вызвать образование большого числа молекул антитела. Так, например, при иммунизации бактериями количество образующихся антител примерно в 600 раз больше количества, необходимого для агглютинации инъицированных бактерий [65].
Первоначально предполагалось, что каждый антиген вызывает появление только одного типа антител, адаптированного к детерминирующей группе молекулы антигена. Если каждая молекула инъицированного антигена содержит несколько различных детерминирующих групп, то образуется несколько различных антител. Иммунизация глобулином, в молекулу которого введены иод и азофениларсоновая кислота, приводит к появлению двух типов антител: антител против дииодтирозина и антител против азофениларсоновой кислоты [66]. Эти два типа антител можно отделить друг от друга, осаждая один из них иодовальбумином, второй — арсанилазоовальбумином. Если после осаждения этих антител добавить иодарсанилазоовальбумин, то дополнительного осадка не образуется.
Совсем иная картина имеет место при иммунизации арсанил-глобулином сыворотки овцы. В этом случае образуются, по крайней мере, три типа антител: 1) антиарсаниловые, 2) антиовечьи и 3) антиарсаниловечьи [67]. Последние антитела осаждаются арсанилглобулином сыворотки овцы и не осаждаются ни арсанилазоовальбумином, ни овечьим сывороточным глобулином. Из этих опытов вытекает, что специфичность молекул антител зависит от расположения детерминирующих групп в молекуле антигена. Если вводить антиген (А+Б), детерминирующие группы которого А и Б расположены в разных местах поверхности молекулы антигена, то будут образовываться антитела двух типов: анти-А и анти-Б, но не будут образовываться антитела типа анти-АБ. Если же группы А и Б расположены близко друг к другу, то кроме антител анти-А и анти-Б будут образовываться
также и антитела анти-АБ [68] (см. фиг. 47 и 48).

Фиг. 47. Соединение антигена с антителом.
А и Б — две различные детерминирующие группы антигена (A+Б).
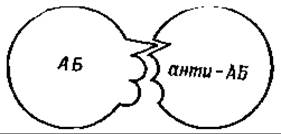
Фиг. 48. Соединение антигена с антителом.
АБ — антиген, содержащий две детерминирующие группы А и Б, расположенные рядом.
Из этих наблюдений вытекает, что иммунная сыворотка неизбежно должна содержать разнообразные антитела даже в том случае, если для иммунизации используется только один простой антиген. Образование многих антител в ответ на введение одного антигена обусловлено, с одной стороны, тем, что антиген может содержать несколько различных детерминирующих групп, вызывающих появление различных адаптированных к ним антител, с другой стороны — несовершенством адаптации образующихся антител. Молекулы антител образуются из аминокислот, и, поскольку строение пептидной цепи может меняться только до определенного предела, конфигурация их никогда не может полностью соответствовать конфигурации молекулы антигена. Иммунная сыворотка, следовательно, должна содержать и хорошо и плохо адаптированные антитела (фиг. 49). [13, 69—72]. Поэтому даже кристаллические белковые антигены, такие, например, как яичный альбумин, вызывают образование нескольких различных антител [72].
В иммунной сыворотке, по всей вероятности, имеются все промежуточные формы между нормальными сывороточными глобулинами и хорошо выраженными антителами [73]. Некоторые авторы допускают даже, что все глобулины в иммунной сыворотке являются антителами, т. е. характеризуются структурной адаптацией к молекулам антигена [74, 75]. В пользу этого мнения говорит то, что специфичность антител уменьшается при продолжительной иммунизации; антитела, образующиеся в первые дни иммунизации, способны осаждать только антиген, применявшийся для иммунизации, тогда как антитела, образующиеся в результате иммунизации, длящейся несколько недель или месяцев, могут хорошо осаждать также и другие, сходные антигены [76—78].
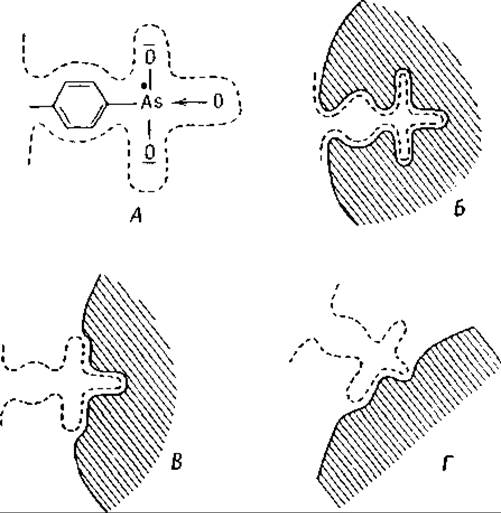
Фиг. 49. Детерминирующие группы антигена (фенил- арсоновая кислота) и различные типы антител.
А — детерминирующая группа антигена; Б — идеальное антитело; В — хорошо адаптированное антитело; Г — плохо адаптированное антитело.
Схемы, изображенные на фиг. 47 и 48, показывают, что каждая молекула антитела, даже в том случае, если для иммунизации используется многовалентный антиген, обладает только одной специфической группой, способной связываться с антигеном. Представление о том, что антитела являются одновалентными [67, 79], подкрепляется следующим наблюдением. Дифтерийный антитоксин, молекулярный вес которого равен 184 000, расщепляется пепсином на две части. Одна из этих частей, с молекулярным весом 98 000, обладает всей активностью нерасщепленного антитоксина, другая же совершенно лишена антитоксической активности. Очевидно, что специфическая реактивная группа присутствует только в одной части молекулы первоначального антитоксина [80]. Однако представление об одновалентности антител разделяется далеко не всеми исследователями, работающими в области иммунохимии. Многие из них [50, 81, 82] придерживаются того мнения, что каждая молекула антитела обладает двумя или большим числом специфических групп, способных связываться с антигеном. Эти исследователи объясняют низкую реактивность антител, образовавшихся в первые дни иммунизации, их одновалентностью и неспособностью одновалентных антител образовывать преципитаты [83].
Поскольку антитела являются белками, нет ничего удивительного в том, что на действие антител оказывают влияние все агенты, вызывающие денатурацию белков. Эффективность антител понижается или полностью исчезает при нагревании, высоких давлениях [84], а также при обработке иодом, формальдегидом или диазосоединениями [85].
Нельзя, однако, считать, что специфическая активная группа антител очень лабильна [16]; часто она даже более устойчива, чем детерминирующая группа антигена. В первую очередь это относится к антитоксинам. Обработка преципитата токсин—антитоксин денатурирующими агентами вызывает разрушение только токсина, в результате чего получается нетоксический препарат антитоксина. Различия между составом антител и нормальных сывороточных глобулинов не настолько велики, чтобы обусловить заметную разницу в их антигенных свойствах. Если кролику вводить антитела сыворотки лошади, то в его организме образуются преципитины, действующие не только против лошадиных антител, но и против нормального сывороточного глобулина лошади [86].
Очень часто образование в организме животного антител рассматривают как процесс, ничего общего не имеющий с другими непрерывно протекающими в нормальном организме процессами. Однако образование антител связано с синтезом новых белковых молекул, и нет никаких оснований считать, что этот процесс заметно отличается от обычного процесса синтеза белка [58, 87]. Механизм образования белков в живых клетках будет обсуждаться ниже (см. гл. XVII). Здесь же необходимо только отметить, что этот процесс протекает, повидимому, в две стадии [58]: 1) образование копии растянутого белкового шаблона и 2) превращение двумерной копии в трехмерную глобулярную молекулу белка путем образования складок. Влияние антитела сказывается главным образом во время второй стадии образования белка. Вероятно, полярные группы антигена нарушают нормальный процесс свертывания пептидной цепи таким образом, что конфигурация образующихся глобулярных частиц оказывается как бы геометрическим дополнением к конфигурации полярных детерминирующих групп антигена [58]. Электростатические силы детерминирующих полярных групп антигена обусловливают, по- видимому, возникновение определенного силового поля, причем размеры этого поля варьируют от антигена к антигену. Поскольку глициллейцин иммунологически отличается от лейцил- глицина (см. начало этой главы), следует считать, что специфичность антител определяется не одной какой-либо группой антигена, а всей областью смежных полярных групп. На основе этой концепции понятно, почему антитела против пептидов способны соединяться и с аналогами пептидов — пептаминами [89]:
![]()
Некоторые исследователи пытались синтезировать антитела in vitro путем обработки нормальных сывороточных у-глобулинов мягкими денатурирующими агентами в присутствии антигена [90]. Однако пока еще нельзя сделать никаких определенных выводов относительно результатов этих опытов, потому что денатурированные у-глобулины дают неспецифические преципитаты с используемыми антигенами [91, 92].