Химия и биология белков - Ф. Гауровитц 1953
Электрохимия белков
Аминокислоты как диполи
В течение долгого периода времени полагали, что аминокислоты в водном растворе существуют в форме нейтральных молекул, имеющих общую формулу H2N ∙ R ∙ СООН. Тот факт, что аминокислоты в кислом или щелочном растворе перемещаются в сторону катода или анода, считали следствием следующих реакций:
![]()
Адамс [1] и Бьеррум [2] впервые высказали предположение, что нейтральная формула аминокислот H2N ∙ R ∙ СООН должна быть заменена формулой диполя — H3N ∙ R ∙ COO и что лишь ничтожно малое количество аминокислоты может находиться в растворе в форме незаряженных нейтральных молекул. Если мы примем такую точку зрения, то уравнения (1а) и (2а) должны будем заменить новыми:
![]()
Согласно старым представлениям, водородные ионы соединялись с незаряженной аминогруппой NH2, превращая ее тем самым в положительно заряженную аммонийную группу
(уравнение 1а); по новым же представлениям, водородные ионы взаимодействуют с отрицательно заряженной СОО-группой, образуя СООН. Аналогичным образом и ионы гидроксила ОН-, по новому представлению, реагируют с СООН или с ![]() (см. уравнения 2а и 2б).
(см. уравнения 2а и 2б).
Сравнивая уравнения (1а) с (1б) и (2а) с (2б), мы видим, что правые стороны их тождественны. Действительно, в кислых растворах аминокислоты находятся в виде катионов с формулой ![]() а в щелочных — в виде анионов с формулой
а в щелочных — в виде анионов с формулой ![]()
Доказательством этому служат упомянутые выше данные о перемещении ионов аминокислот в электрическом поле, однако эти наблюдения не позволяют решить вопрос о том, находятся ли аминокислоты, растворенные в чистой воде, в виде соединений, отвечающих нейтральной формуле H2N ∙ R ∙ СООН, или же в форме диполя — ![]()
Дипольные ионы благодаря своим положительным и отрицательным группам притягиваются с одинаковой силой как к аноду, так и к катоду, вследствие чего они, в отличие от истинных анионов и катионов, не передвигаются ни к аноду, ни к катоду. В связи с этим дипольные ионы (цвиттерионы, гибридные ионы) не оказывают влияния на электропроводность раствора, т. е. ведут себя так, как если бы они действительно были нейтральными незаряженными молекулами. Измерения электропроводности растворов аминокислот не дают поэтому возможности решить вопрос о том, содержат ли эти растворы нейтральные молекулы H2N ∙ R ∙ СООН или дипольные ионы ![]()
Этот вопрос был полностью выяснен при помощи других физико-химических методов, которые бесспорно доказали дипольную структуру аминокислот. Одним из первых примененных для этой цели методов был метод калориметрического определения теплоты ионизации аминокислот в кислом и щелочном растворах [3]. Уже давно было установлено, что теплота реакции ![]() равная для карбоновых кислот алифатического ряда приблизительно +1 000 кал/моль, сильно отличается от теплоты ионизации алифатических аминов:
равная для карбоновых кислот алифатического ряда приблизительно +1 000 кал/моль, сильно отличается от теплоты ионизации алифатических аминов:
![]()
которая составляет +12 000 кал/моль. При соответствующих определениях было найдено, что теплота ионизации аминокислот в кислом растворе варьирует от —1 300 до +2 100, а теплота ионизации в щелочном растворе колеблется от + 10 000 до +13 300 кал/моль. Ив этих данных ясно, что соляная кислота реагирует с карбоксильными группами аминокислот, а едкий натрий — с их аммонийными группами.
Дополнительным подтверждением дипольной структуры аминокислот служат данные о повышении диэлектрической постоянной воды при растворении в ней аминокислот (см. гл. VII). Эти данные невозможно было объяснить на основании старых представлений о нейтральной структуре аминокислот. О наличии в нейтральных растворах аминокислот групп ![]() а не СООН свидетельствуют также спектры комбинационного рассеяния (рамановские спектры), которые зависят от характера колебаний и, следовательно, от структуры молекулярных группировок, входящих в молекулу аминокислоты [4].
а не СООН свидетельствуют также спектры комбинационного рассеяния (рамановские спектры), которые зависят от характера колебаний и, следовательно, от структуры молекулярных группировок, входящих в молекулу аминокислоты [4].
Дипольное строение аминокислот в водных растворах подтверждается, наконец, явлением электрострикции, т. е. значительным сокращением объема, наблюдаемым при растворении твердых аминокислот в воде. У других веществ наблюдается лишь легкое сокращение объема. Так, например, при растворении в воде 1 моля (75 г) амида гликолевой кислоты СН2ОН ∙ CONH2 объем увеличивается на 56,2 мл, в то время как при растворении 1 моля (75 г) изомерного глицина H3N ∙ СН2∙ СОО увеличение объема составляет лишь 43,5 мл. Указанная резко выраженная стрикция обусловлена сильным электростатическим притяжением ионизированными группами аминокислот молекул воды, в результате которого происходит их уплотнение [5].
О том, что и твердые аминокислоты существуют, вероятнее всего, в форме диполей, а не в форме нейтральных молекул, свидетельствуют их значительная плотность и высокие точки плавления. Оба эти свойства указывают на сильное электростатическое притяжение между противоположно заряженными ионизированными группами смежных молекул, в результате которого их разделение оказывается значительно более затруднено, чем разделение смежных нейтральных молекул. В то время как плотность амида гликолевой кислоты равна 1 390, а точка плавления 117°, изомерный глицин имеет платность 1 607 и точку плавления 232° [5].
Основное преимущество нового представления о дипольном строении аминокислот выявляется в том факте, что постоянные диссоциации их кислых и основных групп действительно соответствуют постоянным диссоциации алифатических кислот и алифатических аминов. При расчете постоянной диссоциации на основе старых уравнений (1а) и (16) получались величины, значительно отличающиеся от типичных постоянных диссоциации алифатических кислот и алифатических аминов. Так, например, при таком расчете были получены постоянные для кислых групп аминокислот порядка 10-9 и для основных групп — порядка 10-11, в то время как постоянная диссоциации уксусной кислоты равна 1,8∙10-5 и этиламина 1,2∙10-3. При расчете на основе старых представлений получалось, таким образом, что диссоциация карбоксильных групп аминокислот значительно ниже, чем диссоциация карбоксильной группы угольной кислоты (ka = 4,5 ∙ 10-7). Это противоречие устраняется, если принять дипольную формулу аминокислот.
Прежде чем перейти к дальнейшему рассмотрению вопроса о диссоциации кислых и щелочных групп аминокислот, необходимо видоизменить уравнение (2б) в соответствии с теорией кислот и оснований Бренстеда. Бренстед определяет кислоты как вещества, способные отдавать протоны, и основания — как вещества, способные воспринимать протоны. Если мы примем это определение, то группы ![]() и NH2 следует рассматривать как основные группы, потому что они соединяются с протоном Н+; подобным же образом группы СООН и
и NH2 следует рассматривать как основные группы, потому что они соединяются с протоном Н+; подобным же образом группы СООН и ![]() следует рассматривать как кислые группы, поскольку они являются донаторами протонов. В соответствии с этим уравнение (2б) может быть заменено уравнением
следует рассматривать как кислые группы, поскольку они являются донаторами протонов. В соответствии с этим уравнение (2б) может быть заменено уравнением
![]()
Хотя обозначение ![]() как основания и
как основания и ![]() как кислоты и не вызывает возражении с этой точки зрения, тем не менее старое определение карбоксильной группы как кислотной и аминогруппы как основной все же остается достаточно употребительным. В связи с этим следует быть осмотрительным в терминологии, так как иначе может возникнуть путаница.
как кислоты и не вызывает возражении с этой точки зрения, тем не менее старое определение карбоксильной группы как кислотной и аминогруппы как основной все же остается достаточно употребительным. В связи с этим следует быть осмотрительным в терминологии, так как иначе может возникнуть путаница.
Теория Бренстеда о природе кислот и щелочей имеет то преимущество перед старыми представлениями, что объясняет реакции между кислотами и щелочами в неводных растворителях, где гидроксильные ионы ОН- не образуются. При рассмотрении вопросов, касающихся водных растворов, необходимо принять во внимание, что вода может действовать двояко: и как кислота, т. е. быть донатором протона (Н2О → Н+ + ОН-), и как основание, т. е. быть акцептором протона (Н2О + Н+→ Н3О+); в последнем случае образуется ион гидрония Н3О+. В связи с этим реакцию аминокислот с основаниями в водных растворах возможно описать также и при помощи уравнения (2б). В отсутствие же воды правомочно лишь уравнение (2в). Однако нельзя забывать, что протон, находящийся в правой половине уравнения, не свободен, но связан с добавленным основанием, вследствие чего уравнение (2в) может быть написано также следующим обпазом:
![]()
Поскольку, согласно теории Бренстеда, наличие гидроксильного иона не обязательно для оснований и кислоты и основания определяются как донаторы и акцепторы протона, мы можем представить диссоциацию кислых и основных групп общей формулой:
![]()
где А — кислота (донатор протона) и В — основание (акцептор протона). Постоянная диссоциации А кислоты определяется на основе уравнения (3) по следующей формуле:
![]()
Где ![]() — активности соответственно кислоты, основания и водородного иона. Согласно уравнению (1б), постоянная диссоциации карбоксильной группы аминокислоты должна быть представлена следующим образом:
— активности соответственно кислоты, основания и водородного иона. Согласно уравнению (1б), постоянная диссоциации карбоксильной группы аминокислоты должна быть представлена следующим образом:
![]()
и, согласно (2в), постоянная диссоциации аминогруппы равна
![]()
Если для расчета диссоциации аминогруппы вместо уравнения (2б) использовать уравнение (2в), то мы получим
![]()
В разведенных растворах, где коэффициенты активности близки к единице, ими можно пренебречь и активности в вышеприведенных уравнениях заменить молярной концентрацией. Таким образом, последнее уравнение на основе уравнения (2б) может быть написано в следующем виде:
![]()
Поскольку концентрации водородных и гидроксильных ионов определяются уравнением
![]()
член [ОН-] в вышеприведенном уравнении может быть заменен на Кw/[Н+], и уравнение на основе (3а) и (4) может быть представлено в виде
![]()
Кb в разведенных растворах, согласно уравнениям (2s) и (2г), равно
![]()
поэтому отношение Кb' к Кb может быть представлено (см. уравнения 2б, 3 и 4) уравнением ![]()
где Kw — постоянная диссоциации воды, равная приблизительно 10-14. Когда, исходя из этих уравнений, были рассчитаны постоянные диссоциации Ка карбоксильной группы, а также постоянные диссоциации Кb и Кb' аминогрупп, то оказалось, что значение Ка — постоянной диссоциации карбоксильной группы — варьирует от 10-2 до 10-3; для постоянной диссоциации аминогрупп были получены значения Кb' от 10-4 до 10-5 и Кb — от 10-9 до 10-10. Смысл этих постоянных диссоциации становится яснее, если мы рассмотрим тот случай, когда концентрация донатора протона А равна концентрации акцептора протона В. Если [А] = [В], то постоянная диссоциации К равна концентрации ионов водорода:
![]()
Концентрация водородных ионов при этих условиях является мерой диссоциации кислоты или основания. Она указывает точку, в которой отношение ![]()
Или ![]() равно единице. Поскольку принято выражать концентрацию водородных ионов отрицательным логарифмом pH = —Ig[H+], мы можем применить тот же способ и для выражения постоянной диссоциации и написать рКa = = —lgKa и рКb = —IgKb. Следовательно, рКa и рКb равны тому значению pH, при котором 50% аминокислоты находятся в виде дипольных ионов и 50% — в виде катионов или анионов. Эти постоянные определяются электрометрическим титрованием аминокислот соляной кислотой или едким натрием [6]. Если вычертить кривую изменения pH в зависимости от количества кислоты или основания, добавленного к аминокислоте, то значения рКа или рКb будут равны тому значению pH на кривой титрования, которое соответствует 0,5 эквивалента прибавленной кислоты или щелочи на 1 моль аминокислоты.
равно единице. Поскольку принято выражать концентрацию водородных ионов отрицательным логарифмом pH = —Ig[H+], мы можем применить тот же способ и для выражения постоянной диссоциации и написать рКa = = —lgKa и рКb = —IgKb. Следовательно, рКa и рКb равны тому значению pH, при котором 50% аминокислоты находятся в виде дипольных ионов и 50% — в виде катионов или анионов. Эти постоянные определяются электрометрическим титрованием аминокислот соляной кислотой или едким натрием [6]. Если вычертить кривую изменения pH в зависимости от количества кислоты или основания, добавленного к аминокислоте, то значения рКа или рКb будут равны тому значению pH на кривой титрования, которое соответствует 0,5 эквивалента прибавленной кислоты или щелочи на 1 моль аминокислоты.
Если раньше диссоциацию аминогруппы выражали при помощи величины Кb', то в настоящее время предпочитают величину Кb, поскольку она прямо указывает значение pH при 50-процентной диссоциации; величина же Kb' относится к концентрации гидроксильных ионов, которая обычно не определяется, но может быть легко получена вычитанием pH из 14. Однако основное преимущество нового способа выражения постоянных диссоциации заключается в том, что мы оказываемся в состоянии определить эти постоянные и в тех случаях, когда природа реагирующих групп неизвестна. Так, до настоящего времени было неясно, относится ли величина рК 9,1, найденная электрометрическим титрованием для тирозина, к диссоциации фенольной гидроксильной группы на водородный ион и анион или к диссоциации аммонийной группы ![]() на аминогруппу NH2 и водородный ион. Совершенно очевидно, что электрометрическое титрование не вскрывает характера происходящей реакции; оно указывает только на число протонов, связываемых при различных значениях pH. Вместе с тем нет необходимости употреблять разные символы Ка и Kb. Для карбоксильной и аминной групп; удобнее нумеровать постоянные диссоциации в порядке увеличения значения рК — pK1, рК2, рК3 и т. д. Этот способ обозначения постоянных диссоциации использован в табл. 6. Эта таблица показывает, что кислотная и щелочная постоянные ионизации моноаминокислот алифатического ряда варьируют очень незначительно.
на аминогруппу NH2 и водородный ион. Совершенно очевидно, что электрометрическое титрование не вскрывает характера происходящей реакции; оно указывает только на число протонов, связываемых при различных значениях pH. Вместе с тем нет необходимости употреблять разные символы Ка и Kb. Для карбоксильной и аминной групп; удобнее нумеровать постоянные диссоциации в порядке увеличения значения рК — pK1, рК2, рК3 и т. д. Этот способ обозначения постоянных диссоциации использован в табл. 6. Эта таблица показывает, что кислотная и щелочная постоянные ионизации моноаминокислот алифатического ряда варьируют очень незначительно.
Таблица 6 Постоянные ионизации моноаминокислот и пептидов [7]
|
Вещество |
РК1 |
рК2 |
Изоэлектрическая точка |
|
Глицин |
2,35 |
9,78 |
6,1 |
|
Глицилглицин |
3,12 |
8,07 |
5,6 |
|
Аланин |
2,34 |
9,87 |
6,1 |
|
Аланилаланин |
3,17 |
8,42 |
5,8 |
|
Валин |
2,32 |
9,62 |
6,0 |
|
Лейцин |
2,36 |
9,60 |
6,0 |
|
Гексаглицин |
3,05 |
7,60 |
5,32 |
|
Серин |
2,21 |
9,15 |
5,68 |
|
Пролин |
1,99 |
10,60 |
6,30 |
|
Триптофан |
2,38 |
9,39 |
5,89 |
Алифатические боковые цепи приведенных в таблице аминокислот, по-видимому, не оказывают большого влияния на диссоциацию как карбоксильных, так и аминных групп. Кроме того, из таблицы следует, что у пептидов величина pK1 на 0,8 единицы pH выше, а величина рК2 на 1,4—1,7 единицы pH ниже, чем у соответствующих аминокислот. Это означает, что кислотность пептидов слегка снижена, а их основность значительно снижена по сравнению с соответствующими аминокислотами. Таким образом, становится понятным то, что пептиды обладают более сильно выраженными кислотными свойствами, чем аминокислоты, в силу чего гидролиз пептидов сопровождается снижением кислотности раствора, которое можно определить манометрически в атмосфере углекислоты (см. гл. III).
Поскольку аминокислоты в щелочных растворах движутся к аноду, а в кислых к катоду, то существует значение pH, при котором вообще никакого передвижения не происходит. Эта величина pH называется изоэлектрической точкой. Она легко может быть рассчитана из постоянных ионизации, согласно уравнению
![]()
Величины pHI для различных аминокислот приведены в последней графе табл. 6.
Если бы кислотная и щелочная группы аминокислоты были ионизированы в одинаковой степени, бессолевой раствор такой аминокислоты должен был бы иметь то же значение pH, что и чистая вода. Так как у моноаминокислот ионизация карбоксильной группы оказывается выше, чем ионизация аминогруппы, то они являются слабокислыми веществами, изоэлектрическая точка которых лежит около pH 6,0. В водных растворах моноаминокислот, кроме большого количества дипольных ионов ![]()
![]() содержится поэтому также некоторое количество водородных ионов и анионов
содержится поэтому также некоторое количество водородных ионов и анионов ![]()
То обстоятельство, что аминокислоты являются одновременно слабыми кислотами и слабыми основаниями, дает возможность использовать их смеси с сильными кислотами и щелочами в качестве буферных растворов. На фиг. 9 показаны значения pH в смесях глицина с соляной кислотой и едким натрием. Если объемы соляной кислоты или едкого натрия, указанные в диаграмме, обозначить через и, то добавленный объем 0,1 н. раствора глицина будет (10 — v) мл.
Когда аминокислоты, кроме а-аминогрупп и а-карбоксильных групп, содержат еще и другие ионизированные группы, кривые титрования будут осложнены новыми точками перегиба. Постоянные ионизации таких аминокислот, содержащих функциональные группы в своей боковой цепи, приведены в табл. 7. Эта таблица показывает, что аминодикарбоновые кислоты обладают более сильной кислотной группой, чем моноаминокислоты. Последнее находится в соответствии с тем хорошо известным фактом, что органические дикарбоновые кислоты представляют собой сильные кислоты. Из таблицы видно также, что величина рК гидроксильной группы в фенольном кольце тирозина приближенно равна 10,1. Эта группа обладает, следовательно, лишь очень слабыми кислотными свойствами, практически не заряжена в нейтральных растворах и ионизирует только в щелочных растворах.
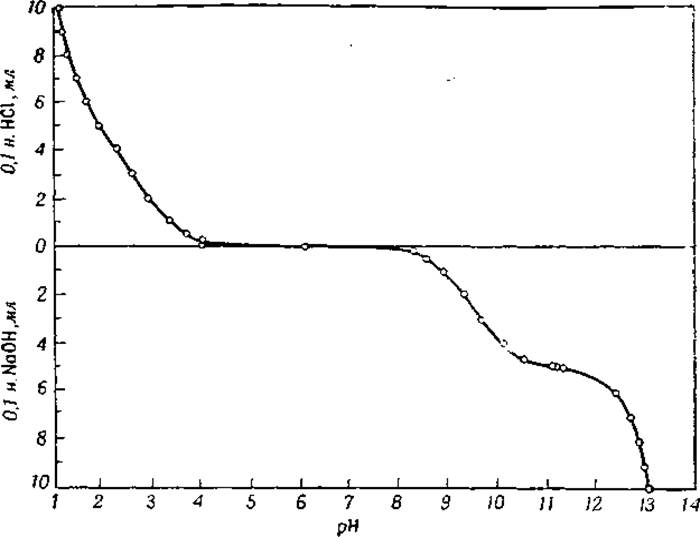
Фиг. 9. Буферное действие глицина [8].
Таблица 7 Постоянные ионизации аминокислот, содержащих функциональные группы в боковой цепи
|
Аминокислoта |
рK1 |
рK2 |
рК3 |
Изоэлектрическая точка |
|
Аспарагиновая кислота |
2,09 (СООН) |
3,87 (СООН) |
9,82 (NH3+) |
3,0 |
|
Глутаминовая кислота |
2,19 (СООН) |
4,28 (СООН) |
9,66 (NH-3) |
3,2 |
|
Тирозин |
2,20 (СООН) |
9,11 (NH+3) |
10,1 (ОН) |
5,7 |
|
Цистеин |
1,96 (СООН) |
8,18 (NH+3) |
10,28 (SH) |
5,07 |
|
Аргинин |
2,02 (СООН) |
9,04 (NH+3) |
12,48 (гуанидин) |
10,8 |
|
Лизин |
2,18 (СООН) |
8,95 (a-NH+3) |
10,53 (ε-NH+3) |
9,7 |
|
Гистидин |
1,77 (СООН) |
6,10 (имидазол) |
9,18 (NH+3) |
Гуанидиновая группа аргинина и є-аминогруппа лизина (рК 12,48 и 10,53) являются сильными основаниями, и их ионизация более резко выражена, чем ионизация аминогрупп моноаминокислот; имидазольная же группа гистидина обладает лишь слабоосновными свойствами. Отдаленные молекулярные группировки оказывают лишь незначительное влияние на постоянные диссоциации аминокислот. В связи с этим можно ожидать, что и постоянные ионизации белков будут близки к постоянным ионизации аминокислот.