Химия и биология белков - Ф. Гауровитц 1953
Электрохимия белков
Ионизация белков. Соединение с водородными ионами
Подобно аминокислотам белки перемещаются к катоду в кислых и к аноду в щелочных растворах; как и аминокислоты, они обладают изоэлектрической точкой, при которой вообще не происходит передвижения [9]. Принято считать, что белки в своей изоэлектрической точке являются многовалентными цвиттерионами и от простых аминокислот отличаются в основном лишь множественностью своих анионных и катионных групп.
Однако этот взгляд был принят не без возражений. Дело в том, что белки в своей изоэлектрической точке обнаруживают минимальную растворимость [10], а хорошо известно, что растворимость органических кислот и оснований увеличивается с их ионизацией. Это правило, однако, не имеет силы для амфолитов. Осаждение белков в их изоэлектрической точке обусловлено электростатическими силами взаимного притяжения между положительно и отрицательно заряженными группами соседних цвиттерионов. Это объяснение находит известную поддержку при рассмотрении явления растворяющего действия добавленных к белку нейтральных солей. Ионы нейтральной соли в силу своего электростатического действия на ионизированные группы, расположенные на поверхности белковой частицы, предотвращают их взаимную агрегацию [11].
На амфотерную природу ионизированных частиц изоэлектрического белка указывает также величина теплоты нейтрализации (сильными кислотами и основаниями). Теплота нейтрализации белков может быть определена калориметрически [12] или рассчитана из температурного коэффициента постоянной ионизации [13]. Оба метода дают величину, равную приблизительно + 10 000 кал на 1 же водородного иона, если кислота добавляется к слабощелочному раствору белков (pH приблизительно 8—9). Порядок этой величины тот же, что и порядок величин, получаемых при добавлении сильных кислот (водородных ионов) к органическим основаниям, но значительно выше, чем теплота ионизации [14] реакции
![]()
Из этих данных очевидно, что реакция, протекающая при pH 8—9, не соответствует приведенной выше реакции, но происходит по уравнению:
![]()
Наиболее убедительное доказательство цвиттерионного строения изоэлектрического белка дает сравнение данных, получаемых при электрометрическом титровании в присутствии формальдегида и без него. Формальдегид, как мы знаем (см. гл. VII), взаимодействует с аминогруппами белков, лишая последние их основных свойств. Если аминокислоты или белки титровать едким натрием в присутствии формальдегида, то типичный перегиб кривой титрования при pH 9, который соответствует превращению ![]() в NН2, исчезает (фиг. 10 и 11); это служит решающим доказательством того, что буферирующее действие белков в этой области pH обусловлено их аминогруппами, а не ионизацией карбоксильных групп [15]. Тот же самый результат получается, если аминогруппы превращать в гидроксильные группы действием азотистой кислоты [16]. Добавление этанола также изменяет ход кривой электрометрического титрования, причем заметно уменьшается постоянная диссоциации карбоксильных групп, в то время как постоянная диссоциации аммонийных групп уменьшается лишь незначительно [17].
в NН2, исчезает (фиг. 10 и 11); это служит решающим доказательством того, что буферирующее действие белков в этой области pH обусловлено их аминогруппами, а не ионизацией карбоксильных групп [15]. Тот же самый результат получается, если аминогруппы превращать в гидроксильные группы действием азотистой кислоты [16]. Добавление этанола также изменяет ход кривой электрометрического титрования, причем заметно уменьшается постоянная диссоциации карбоксильных групп, в то время как постоянная диссоциации аммонийных групп уменьшается лишь незначительно [17].
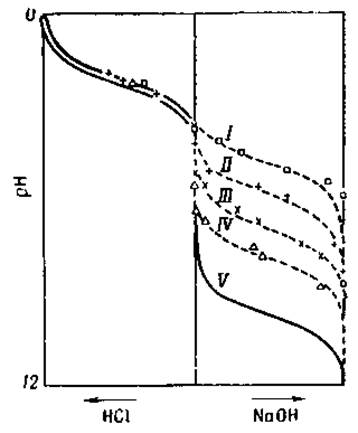
Фиг. 10. Кривая титрования глицина в присутствии возрастающих концентраций формальдегида [18].
I — 2% НСНО; II — 80%, HCHO; III — 20% НСНО; IV — 0,5% НСНО; V — вода.
Хотя кривые, полученные при электрометрическом титровании белков, и подобны кривым титрования аминoкислот, все же между этими процессами имеются некоторые существенные отличия. Ионизация моноаминокислот обусловлена электролитической диссоциацией группировки

т. е. диссоциацией d-аминогруппы и соседней карбоксильной группы. Вследствие близости этих двух групп неизбежно должно возникнуть электростатическое взаимодействие как между самими группами, так и между ними и ближайшими к ним водородными и гидроксильными ионами. Положительно заряженный водородный ион, который притягивается отрицательной карбоксильной группой, будет отталкиваться расположенной по соседству положительно заряженной аммонийной группой. Отрицательный заряд карбоксильной группы будет как бы ослаблен близким соседством положительной аммонийной группы. В связи с этим электростатическое взаимодействие указанных групп имеет очень сложный характер, и результаты его трудно предвидеть. Из табл. 6, однако, следует, что а-карбоксильные группы моноаминокислот (рК приблизительно 2,2) обладают более сильными кислыми свойствами, чем карбоксильные группы соответствующих жирных кислот (рК приблизительно 4,8), и что аминогруппы кислот (рК приблизительно 9,8) имеют менее сильные основные свойства, чем аминогруппы органических аминов (рК приблизительно 10,6).
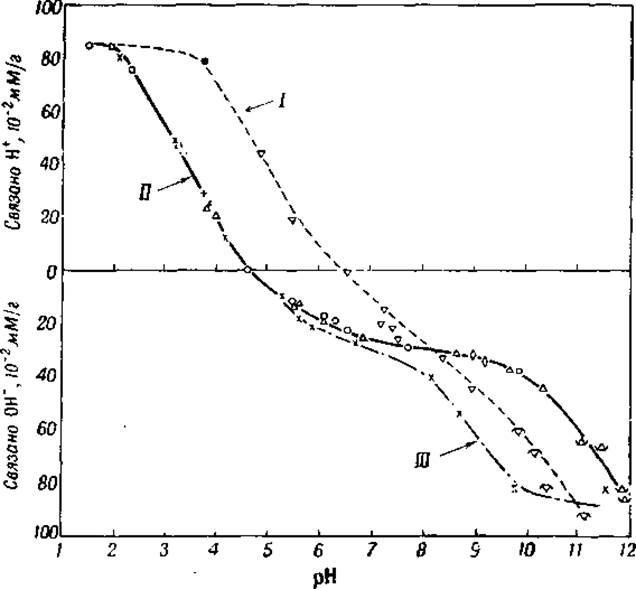
Фиг. 11. Электрометрическое титрование яичного альбумина в воде, 80-процентном этиловом спирте и 1-процентном растворе формальдегида [15].
I — этиловый спирт; II — вода; III — формальдегид.
Белки обладают, по существу, теми же ионными группами, что и аминокислоты. Однако в белке большинство d-аминогрупп и d-карбоксильных групп связаны друг с другом пептидными связями. Кислые группы белков представлены главным образом свободными карбоксильными группами аспарагиновой и глутаминовой кислот, ионизация которых соответствует рК 3,87 и 4,28 (табл. 7). К основным группам белков относятся гуанидиновые группы аргинина (рК 12,48) и ε-аминогруппы лизина (рК 10,53). Гидроксильные группы тирозина и сульфгидрильные группы цистеина отдают свои протоны в одной и той же области pH (рК около 10), в то время как имидазольные группы гистидина титруются вблизи pH 6 (табл. 7).
Кривые электрометрического титрования белков, в связи с буферным действием карбоксильных и аминных групп, дают отчетливые перегибы при pH 3—4 и 10—12. Нет, однако, возможности при помощи электрометрического титрования отдифференцировать небольшое количество концевых d-карбоксильных групп белков от β- и y-карбоксильных групп аспарагиновой и глутаминовой кислот так же, как и конечные d-аминогруппы от ε-аминогрупп лизина. На основе титрования можно сделать лишь одно заключение, что число конечных d-карбоксильных групп не может быть очень велико (см. гл. VII), так как иначе перегиб кривой оказался бы сдвинут от pH 3—4 ближе к pH 2. Перегиб около pH 6—7, который заметен на многих кривых титрования, соответствует буферному действию имидазольных групп гистидина (см. фиг. 11).
Электрометрическое титрование производится при добавлении к изоэлектрическому раствору белка сильных кислот, обычно соляной кислоты, или сильных оснований, например едкого натра. Если мы прибавим соляную кислоту к изоэлектрическому раствору белка, то часть водородных ионов (протонов) будет связана СОО-группами белка и последние превратятся в карбоксильные группы (см. уравнение 16); с другой стороны, некоторые из немногочисленных NH2-rpyпп, присутствующих в изоэлектрическом белке, связывая протоны, превратятся в положительно заряженные аммонийные группы ![]() Максимальное связывание кислоты определяется на кривой титрования расстоянием между горизонтальной линией, которая соответствует изоэлектрической точке, и горизонтальной частью кривой титрования при pH 1—2. Таким же путем по кривой электрометрического титрования изоэлектрического белка едким натром рассчитывается и максимальное связывание основания. Однако точно определить количество связанного основания затруднительно, так как конечная точка выражена в этом случае менее резко, чем при титровании кислотосвязывающих групп [19, 20]. Кроме того, следует помнить, что те гидроксильные ионы, которые используются при электрометрическом титровании в качестве основания, фактически не связываются белком, но соединяются с теми протонами, которые отдают, с одной стороны, положительно заряженные гуанидиновые группы аргинина или аммонийные группы белка
Максимальное связывание кислоты определяется на кривой титрования расстоянием между горизонтальной линией, которая соответствует изоэлектрической точке, и горизонтальной частью кривой титрования при pH 1—2. Таким же путем по кривой электрометрического титрования изоэлектрического белка едким натром рассчитывается и максимальное связывание основания. Однако точно определить количество связанного основания затруднительно, так как конечная точка выражена в этом случае менее резко, чем при титровании кислотосвязывающих групп [19, 20]. Кроме того, следует помнить, что те гидроксильные ионы, которые используются при электрометрическом титровании в качестве основания, фактически не связываются белком, но соединяются с теми протонами, которые отдают, с одной стороны, положительно заряженные гуанидиновые группы аргинина или аммонийные группы белка
![]()
и, с другой стороны, незаряженные гидроксильные группы тирозина [21] или сульфгидрильные группы цистеина
![]()
Ясно, что дело заключается здесь не в действительном связывании основания, но в переносе протонов от кислых групп белка к гидроксильным ионам.
Результаты электрометрического титрования для многих белков достаточно хорошо совпадают с результатами химического определения аминокислотного состава. Так, общее число анионных и катионных групп, определенное электрометрически в яичном альбумине, лактальбумине [19] и сывороточном альбумине [22], почти совпало с числом кислых и основных аминокислот, найденных при соответствующем химическом анализе. В других белках, однако, например в инсулине, был обнаружен значительный избыток групп, титруемых в щелочной области pH [22], что объясняется наличием в инсулине большого числа конечных d-аминогрупп.
Изоэлектрический белок содержит положительно и отрицательно заряженные группы в одинаковом количестве, поэтому его суммарный свободный заряд равен нулю и при наложении электрического поля не происходит движения ни к одному из полюсов. Изоэлектрический белок, однако, не представляет собой истинного гомогенного вещества, но является смесью частиц, содержащих слабый избыток положительных или отрицательных зарядов. Так, например, в растворе изоэлектрического гемоглобина при pH 6,9 только 22,4% молекул гемоглобина точно изоэлектричны (свободный заряд равен нулю), в то время как содержание молекул, несущих 1, 2, 3 и более, положительных зарядов, составляет соответственно 17; 9,4; 3,9 и 1,5%, а содержание молекул, несущих 1, 2, 3 и более отрицательных зарядов, выражается цифрами 21,2; 14,2; 3,0 и 2,5% [23].
Изоэлектрическая точка белка зависит от числа и от постоянных ионизации ионизированных групп. Поскольку диссоциация каждой способной ионизировать группы находится под влиянием электростатического воздействия соседних ионных групп, не существует строго постоянной зависимости между отношением максимального числа воспринимаемых протонов к максимальному числу отдаваемых протонов, с одной стороны, и изоэлектрической точкой белка — с другой. Это видно из табл. 8, где I — изоионная точка (pH электродиализированного белкового раствора), а — максимальное количество воспринимаемых 105 г белка протонов и b — максимальное количество протонов, отдаваемых 105 г белка (в граммэквивалентах).
Таблица 8 Зависимость изоионной точки белка от степени его ионизации в растворе
|
Белок |
1 |
а |
b |
c/b |
|
Яичный альбумин |
4,74 |
110 |
134 |
0,82 |
|
Сывороточный альбумин |
5,34 |
148 |
159 |
0,92 |
|
Гемоглобин |
6,97 |
156 |
127 |
1,23 |
Зависимость изоэлектрической точки от постоянных ионизации диссоциирующих групп становится очевидной из результатов определения изоэлектрической точки в присутствии различных концентраций этилового спирта. Поскольку этиловый спирт уменьшает главным образом константу диссоциации карбоксильных групп (см. предыдущий раздел), он смещает изоэлектрическую точку в сторону более высоких значений pH. В растворах желатины, содержащих 80% этилового спирта, изоэлектрическая точка соответствует pH 6,0, в то время как в водных растворах она соответствует pH 4,9 [15].
Если толкование данных электрометрического титрования аминокислот и простых пептидов относительно несложно, то при интерпретации кривых титрования белков возникает ряд трудностей, зависящих от следующих обстоятельств.
1. Белки являются многовалентными цвиттерионами, содержащими большое число положительно и отрицательно заряженных групп. Кривые титрования показывают, что для нейтрализации 1 г белка требуется приблизительно 1 мМ кислоты или основания. Молекулярный вес белка имеет порядок 100 000, и, следовательно, на одну белковую молекулу приходится около 100 отрицательных и 100 положительных групп. Эти цифры довольно хорошо согласуются с данными соответствующего анализа, определяющими количество аминодикарбоновых кислот, аммиака и основных аминокислот в белковой молекуле. Однако точно установить число содержащихся в молекуле ионизированных групп затруднительно, так как на кривой титрования происходит некоторое перекрывание, особенно в щелочной области pH между 8 и 12; pH 8,5 принято в качестве конечной точки нейтрализации основных групп до некоторой степени произвольно [24].
2. Белки в присутствии кислот и оснований лабильны. Некоторые белки денатурируются при значениях pH ниже 2 или выше 11, вследствие чего точные определения ионизации нативных белков в этих областях pH становятся невозможными. Скорость денатурации может быть снижена, если определения проводить при низких температурах. Если денатурации избежать нельзя, то ее влияние можно до некоторой степени исключить, измеряя pH непосредственно после смешивания белка с кислотой или основанием и далее — через определенные промежутки времени. Нейтрализация ионизированных групп происходит немедленно, в то время как денатурация, как правило, наступает позднее. Этим путем обе реакции можно отделить одну от другой [25].
3. Белки легко взаимодействуют с другими ионами, кроме водородных, в частности с ионами кальция, магния, фосфата и бикарбоната. Образующиеся связи настолько прочны, что указанные ионы нельзя отделить ни диализом, ни электрофорезом, и лишь электродиализом удается это сделать [26]. Прочность связей образующихся между молекулами белка и ионами кальция или фосфата обусловлена высоким электростатическим действием двувалентных неорганических ионов. Одновалентные ионы, например ионы калия, натрия или хлора, связываются менее прочно; поэтому для электрометрического титрования и используют едкий натрий, едкий калий и соляную кислоту. Недавно, однако, было найдено, что белки соединяются также и с ионами хлора [27]. Наиболее вероятно, что последние связываются положительно заряженными группами белковой молекулы.
В процессе адсорбции противоионов ионизированные группы белка нейтрализуются, в результате чего, в конечном счете, видоизменяются электрохимические свойства белка [28]. Так, например, было установлено, что изоэлектрическая точка белка зависит от характера и концентрации ионов, присутствующих в растворе [29, 30].
Сдвиг изоэлектрической точки особенно велик тогда, когда в растворе находятся многовалентные ионы, например ионы фосфатов. Это обстоятельство затрудняет применение в качестве буферов солей с многовалентными ионами, обычно используемых для этой цели в пределах pH между 6 и 7. Михаэлисом [31] было предложено поэтому использовать барбитурат в качестве буфера для этой области pH.
Как видно из изложенного, изоэлектрическая точка белка зависит от наличия посторонних ионов, в связи с чем она непостоянна. Для того чтобы обозначить pH чистого белка, растворенного в воде в отсутствие солей, употребляют термин изоионная точка [32]. Однако определение изоионной точки также встречает много затруднений и часто невозможно, поскольку многие белки нерастворимы в отсутствие солей. Кроме того, проводимость бессолевых растворов белков очень низка. Изоионная точка карбоксигемоглобина крови овцы лежит при pH 7,6, в то время как изоэлектрическая точка того же белка в аммонийно-фосфатном буфере варьирует в пределах 6,70—7,16 [33].
4. Известные осложнения в толковании данных электрометрического титрования белков обусловливаются, наконец, взаимодействием между самими белковыми цвиттерионами. Две или более белковые молекулы могут образовать агрегат (мицеллу) в результате возникновения солеобразных связей между положительно и отрицательно заряженными группами соседних молекул. Выше уже было упомянуто, что нейтральные соли тормозят образование нерастворимых белковых осадков. Это же справедливо и для образования растворимых агрегатов. Так, например, молекулы сывороточного глобулина образуют агрегаты в течение электродиализа, когда большая часть солей уже удалена [35]. Наряду с белками простые аминокислоты также обнаруживают стремление к связыванию друг с другом и образованию таких же солеподобных соединений [35].
Перечисленные выше трудности коренятся в сложности самого строения белков. Кроме этих трудностей, при попытке объяснения результатов электрометрического титрования и электрофореза мы должны принять во внимание еще и другой осложняющий момент общего характера. В большинстве экспериментов концентрацию водородных ионов определяют при помощи обычных электродов. При таком определении измеряется не фактическая концентрация водородных ионов [Н+], но лишь их активность в переносе электричества аH+, которая равна [Н+]у, где у — коэффициент активности. Результаты электрометрических титрований и электрометрических определений обычно относят к активности водородных ионов, и термин pH часто заменяют термином рdH+. Но и это также является упрощением, поскольку активность водородных ионов зависит от природы и концентрации других присутствующих в растворе ионов. Истинные концентрация и активность водородных ионов неопределимы [36]. Величины, получаемые при обычных определениях, могут, однако, служить для целей сравнения и считаться близкими к истинной активности водородных ионов, хотя и не тождественными ей [37, 38].