Химия и биология белков - Ф. Гауровитц 1953
Внутренняя структура глобулярных белков
Денатурация белков
Необратимое свертывание белка яиц при нагревании — явление хорошо известное. Подобное изменение в состоянии указанного белка может быть вызвано и действием ряда других физических и химических агентов: сильным встряхиванием, облучением ультрафиолетовыми лучами, действием ультразвуковых волн, кислот, щелочей, органических растворителей, солей тяжелых металлов, мочевины, гуанидина, салицилатов и многих других веществ. При всех этих воздействиях белок теряет свою первоначальную растворимость и в большинстве случаев становится нерастворимым при изоэлектрической точке. В отличие от других белков коллаген при нагревании в воде растворяется. Измененные под влиянием всех указанных воздействий нативные белки получили название денатурированных белков. Денатурация часто сопровождается потерей биологической активности белков. Так, например, ферменты теряют свою каталитическую активность, гормоны — физиологическую функцию, антитела — способность соединяться с антигеном. Эти изменения не всегда протекают параллельно изменениям физико-химических свойств белков. Денатурация, очевидно, представляет собой комплексное явление. Вряд ли можно думать, что действие столь различных соединений, как мочевина и серная кислота, а также влияние нагревания обусловливают одно и то же изменение белков. Нельзя поэтому просто говорить о денатурации белков, например яичного альбумина; необходимо всегда указывать, какой именно агент вызвал денатурацию.
Явление денатурации белков пытались объяснить с различных точек зрения. Денатурация, обусловленная нагреванием, рассматривалась как типичная и привлекала поэтому особое внимание. Первоначально предполагали, что при денатурации, вызываемой нагреванием, происходит дегидратация или образование связей между некоторыми свободными аминными и карбоксильными группами. В дальнейшем, однако, было высказано обратное предположение, состоящее в том, что денатурация при нагревании обусловлена разрывом пептидных связей. Оба эти предположения подверглись экспериментальной проверке при помощи дилатометрических методов, т. е. методов, позволяющих определить изменения в объеме. Поскольку гидратация белков сопровождается уменьшением объема, дегидратация должна вести к его увеличению (см. гл. III). Увеличения объема следовало ожидать также при образовании новых пептидных связей, так как при этом должна выделяться вода, согласно реакции
R ∙ NH2 + НООС ∙ R' —R ∙ NH ∙ СО ∙ R' + Н2О.
Дилатометрические определения показали, однако, что тепловая денатурация белков не сопровождается заметными изменениями в объеме [131, 132]. Гидратация денатурированных белков во влажном воздухе также оказалась лишь немногим меньше, чем гидратация нативных белков. Это означает, что денатурированные и нативные белки обладают примерно одинаковой способностью связывать воду [28, 133].
Первая достаточно обоснованная теория денатурации была выдвинута By [134]. Согласно этой теории, денатурация возникает вследствие разрыва денатурирующим агентом слабых связей, удерживающих пептидные цепи вместе, — разрыва, который сопровождается соответствующим изменением в расположении этих цепей. Если сочетать эту концепцию By с изложенными выше данными относительно строения глобулярных белков, то можно сказать, что при денатурации белка происходит изменение его специфической внутренней структуры, причем сложенные в складки пептидные цепи развертываются. В зависимости от особенностей действия денатурирующего агента, ставшие свободными пептидные цепи могут остаться развернутыми (фиг. 29,11), могут вновь сложиться в складки с образованием прежней специфической структуры (фиг. 29,1) или же, наконец, образовать новую структуру (фиг. 29,ІІІ), отличную от прежней.

Фиг. 29. Схемы процесса денатурации белков.
Если рассматривать проблему денатурации с энергетической точки зрения, то представляется очевидным, что должен существовать какой-то энергетический барьер, защищающий нативные белки от денатурации, которая могла бы наступить в результате тепловых колебаний пептидных цепей. В случае преодоления этого барьера денатурирующим агентом, пептидные цепи освобождаются. При этом форма и расположение пептидных цепей будут зависеть от их массы, электрических зарядов и от механического напряжения; величина последнего определяется, в свою очередь, давлением прилегающих друг к другу цепей и ударами молекул растворителя [135]. В связи с этим степень денатурации белка может варьировать от небольших структурных изменений до полного изменения в расположении пептидных цепей. Развертывание пептидных цепей при денатурации подтверждается тем. что денатурированные белки дают более интенсивные цветные реакции, чем нативные белки. Это было впервые установлено для реакций на сульфгидрильные группы цистеина и на дисульфидные группы цистина [136]1. Реакция с нитропуссидом, титрование железосинеродистым калием [39], ацетилирование [137] и полярография [138] — все эти методы определения сульфгидрильных и дисульфидных групп показали, что число этих групп в денатурированных белках больше, чем в тех же белках, находящихся в нативном состоянии. Денатурированные белки дают также более интенсивные цветные реакции на тирозин с фосфорномолибденовой кислотой [139, 140] и с диазореактивом [141], а на аргинин с реактивом Сакагуши [142] и присоединяют большие количества иода [143]. В то время как в нативном лактоглобулине только 12 ε-аминогрупп лизина реагируют с динитрофторбензолом, в денатурированном лактоглобулине эту реакцию дает 31 ε-аминогруппа, т. е. все содержащиеся в нем ε-аминогруппы [144]. Таким образом, все приведенные данные подтверждают ту точку зрения, что при денатурации в связи с развертыванием пептидных цепей становятся доступными те активные группы, которые в нативных белках недоступны для соответствующих реактивов. Подобным же образом можно объяснить меньшую устойчивость ряда денатурированных белков по отношению к действию трипсина. Как известно, многие денатурированные белки гораздо легче расщепляются трипсином, чем те же самые белки в нативном состоянии. Это можно рассматривать как следствие того, что при денатурации разрываются связи, тесно удерживающие пептидные цепи друг около друга, и обнажаются те пункты, на которые может воздействовать фермент [146, 147]. Можно полагать, что трипсин, гидролизуя (хотя и медленно) нативные белки, гидролизует, в сущности, содержащиеся в них следы денатурированных белков. При этом процессе должно происходить непрерывное нарушение равновесия в системе нативный белок — денатурированный белок и смещение этого равновесия в правую сторону.
1 В своей недавно опубликованной работе А. Г. Пасынский и Р. С. Черняк (Биохимия, 17, 198, 1952) показали, что в присутствии концентрированных растворов мочевины окисляемость сульфгидрильных групп железосинеродистым калием значительно повышается. Авторы считают, что разрыв водородных связей, происходящий под влиянием мочевины, освобождает и водород сульфгидрильных групп, в результате чего этот водород становится более доступным для действия окислителей. По мнению авторов повышенную окисляемость сульфгидрильных групп белков, денатурированных мочевиной, нельзя поэтому рассматривать непременно как следствие структурных изменений белковых глобул. — Прим. ред.
О перестройке пептидных цепей при денатурации свидетельствуют также увеличение двойного лучепреломления в потоке [149], сдвиг изоэлектрической точки в сторону повышения pH [150] и потеря белками способности соединяться с кислыми красками [151]. Превращение конго красного в конго синий при pH 1—2 тормозится денатурированным альбумином, но не нативным [152].
В некоторых случаях денатурация сопровождается образованием больших белковых агрегатов, в других же, наоборот, образуются мелкие молекулы. Осмометрические определения, проведенные Бёрком [153], показали, что денатурация гемоглобина, казеина и эдестина концентрированными растворами мочевины ведет к дезагрегации молекул этих белков. Молекулярный вес образующихся продуктов равен соответственно 34 300, 33 600 и 49 500, тогда как молекулярный вес нативного гемоглобина составляет 68 000, а нативного эдестина — 212 000. Сывороточный альбумин, сывороточный глобулин и яичный альбумин обнаруживают один и тот же молекулярный вес в водных растворах и в концентрированных растворах мочевины. С другой стороны, при денатурации яичного альбумина кислотами, щелочами или нагреванием образуются агрегаты, содержащие от 5 до 20 молекул [154]. При небольших сдвигах pH или изменении концентрации солей в растворе, а также при действии ультразвука молекула гемоцианина делится пополам или на восемь частей [155, 156]. Подобным же образом расщепляются пополам при образовании мономолекулярных пленок на поверхности солевых растворов молекулы лактоглобулина с молекулярным весом 35 000 и молекулы инсулина [157]. Дезагрегация молекул инсулина может быть предотвращена солями меди [158].
Изменения в серологической специфичности белков при денатурации также свидетельствуют о нарушении их специфической структуры. Денатурированный яичный альбумин гораздо хуже реагирует со специфическим антителом, и количество образуемого им соединения составляет лишь 1—2% того количества, которое образуется нативным яичным альбумином [154, 159]. Тот факт, что сложное специфическое расположение пептидных цепей меняется при денатурации, сам по себе не вызывает удивления. Почти каждый физический или химический агент способен менять лабильную структуру нативных белков. Денатурирующее действие минеральных кислот и едких щелочей может быть объяснено их влиянием на ионные группы белков. Минеральные кислоты превращают отрицательную группу ![]() в группу —СООН, в связи с чем связь
в группу —СООН, в связи с чем связь ![]() — разрывается и пептидная цепь развертывается. Подобным же образом снимается положительный заряд при действии на белки щелочей. О развертывании пептидных цепей белков в кислотах и щелочах свидетельствует также увеличение вязкости их растворов [131]. Если добавленная к раствору белка кислота или щелочь нейтрализуются, то восстанавливается амфотерное состояние белков, причем вновь образуются некоторые из прежних солевых мостиков. Однако часть положительно заряженных групп соединяется при этом уже не с теми отрицательно заряженными группами, с которыми они были соединены в нативном белке до его денатурации. Некоторые положительные и отрицательные группы, расположенные на поверхности денатурированных молекул белка, могут также образовать связи с противоположно заряженными группами другой белковой молекулы, в результате чего возникают межмолекулярные солевые мостики. Этим можно объяснить возникновение больших нерастворимых агрегатов белковых молекул и свертывание денатурированных белков [132].
— разрывается и пептидная цепь развертывается. Подобным же образом снимается положительный заряд при действии на белки щелочей. О развертывании пептидных цепей белков в кислотах и щелочах свидетельствует также увеличение вязкости их растворов [131]. Если добавленная к раствору белка кислота или щелочь нейтрализуются, то восстанавливается амфотерное состояние белков, причем вновь образуются некоторые из прежних солевых мостиков. Однако часть положительно заряженных групп соединяется при этом уже не с теми отрицательно заряженными группами, с которыми они были соединены в нативном белке до его денатурации. Некоторые положительные и отрицательные группы, расположенные на поверхности денатурированных молекул белка, могут также образовать связи с противоположно заряженными группами другой белковой молекулы, в результате чего возникают межмолекулярные солевые мостики. Этим можно объяснить возникновение больших нерастворимых агрегатов белковых молекул и свертывание денатурированных белков [132].
Если денатурирование белка вызывается нагреванием, то белок остается в состоянии цвиттериона, разрыв же имевшихся солевых мостиков происходит вследствие обусловленного нагреванием усиленного движения пептидных цепей. Одновременно, однако, происходит образование новых межмолекулярных и внутримолекулярных мостиков, в результате чего белки свертываются. Развертывание пептидных цепей не может происходить, если вода не проникает в промежутки между пептидными цепями, поэтому сухие белки более устойчивы к нагреванию, чем их растворы1. По этой же причине концентрированные растворы белков обладают более высокой устойчивостью по сравнению с разбавленными растворами. Кристаллы сывороточного альбумина сохраняют свою форму при нагревании [160].
Денатурация белков, возникающая при сильном встряхивании или помешивании их растворов, связана с образованием пены и представляет собой поверхностную денатурацию белковых пленок, образующихся на пузырьках воздуха пены. При обсуждении вопроса об образовании белковых пленок уже указывалось, что образование этих пленок сопровождается полным развертыванием пептидных цепей и возникновением тонких слоев, высота которых соответствует поперечному диаметру пептидной цепи (см. гл. VI). Понятно поэтому, что при образовании пленок все сульфгидрильные группы становятся доступными и могут быть определены титрованием железосинеродистым калием [161]. С другой стороны, денатурированные белки не могут так легко, как нативные, образовывать мономолекулярные пленки, так как внутримолекулярные и межмолекулярные силы, обусловливающие притяжение их групп, настолько велики, что их не могут преодолеть силы, вызывающие образование пленок [162]. При растворении, однако, и денатурированные белки часто образуют мономолекулярные пленки, причем эта способность повышается, если их предварительно подвергнуть кратковременному действию трипсина [163].
1 В. В. Пономаревым (Биохимия, 16, 556, 1951) найдено, что глиадин денатурируется при нагревании не только в растворе, как это принималось ранее, но и в сухом состоянии (содержание воды в препаратах было равно 8,5%). При нагревании сухого глиадина в течение 60 мин. при 70° происходит падение его растворимости в спирте, уменьшение молекулярного веса, уменьшение теплоты, выделяемой при взаимодействии с водой, и увеличение вязкости его спиртовых растворов. Данные рентгеноскопических исследований, проведенных автором, указывают на разрушение кристаллической решетки глиадина по мере его денатурации. — Прим. ред.
Сухие нативные белки денатурируются при сильном растирании их порошков [164]. В этих случаях денатурация, очевидно, обусловлена механической деформацией пептидных цепей или их разрывом. Большинство белков не денатурируется, если их растворы подвергать повторному замораживанию и оттаиванию [126]. Однако растворимость липопротеидов и биологические свойства некоторых антител меняются при таком воздействии [28]. Вопрос о денатурации при замораживании имеет очень большое значение при разрешении ряда проблем, касающихся технологии замораживания пищевых продуктов [165].
Денатурация, вызванная действием ультрафиолетовых лучей, представляет сложную реакцию. Ясно, что только поглощенные лучи оказывают действие на белки. Как уже упоминалось выше, ультрафиолетовые лучи поглощаются главным образом ароматическими кольцами тирозина, фенилаланина и триптофана, причем кривые поглощения белков заметно не отличаются от кривых поглощения их гидролизатов (см. фиг. 27). И, действительно, было установлено, что при фотолизе разрываются только те пептидные связи, которые прилегают к ароматическим кольцам [166], и что эффективными в этом отношении являются только те волны, которые поглощаются указанными кольцами, т. е. волны длиной около 2 700 Å. Квантовый выход в этих опытах был очень низок.
Так, например, при инактивации пепсина лучами длиной 2 537 Å он оказался равным лишь 0,0025 [167], другими словами, только 1 из 400 поглощенных квантов был эффективен. Лучи с длиной волны между 2 700 и 2 800 Å оказывают одинаковое действие на белки при аэробных и анаэробных условиях, лучи же с длиной волны от 3 000 до 4 000 Å вызывают фотоокисление белков [168].
Такое же окисление может иметь место и при действии на белки ультразвуковых волн. Эти волны могут влиять на белки тремя различными путями: 1) действуя на механические колебания молекул; 2) вызывая нагревание и 3) обусловливая выделение кислорода из воды [169]. При действии ультразвуковых волн кольца ароматических аминокислот разрушаются [169].
Ультразвуковые волны низкой частоты обусловливают дезагрегацию белков, волны же высокой частоты, наоборот, вызывают образование нерастворимых агрегатов [170].
Наибольший интерес представляет действие тех денатурирующих агентов, которые являются нейтральными и, на первый взгляд, индифферентными веществами. К числу таких веществ принадлежат мочевина, некоторые кислотные амиды и производные гуанидина. Мочевина не обладает ни кислыми, ни щелочными свойствами, не оказывает влияния на поверхностные явления и не вызывает токсического действия. Она, однако, является одним из немногих соединений, повышающих диэлектрическую постоянную воды. Можно думать поэтому, что мочевина представляет собой диполь и что в водных растворах нормальная неполярная структура NH2∙ СО ∙ NH2 превращается в полярную форму:
![]()
Денатурирующее действие концентрированных растворов мочевины объясняется, вероятно, образованием водородных связей с пептидными группировками. Возможно, что небольшие полярные молекулы мочевины при своем тепловом движении вдвигаются, как клинья, между пептидными цепями, разрывая имеющиеся водородные мостики и образуя новые с освободившимися группами. Это может быть показано следующими формулами, в которых длинные горизонтальные линии обозначают две параллельные пептидные цепи:

Этим путем мочевина может вызвать развертывание пептидных цепей и денатурацию белков. Обычно применяют концентрации мочевины порядка 40—60%. Такое же действие, как мочевина, оказывают некоторые кислотные амиды, формула которых (R ∙ СО ∙ NH2) аналогична формуле мочевины (мы можем рассматривать мочевину как диамид угольной кислоты) [172]. Мочевина вызывает быструю денатурацию яичного альбумина при температуре 6°, при более же высоких температурах, вплоть до 37° денатурация яичного альбумина мочевиной протекает гораздо медленнее [173]. Причина этого странного явления до сих пор неясна.
Как указывалось выше, молекулы некоторых белков в присутствии мочевины распадаются на более мелкие единицы (это свидетельствует о том, что эти единицы связаны друг с другом водородными мостиками). Согласно классическим химическим представлениям, мы должны были обозначить эти мелкие единицы как истинные молекулы, а более крупные частицы, которые мы до сих пор называли молекулами, назвать мицеллами или молекулярными комплексами [174]. Это, в особенности, относится к тем случаям, когда субъединицы обладают теми же биологическими свойствами, что и их полимеры. Надо, однако, отметить, что расщепление больших комплексов на субъединицы нередко сопровождается потерей определенных биологических свойств.
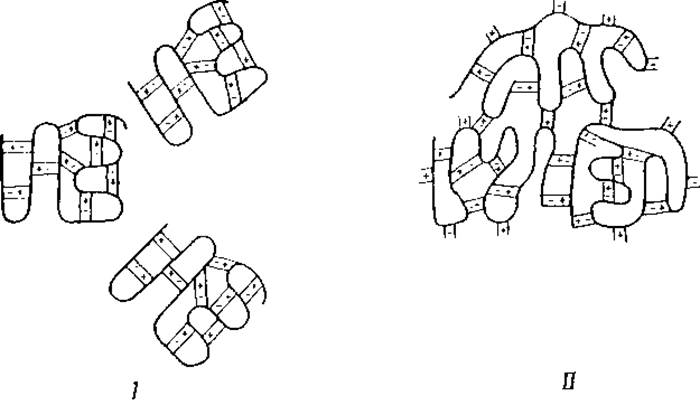
Фиг. 30. Солевые мостики [132].
І — внутримолекулярные; II — межмолекулярные.
Денатурация часто сопровождается очень резкими изменениями в растворимости белков. Если удалить денатурирующий агент, то при pH раствора, близком к изозлектрической точке белка, белок свертывается. Выше уже указывалось, что свертывание белков может быть обусловлено образованием межмолекулярных солевых мостиков между ионными группами, располагающимися на поверхности белковой молекулы при развертывании пептидных цепей. Это предположение подтверждается тем, что щелочные протамины легко вступают в соединение с денатурированными альбуминами, но нe реагируют с нативными [129].
На фиг. 30 схема І изображает молекулу нативного белка, имеющую только внутримолекулярные солевые мостики, схема II представляет молекулы денатурированных белков, соединенные друг с другом межмолекулярными солевыми мостиками. На этих схемах образование структур, протекающее фактически в трех измерениях, представлено на плоскости, т. е. в двух измерениях. Гипотеза, приписывающая свертывание белков образованию солевых мостиков между ионными группами белков, принимается, однако, далеко не всеми исследователями. Некоторые из них считают, что нерастворимость денатурированных белков связана с пространственным перераспределением полярных и неполярных групп, которое выражается в переносе неполярных, гидрофобных групп на поверхность молекулы1 [134, 175, 176].
Денатурация и свертывание некоторых белков могут быть предотвращены прибавлением концентрированных растворов глюкозы или других сахаров [177]. Свертывание сывороточного альбумина при нагревании тормозится также щелочными солями жирных кислот [178], кислыми красками, например конго красным [152], мочевиной и некоторыми другими соединениями. Действие всех этих веществ, возможно, обусловлено тем, что они адсорбируются на глобулярной молекуле белков, в связи с чем белок представляет собой центр большого растворимого комплекса. В некоторой степени денатурация белков может быть заторможена повышением вязкости растворителя, так как высокая вязкость замедляет движения пептидных цепей и затрудняет их развертывание. В этом же направлении действует и повышение давления [179].
Скорость денатурации одних и тех же белков, выделенных из крови различных видов животных, может резко различаться. Это было показано на примере денатурации гемоглобинов разных видов животных едким натром. Так, например, гемоглобин человека денатурируется на 50% 0,05 н. раствором едкого натра в течение 20—30 сек., между тем денатурация на 50% гемоглобина быка происходит лишь в течение нескольких часов [180]. Интересно отметить, что скорость денатурации обоих гемоглобинов при нагревании или при действии соляной кислоты одинакова [181]. Эти данные могут быть объяснены тем, что разные денатурирующие агенты действуют на различные группировки белков, образуя отличающиеся друг от друга конечные продукты [182].
1 Этот вопрос детально освещен в работах Д. Л. Талмуда н С. Е. Бреслсра (С. Е. Бреслер, Д. Л. Талмуд, ДАН СССР, 63, 326, 367, 1944; Д, Л. Талмуд, Коллоид. жури., 4, 247, 1946). — Прим. ред.
Если денатурирующий агент удалить из среды или приостановить денатурацию каким-либо другим путем, то может произойти восстановление нативных свойств белка. Так, например, некоторые ферментные белки после нагревания и последующего охлаждения обнаруживают такую же ферментную активность, как и до этой обработки (см. гл. XII) [183]. Имеются также данные об обратимости денатурации гемоглобина [184]. Надо, однако, указать, что хотя восстановленные белки очень похожи по своим свойствам на нативные, все же при помощи чувствительных методов удается обнаружить некоторые различия [185]. Восстановленные белки расщепляются протеолитическими ферментами таким же образом, как и нативные белки [147], но их растворимость, форма кристаллов и электрофоретическая подвижность слегка отличаются от соответствующих показателей нативных белков [186]. Восстановленный гемоглобин денатурируется едкой щелочью с гораздо большей скоростью, чем нативный гемоглобин [187]. Все эти данные показывают, что полного восстановления не происходит. Надо указать, что со статистической точки зрения полное восстановление, т. е. возвращение к прежнему виду каждой мельчайшей детали, вообще очень мало вероятно. В макромолекуле, имеющей размер, равный размеру молекулы белка, можно допустить наличие бесконечного числа энергетически эквивалентных сочетаний. Только в том случае, когда сочетания пептидных цепей в молекуле белка очень стойки и когда они обусловливают меньшие напряжения и искривления пептидных цепей, чем любые другие сочетания, — только в этом случае можно ожидать, что большинство этих цепей примет прежнее положение при прекращении действия денатурирующего агента. Такое почти полное восстановление до нативного состояния наблюдается у белка, полученного из соевых бобов и обладающего свойством тормозить действие трипсина [188]. В пределах температуры между 35 и 50° раствор этого белка содержит смесь нативного и денатурированного белков, причем отношение нативный белок/денатурированный белок определяется температурой раствора: чем выше температура, тем ниже это отношение. Денатурированный белок отличается от нативного своей нерастворимостью при pH 4,5. Поскольку взаимное превращение нативного и денатурированного белков происходит очень медленно, они могут быть отделены друг от друга путем осаждения денатурированного белка [188]. Другим примером обратимой денатурации может служить денатурация белка Бенс-Джонса при нагревании его растворов. Эти растворы прозрачны при комнатной температуре и при температуре выше 60°, но мутны при температуре между 45 и 60°.
Сочетание пептидных цепей у этих белков, очевидно, настолько стабильно, что при понижении температуры происходит почти полное восстановление их нативной структуры. С физикохимической точки зрения это свойство указанных белков может быть сравнено с таутомерией органических соединений [189], поскольку хорошо известно, что равновесие между двумя и более таутомерными формами часто зависит от температуры системы. Восстановление денатурированных белков до нативного состояния представляет собой с этой точки зрения не что иное, как восстановление равновесия после прекращения действия агента, вызвавшего его нарушение.
Если сочетание пептидных цепей в нативном белке представляется менее стабильным, чем другие возможные сочетания, то денатурация будет необратимой и денатурированный белок будет сохранять то расположение пептидных цепей, которое возникло в связи с денатурацией. Поскольку каждый белок содержит сотни аминокислот, возможности для частичной денатурации и ренатурации неисчислимы; другими словами, сочетания пептидных цепей в денатурированном и в восстановленном белках представляют собой промежуточные варианты между сочетанием пептидных цепей в нативном белке и их сочетанием в различных белках, образующихся при более или менее полной денатурации.
Многие исследователи полагают, что денатурация подчиняется закону «все или ничего», т. е. что денатурация всегда протекает полностью и никогда частично [190]. Это мнение трудно проверить экспериментально, поскольку лишь немногие свойства денатурированных белков поддаются количественному измерению. Нерастворимость денатурированного белка не может быть использована как критерий денатурации, так как коагулят нерастворимого денатурированного белка может адсорбировать молекулы нативного белка и, наоборот, само свертывание денатурированного белка может тормозиться благодаря защитному действию остающегося в растворе нативного белка. Поскольку мы не имеем в своем распоряжении достаточно надежных и доступных методов для решения вопроса о том, содержит ли денатурированный раствор белка частично денатурированные молекулы или же он содержит смесь нативных и полностью денатурированных молекул, весь вопрос остается открытым [130].
Из сказанного выше ясно, что процесс денатурации можно рассматривать как со статистической, так и с энергетической точки зрения. Энергетика денатурации может быть исследована количественно на основании законов термодинамики. Согласно второму закону термодинамики, для каждой реакции верно следующее уравнение:
∆Н = ∆F + Т∆S, (1)
где ∆Н — теплота реакции, т. е. разница в теплоте системы до и после реакции. Если обозначить количество теплоты в нативном белке через НН, а в денатурированном белке через НД, то теплота денатурации будет равна ∆Н = НД — НН. Обычно принято выражать ∆Н в виде положительной величины, если в процессе реакции энергия потребляется, и в виде отрицательной величины, если энергия выделяется. Положительный знак величины ∆Н указывает, таким образом, на то, что реакция является эндотермической, а отрицательный знак — на то, что реакция экзотермична.
Количество теплоты в каком-либо веществе при абсолютной температуре Т = t° К равно тому количеству теплоты, которое необходимо, чтобы температуру вещества повысить от Т = 0° К до Т = t° К. Соответствующая величина не может быть определена непосредственно, но мы имеем возможность вычислить теплоту денатурации ∆Н из постоянных равновесия К1 и К2, определенных при двух различных температурах Т1 и Т2. Если концентрации нативного и денатурированного белков обозначить соответственно через [Н] и через [Д], то постоянная равновесия денатурации будет равна К = [Д]/[Н]. Если постоянную равновесия при температуре Т1 обозначить через К1, а при температуре Т2 — через К2, то ∆Н может быть вычислена из уравнения Ванг-Гоффа:
![]()
Такого рода вычисление возможно, конечно, только в том случае, когда денатурация обратима и между нативным и денатурированным белками устанавливается состояние обратимого равновесия. Кунитц применил указанный метод для вычисления АН обратимой денатурации ингибитора трипсина (белка соевых бобов) и нашел ее равной +57 000 кал на 1 моль белка [188]. Другой метод, использованный Кистяковским, основан на калориметрическом определении теплот следующих двух реакций:
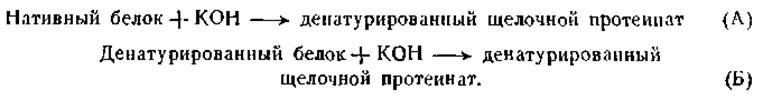
Если теплоту, выделившуюся при первой реакции, обозначить через ∆НА, а теплоту, выделившуюся при второй реакции — через ∆НБ, то разница ∆НБ — ∆НАбудет представлять теплоту денатурации. Эта величина для денатурации кристаллического пепсина равна +15 кал на 1 г азота, что соответствует +85 000 кал на 1 моль пепсина, если принять молекулярный вес пепсина равным 35 000. При определениях теплоты денатурации метгемоглобина были получены величины того же порядка [192].
Наиболее важный вывод из указанных исследований состоит в том, что денатурация белка представляет собой эндотермическую реакцию и что необходимо, следовательно, увеличить энергию нативного белка для того, чтобы денатурация могла произойти. Этот вывод оказался несколько неожиданным, так как можно было, наоборот, полагать, что ориентированное лабильное состояние пептидных цепей в нативном белке соответствует более высокому содержанию энергии, чем дезориентированное стабильное состояние тех же цепей в денатурированном белке. Для того чтобы понять причины этого расхождения, необходимо рассмотреть вопрос о значении двух других термодинамических постоянных ∆F и ∆S, приведенных в уравнении (1). Согласно этому уравнению, общее изменение энергии представляет собой арифметическую сумму ∆F и T∆S. Аналогично тому, как это было сделано в отношении ∆Н, мы можем написать: ∆F = FД — FН и ∆S = SД — SH, где F — свободная энергия, a S — энтропия реакции денатурации.
Хорошо известно, что молекула каждого вещества находится в постоянном движении и что интенсивность этого движения зависит от температуры. При данной температуре Т энергия этого движения равна TS. Если система содержит избыток энергии F, то этот избыток может быть использован для производства работы. F обозначает свободную энергию системы, которая может быть превращена в электрическую, механическую и другие формы энергии. Второй член в уравнении (1), TS, обозначает ту энергию, которая не может быть использована для производства работы. Он отражает то минимальное количество энергии, которое необходимо для теплового движения молекул. Если механизм протекающей реакции таков, что интенсивность этого движения ослабляется, то энергия TS уменьшается на величину Т∆S. Такое уменьшение энтропии происходит, например, в точке замерзания жидкости, когда жидкость переходит в твердое состояние. При обратном процессе, т. е. при переходе твердого кристаллического вещества в жидкое состояние при той же температуре, происходит потребление энергии. Так, например, требуется 79 кал для превращения льда в воду той же температуры. Поскольку величина свободной энергии F одинакова для льда и воды при температуре 0°, вся потребляемая при указанном процессе энергия уходит на увеличение энтропии системы.
На протяжении долгого времени господствовало мнение, что течение химической реакции зависит от знака ∆Н и что только экзотермические реакции могут протекать без доставки энергии извне. В настоящее время мы, однако, знаем, что эта точка зрения неправильна. Направление химической реакции зависит не от знака ∆Н, а от знака ∆F. Только при отрицательном знаке ∆F реакции могут протекать самопроизвольно. Такого рода реакции называются в настоящее время экзергоническими. Поскольку теплота денатурации ∆Н, согласно уравнению (1), равна сумме ∆F и Т∆S, мы можем написать:
∆F = ∆Н — Т∆S. (3)
Из этого уравнения видно, что ∆F может иметь отрицательный знак тогда, когда ∆Н также имеет отрицательный знак, a ∆S является положительной или небольшой отрицательной величиной. Такой же знак ∆F будет иметь, если ∆H положительна, a ∆S является большой положительной величиной. Последний случай имеет особое значение для понимания процессов денатурации белков. Выше уже было указано, что денатурация белков представляет собой эндотермическую реакцию, требующую приблизительно 105 кал на 1 моль белка. С другой стороны, мы знаем, что денатурация происходит очень легко даже при комнатной температуре и может быть вызвана множеством агентов (мочевиной и др.). Поскольку энтропия при денатурации возрастает и член Т∆S положителен (уравнение 3), необходимо принять, что ∆F имеет отрицательный знак. Процесс денатурации белков аналогичен, таким образом, процессу таяния льда и представляет собой эндотермическую реакцию, протекающую самопроизвольно в результате возрастания энтропии. Изменение в величине свободной энергии ∆F может быть вычислено из уравнения (4), если известна постоянная равновесия:
∆Е = -RTlnK = -2,3 RTlgК. (4)
Если ∆F и ∆Н известны, то ∆S может быть определена из уравнения (3). Полный термодинамический анализ обратимой денатурации кристаллического ингибитора трипсина показал, что ∆Н равна +57 300 кал на 1 моль белка и что К и ∆F имеют значения, показанные в табл. 11.
Таблица 11 Изменение в величине свободной энергии (∆F) и постоянная равновесия (К) для реакции обратимой денатурации ингибитора трипсина
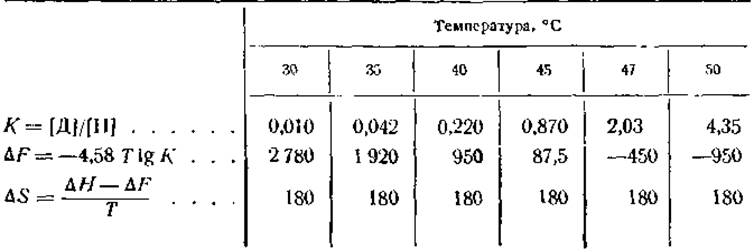
Приведенные выше данные свидетельствуют о том, что при температуре в пределах 45 и 47° между нативным и денатурированным белками должно существовать состояние полного равновесия (∆Е = 0). При более низких температурах равновесие сдвинуто в сторону нативного белка, а при более высоких — в сторону денатурированного белка. Цифры показывают также, что реакция «нативный белок → денатурированный белок» сопровождается возрастанием энтропии, доходящим до 180 кал/град ∙ моль. Это значительное возрастание энтропии и является, очевидно, движущей силой денатурации, так как в результате этого процесса ∆F при повышении температуры становится отрицательной величиной и денатурация начинает протекать с повышенной скоростью.
Если сделать попытку истолковать приведенные выше результаты термодинамических анализов, пользуясь терминами молекулярной кинетики, то опять-таки процесс денатурации можно сравнить с таянием льда. При возрастании температуры перекрестные водородные мостики между пептидными цепями «тают», вследствие чего ставшие свободными пептидные цепи становятся более подвижными.
Высокие значения ∆Н при денатурации белков (порядка 104—105) поразили первых исследователей вопроса. Найденные величины соответствовали тем, которые необходимы для разрыва сильных ковалентных связей, и значительно превышали соответствующие величины для многих химических реакций. Так, например, АН для образования пептидной или эфирной связи равна 2 000—5 000 кал/моль. Более высокие величины наблюдаются, когда стойкие соединения расщепляются на свои составные части. Так, например, для расщепления углекислоты на углерод и кислород требуется 94 380 кал/моль, а для расщепления воды на водород и кислород—115 660 кал/моль. Высокие величины АН при денатурации белков можно объяснить тем, что структура нативных белков определяется большим числом водородных связей между пептидными группами —СО ∙ NH— (см. стр. 136) и гораздо меньшим числом солевых мостиков между анионными и катионными группами [193].
Анализ аминокислотного состава пепсина показывает, что молекула этого белка содержит около 300 пептидных связей [194], а число щелочных аминокислот в его молекуле равно 6. Отсюда следует, что максимальное число водородных связей между прилегающими пептидными группировками равно приблизительно 150. Максимальное же число солевых мостиков в этом белке, равное 6, настолько невелико, что им практически можно пренебречь. Теплота денатурации пепсина равна +85 000 кал/моль, поэтому можно считать, что на одну водородную связь приходится 85 000:150 кал. Если все водородные связи разрываются при денатурации, то на разрыв одной такой связи расходуется около 570 кал. Эта величина значительно меньше, чем общая величина энергии водородной связи, равная приблизительно 5 000 кал. Нужно, однако, помнить, что разрыв одной водородной связи типа N—Н ... О=С сопровождается немедленно образованием новой водородной связи с другими частями пептидной цепи или с молекулами растворителя. В последнем случае одна или несколько молекул воды могут внедриться между имино- и кетогруппой, в результате чего образуется следующая группировка:
![]()
∆Н в этом случае представляет собой разность двух величин: ∆На и ∆Нб, из которых первая обозначает количество энергии, необходимой для разрыва водородных связей N—Н ∙∙∙ О =С и водородных связей между молекулами растворителя, а вторая выражает энергию, освобождающуюся при образовании водородных связей, представленных формулой (5). По всей вероятности, при денатурации белков не происходит разрыва всех водородных связей, имеющихся в нативных белках, в связи с чем теплота денатурации на каждую водородную связь должна быть выше 570 кал.
С кинетической точки зрения состояние равновесия между нативным и денатурированным белками можно рассматривать как конечный результат двух реакций: прямой «Н → Д» и обратной «Д → Н». Если постоянную скорости первой реакции обозначить через k1, а второй реакции — через k2, то состояние равновесия можно выразить следующим уравнением: k1[Н] = k2[Д], где [Н] и [Д] — концентрации нативного и денатурированного белков при состоянии равновесия. Постоянная равновесия равна К = k1/k2. Отношение [Д]/[Н] и величина К зависят от температуры белкового раствора. При повышении температуры k1 значительно увеличивается, повышение же k2 сравнительно невелико, в связи с чем отношение k1/k2 также увеличивается и происходит сдвиг равновесия реакции «Н → Д» в правую сторону.
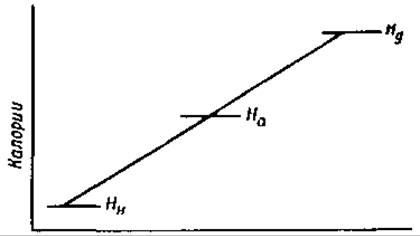
Значительное влияние, которое оказывает повышение температуры на скорость медленных реакций, приписывается тому, что только активированные молекулы способны реагировать. Энергию активации можно определить, исходя из уравнения Аррениуса или из теории абсолютных скоростей реакций. Согласно последней, химические реакции обычно протекают так, как это схематически изображено на фиг. 31. На этой схеме начальное количество энергии системы обозначено через Нн, конечное количество энергии через Hк, а энергия активированного состояния через Hа. Теплота активации для прямой реакции (H1*) будет тогда, очевидно, равна Нa — Hн, а для обратной реакции (Н2*) будет равна На — Нк. Поскольку На при всех условиях больше, чем Нн и Нк, теплота активации будет иметь положительный знак в обоих случаях. Другими словами, теплота должна поглощаться как в прямой, так и в обратной реакциях. Так, например, мы должны нагреть эфир, чтобы расщепить его на кислоту и спирт, и мы должны также нагревать смесь спирта и кислоты, чтобы получить эфир. Общая теплота реакции равна
∆Н = Нк — Нн.

Фиг. 31. Схема экзотермической реакции.
Величина теплоты активации находится в связи со скоростью реакции и может быть рассчитана из уравнения Аррениуса:
![]()
где k — постоянная скорости, А — постоянная, е — основание натуральных логарифмов, Е — энергия активации, R — газовая постоянная (1,98 кал) и Т — абсолютная температура. Определяя постоянные скорости km и kn при двух температурах Тm и Тn, можно исключить член А:
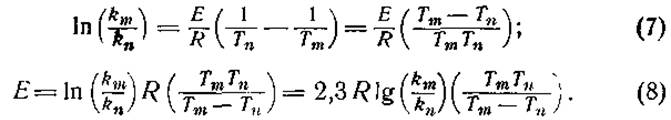
Теплота активации H* равна:
Н* = Е — RT. (9)
Уравнение (1), основное уравнение термодинамики, может быть применено как для процесса активации «Н → Б*», так и для процесса активации «Д → Б*» (Б* обозначает активированное состояние белка), в результате чего можно написать следующие уравнения:
![]()
где H*, F* и S* — соответственно теплота активации, свободная энергия активации и энтропия активации. Поскольку активация в реакции того типа, который показан на фиг. 31, не протекает самопроизвольно, H* и F* являются положительными величинами, а S* обычно имеет небольшое положительное или отрицательное значение.
Кунитц [188] определил величины H*, F* и S* для обратимой денатурации ингибитора трипсина. H* была определена из уравнений (8) и (9), a F* из уравнения (12):
![]()
где К — постоянная Больтцмана (1,38 ∙ 10-16 эрг/град), h — постоянная Планка (6,62 ∙ 10-27 эрг/сек) и k — постоянная скорости в 1 сек. Если F* известно, то S* можно определить из уравнения (13):
![]()
Для ингибитора трипсина были получены следующие величины: Н1* = +55 000 кал/моль, Н2* = —1 900 кал/моль, S1* = +95 кал/моль ∙ град, S2* = —84 кал/моль ∙ град. Из отрицательного значения Н2* ясно, что денатурация существенно отличается от реакции того типа, который изображен на фиг. 31, и соответствует типу реакции, схема которой приводится на фиг. 32 [196]. На этой схеме Hн, Hа и НД обозначают количества энергии в нативном, активированном и денатурированном белках. Отрицательное значение
теплоты активации (Н2* = На — НД) термодинамически соответствует тому факту, что превращение денатурированного белка в нативный происходит скорее при низких температурах. Положительная величина S1* является мерой увеличения дезориентации, сопровождающей денатурацию.
Фиг. 32. Термодинамические изменения в процессе денатурации белков.
Вопрос о денатурации ингибитора трипсина был рассмотрен столь детально потому, что эта денатурация представляет собой первый и до сих пор единственный пример почти полностью обратимой денатурации белка. Для большинства других белков мы пока еще не в состоянии определить ни скорости восстановления, ни постоянной равновесия (К). Мы должны довольствоваться поэтому определением k1 — постоянной скорости денатурации. При определении k1 для двух различных температур мы можем вычислить Е из уравнения (8), H1*—из уравнения (9), F1* — из уравнения (12) и S* — из уравнения (13). Величины для теплот активации реакции «нативный белок денатурированный белок», вычисленные этим путем, имеют тот же порядок, что и величины H1*, найденные Кунитцом [188]. Они колеблются для различных белков от 104 до 105 кал и кажутся, на первый взгляд, очень высокими. Если мы, однако, примем во внимание высокий молекулярный вес белков, то станет ясно, что величина в 100 000 кал/моль является очень небольшой. Для простоты допустим, что молекулярный вес белков равен 100 000 и что теплота денатурации составляет 100 000 кал/моль. В этом случае различие между содержанием энергии в 1 г нативного и в 1 г денатурированного белков будет равно 1 кал. Известно, что полное окисление глюкозы до углекислоты и воды дает 3 900 кал/г. Из этого примера видно, что теплота денатурации настолько мала, что она не может играть никакой роли в энергетическом балансе.
Поскольку пептидные цепи в нативном белке строго ориентированы, а в денатурированном белке дезориентированы, энтропия денатурированных белков выше, чем энтропия нативных. Разница между величинами энтропии нативного и денатурированного белков получила название энтропии конфигурации [197]. При допущении некоторых упрощений она может быть выражена как отрицательный логарифм вероятности. Этим путем были получены величины от —4,3 до —6,1 единицы энтропии для каждого аминокислотного остатка белка, содержащего от 300 до 30 000 аминокислот 10—20 различных типов. При этом расчете допускается, что число аминокислот каждого типа в белке одинаково. Если же принять, что число аминокислот различного типа в белке неодинаково, приведенные выше величины энтропии для каждой аминокислоты возрастут до —8 кал/град. Для пепсина, молекулярный вес которого сравнительно невысок (35 000), такого рода вычисление дает величину, равную —5 кал/град на каждый аминокислотный остаток, а при Т = 300° — величину, равную 300(—5) = —1 500 кал на аминокислотный остаток [197]. ∆Н для денатурации пепсина равна 85 000 кал/моль, или 300 кал для одного аминокислотного остатка. Из этого сопоставления очевидно, что Т∆S значительно больше, чем ∆Н, и это означает, что денатурация сопровождается значительным увеличением энтропии.
1 См. примечание к стр. 130- — Прим. ред.