БІОХІМІЯ - Лабораторний практикум - НАУ 2015
МОДУЛЬ IV
МЕТАБОЛІЗМ ОСНОВНИХ КЛАСІВ БІОМОЛЕКУЛ
Лабораторна робота 10
ЕКСПЕРИМЕНТАЛЬНЕ ПІДТВЕРДЖЕННЯ МЕТАБОЛІЧНИХ ПЕРЕТВОРЕНЬ АМІНОКИСЛОТ
Мета роботи: підтвердити в модельних дослідах ензиматичні перетворення амінокислот.
Основні теоретичні відомості
Метаболізм або обмін речовин — сукупність біохімічних реакцій, що забезпечують життєдіяльність організму. Метаболізм поділяється на анаболізм та катаболізм. У процесі анаболізму з амінокислот синтезуються пептиди та білки. Загальними для амінокислот катаболічними реакціями є декарбоксилування, дезамінування, трансамінування або переамінування. Унаслідок декарбоксилування в організмі амінокислота втрачає карбоксильну групу, виділяється СО2та утворюється біогенний амін.
Дезамінування поділяється на чотири види — внутрішньомолекулярне, відновне, гідролітичне та окисне, у результаті яких утворюються аміак та ненасичена карбонова кислота, насичена карбонова кислота, α-оксикислота або α-кетокислота відповідно. Найбільше притаманно живим організмам окисне дезамінування.
Трансамінування (непряме дезамінування або переамінування) — це реакція між α-амінокислотою та α-кетокислотою, унаслідок якої утворюються нові α-амінокислота та α-кетокислота без проміжного виділення аміаку.
Реакція каталізується ферменами амінотрансферазами (трансаміназами), коферментами яких є піридоксальфосфат (ПАЛФ) та піридоксамінфосфат (ПАМФ). Амінотрансферази виявлені у більшості тваринних та рослинних тканин, а також у мікроорганізмів.
Обладнання: штатив із пробірками, скляні палички, капіляри, піпетки, скляні лійки, колби, водяна баня, крапельниці, термостат, газовий пальник, хроматографічний папір, паперові фільтри, пластинки для хроматографії Silufol, чашка Петрі для радіальної або стакан для висхідної хроматографії, пульверизатор, годинник, центрифуга лабораторна, фотоелектроколориметр (ФЕК).
10.1. Трансамінування між аланіном та α-кетоглутаровою кислотою
Матеріали та реактиви: ферментний препарат (5 г пивних дріжджів розтирають у фарфоровій ступці з 2—3 мл дистильованої води та невеликою кількістю скляного піску, додають 8—10 мл води та фільтрують крізь вату), 1 %-й розчин аланіну, 1%-й розчин глутамінової кислоти, 1%-й розчин піровиноградної кислоти або пірувату натрію, 1%-й розчин α-кетоглутарової кислоти, 0,1 %-й розчин карбонату калію, 0,025 %-й розчин монобромоцтової кислоти, 10 %-й розчин трихлороцтової кислоти, свіжовиготовлений нінгідриновий реактив (9,5 мл 0,5 %-го розчину нінгідрину в 95 %-му ацетоні, 0,1 мл льодяної оцтової кислоти та 0,4 мл дистильованої води), суміш н-бутанолу, льодяної оцтової кислоти, води (4:1:5), концентрований розчин КОН (100 г КОН розчиняють у 60 мл дистильованої води), 2 %-й спиртовий розчин саліцилового альдегіду.
Порядок виконання роботи
Процес переамінування між аланіном та α-кетоглутаровою кислотою каталізується ферментом аланінамінотрансферазою (АлАТ), в результаті утворюються піровиноградна (ПВК) та глутамінова кислоти. Реакція перебігає за участю ПАЛФ та ПАМФ, виділення аміаку не відбувається, як проміжні сполуки утворюються заміщені іміни або основи Шиффа. У ході реакції зменшуються вміст аланіну та α-кетоглутарату, утворюються глютамінова кислота та піруват:
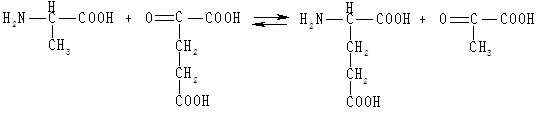
У дві пробірки наливають по 0,5 мл розчину аланіну, 0,5 мл розчину α-кетоглутарової кислоти, 1 мл розчину К2СО3 (для одержання оптимального рН), 0,25 мл розчину монобромоцтової кислоти, щоб запобігти перебігу реакцій гліколізу (для гальмування реакції відновлення пірувату в лактат). У дослідну пробірку вносять по 1 мл ферментного препарату, в контрольну — 1 мл ферментного препарату, прокип'яченого протягом 2—3 хв для інактивації ферментів, а далі охолодженого. Досліджувану та контрольну пробірки закривають пробками та інкубують у термостаті за температури 37 °С 1 год. Для осадження білків у кожну пробірку додають по 0,25 мл 10 %-го розчину трихлороцтової кислоти й відфільтровують суміш.
Появу пірувату доводять реакцією із саліциловим альдегідом. Уміст аланіну та глютамінової кислоти в фільтраті визначають хроматографічним методом.
Реакція на піровиноградну кислоту
До 2 мл фільтрату з кожної пробірки додають по 2 мл розчину КОН та по 1 мл розчину саліцилового альдегіду, пробірки струшують та інкубують 10—12 хв за температури 37 °С. У дослідній пробірці набуває інтенсивного жовтогарячого забарвлення, що свідчить про утворення ПВК. У контрольній пробірці забарвлення лишається світложовтим.
Для побудови калібрувальної кривої в 5 пробірок вносять 0,2, 0,4, 0,6, 0,8 та 1,0 мл розчину ПВК, об’єм доводять водою до 2 мл. У кожну пробірку додають 2 мл розчину КОН та 1 мл розчину саліцилового альдегіду, пробірки струшують та інкубують 10—12 хв за температури 37 °С.
Виміряють оптичну густину розчинів проти дистильованої води на ФЕК з використанням синього світлофільтра, довжина хвилі
450—480 нм.
Радіальна хроматографія на папері
Хроматографічний папір вирізають у вигляді кола, діаметр якого на 0,5 см більший від діаметра чашки Петрі. Вирізають смужку до центра кола і загинають її вниз. Олівцем ділять коло на 4 сегменти. На відстані 0,5 см від центра кола відмічають лінію старту, в сегментах на неї капіляром по краплинах наносять 2—3 рази один з розчинів: фільтрат дослідної проби, фільтрат контрольної проби, стандартний розчини аланіну або глютамінової кислоти, щоразу обережно підсушуючи папір над пальником. На дно чашки Петрі наливають суміш н-бутанолу, льодяної оцтової кислоти, води, папір занурюють відрізаною смужкою в рідину, закривають чашку. Хроматографію припиняють, коли фронт розчинника дійде майже до краю паперу (0,5 — 1 см від краю). Папір виймають і зразу ж олівцем відмічають фронт розчинника.
Хроматограму проявляють, а саме: обережно висушують над пальником, обробляють розчином нінгідрину, висушують в сушильній шафі за температури 70 °С протягом 10 — 15 хв. Відмічають олівцем забарвлені плями. Розраховують Rf для кожної плями як відношення відстані, що пройшла амінокислота, до відстані, що пройшов розчинник, порівнюють положення плям, одержаних з контрольного та дослідного фільтратів із плямами аланіну та глютамінової кислоти. Порівнюють розміри плям.
Тонкошарова хроматографія
Із пластинки Silufol вирізають прямокутник розміром 4×10 см. На відстані 0,5 см від нижнього краю пластини обережно олівцем проводять лінію старту, наносять на неї в окремих точках капіляром 2—3 рази, щоразу підсушуючи, стандартні розчини амінокислот та досліджувані розчини. Опускають пластину в стакан із сумішшю н-бутанолу, льодяної оцтової кислоти, води таким чином, щоб лінія старту не була занурена в рідину. Закривають стакан скляною кришкою й очікують, поки фронт розчинника підніметься вгору, не доходячи 0,5 см до верхнього краю пластини. Пластину виймають, олівцем відмічають лінію фронту розчинника.
Хроматограму проявляють та оцінюють так само, як у разі радіальної хроматографії на папері.
Для визначення абсолютного значення зменшення вмісту аланіну на пластинку або хроматографічний папір наносять відомі кількості аланіну та досліджуваних фільтратів. За допомогою одного із методів кількісного визначення амінокислот (візуальне порівняння, денситометрія чи елюція з хроматограм) визначають вміст аланіну в фільтраті проби та контролю. Аналізуючи одержані результати, установлюють зменшення вмісту аланіну в пробі порівняно з контролем.
10.2. Визначення активності аспартатамінотрансферази
та аланінамінотрансферази у сироватці крові за Райтманом
і Френкелем
Матеріали та реактиви: кров, 0,1 %-й розчин
2,4-динітрофенілгідразину (ДНФГ), 0,4 М розчин NaOH, 1 мкМ розчин пірувату, субстратно-буферні суміші. (Для визначення активності АсАТ 29,2 г α-кетоглутарової кислоти і 2,66 г D,L-аспарагінової кислоти (1,33 г L-аспарагінової кислоти) розчиняють у 1 М розчині натрію гідроксиду до повного розчинення осаду (рН 7,4), розчин переливають у мірну колбу на 100 мл і доводять об’єм до мітки 0,1 М фосфатним буфером (рН 7,4), додають 1 краплю хлороформу, зберігають у холодильнику в замороженому стані. Для визначення активності АлАТ субстратно-буферну суміш готують аналогічно, замість аспарагінової кислоти беруть 1,78 г D,L-аланіну (0,89 г L-аланіну)).
Порядок виконання роботи
Метод ґрунтується на визначенні піровиноградної кислоти (пірувату, ПВК), яка є одним із продуктів реакції, що каталізується АлАТ, або продуктом декарбоксилування оксалацетату (щавлевооцтової кислоти, ЩОК), що утворюється в реакції, яка каталізується АсАТ:
α-Кетоглутарат + Аланін ↔ Глутамат + Піруват
α-Кетоглутарат + Аспартат ↔ Глутамат + Оксалоацетат
Оксалоацетат → Піруват + СО2
Утворена піровиноградна кислота визначається кольоровою реакцією з 2,4-динітрофенілгідразином:
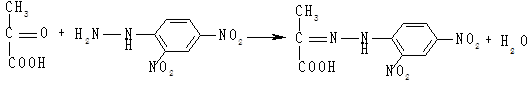
Кров витримують 30 хв за температури 30 °С у водяній бані, далі центрифугують 15 хв за швидкості обертання 3 000 об/хв. Надосадову рідину використовують для визначення активності ферментів.
Визначення активності АсАТ
У пробірку вносять 0,5 мл субстратно-буферної суміші, що містить аспартат, витримують у термостаті 5 хв за температури
37 °С, додають 0,1 мл сироватки крові, інкубують 60 хв за температури 37 °С. Далі додають 0,5 мл розчину ДНФГ і лишають на 20 хв за кімнатної температури (18—25 °С). Додають 5 мл розчину гідроксиду натрію, ретельно перемішують і витримують 10 хв за кімнатної температури. Виміряють оптичну густину на ФЕК, використовуючи зелений світлофільтр (довжина хвилі 500—560 нм), у кюветі завтовшки 1 см.
Контрольну пробу готують так само, як і дослідну, але сироватку крові додають після інкубації 60 хв за температури 37 °С та додавання ДНФГ.
Визначення активності АлАТ
У пробірку вносять 0,5 мл субстратно-буферної суміші, що містить аланін, витримують в термостаті 5 хв за температури 37 °С, додають 0,1 мл сироватки крові, інкубують 30 хв за температури
37 °С. Далі визначення проводиться так само, як і АсАТ.
Побудова калібрувальної кривої
Для побудови калібрувальної кривої беруть 0,1, 0,2, 0,3, 0,5 мл розчину пірувату, до 0,6 мл доливають водою, далі додають 0,5 мл розчину ДНФГ і досліджують так само, як контрольну і дослідну проби. Будують графік залежності оптичної густини від вмісту ПВК в пробі (кмоль).
Розрахунок активності ферментів
Активність АсАТ та АлАТ виражають у мікромолях ПВК, що утворюються унаслідок інкубації за температури 37 °С протягом
60 хв 1 мл сироватки крові. Кількість ПВК знаходять за калібрувальною кривою, множать на 10 для перерахунку на 1 мл сироватки, для АлАТ додатково множать на 2 для перерахунку на 60 хв інкубації.
Фізіологічні значення активності амінотрансфераз у розрахунку на 1 мл сироватки крові після інкубації за температури 37 °С протягом 1 год.: АсАТ — 0,1— 0,5 мкмоль/год·мл; АлАТ —
0,1 — 0,7 мкмоль/год·мл.
Оброблення експериментальних даних
Побудуйте калібрувальні графіки для визначення вмісту піровиноградної кислоти в розчині та для визначення активності амінотрансфераз у сироватці крові. Розрахуйте вміст ПВК та активність АсАТ і АлАТ. Порівняйте результати радіальної хроматографії на папері та тонкошарової хроматографії.
Контрольні запитання та завдання
1. Напишіть реакцію трансамінування між аспарагіновою кислотою та піруватом або α-кетоглутаратом. Назвіть фермент, коферменти, проміжні продукти реакції. Поясніть взаємозв’язок між трансамінуванням та дезамінуванням в організмі.
2. Напишіть реакції декарбоксилування гістидину, лізину, α- декарбоксилування глютамінової кислоти. Назвіть ферменти, коферменти, продукти реакції, поясніть їх біологічну роль.
3.Напишіть реакції дезамінування аланіну (4 види). Назвіть ферменти, коферменти, продукти реакцій.
4. Назвіть шляхи утворення та детоксикації аміаку в організмі. Які кінцеві продукти білкового обміну?
5. У яких анаболічних реакціях беруть участь амінокислоти?
6. Напишіть реакцію утворення глутатіону, поясніть його біологічне значення.
Література: [1; 3—7].