БІОХІМІЯ - Лабораторний практикум - НАУ 2015
МОДУЛЬ I
БІОХІМІЧНІ КОМПОНЕНТИ КЛІТИНИ
Лабораторна робота 1
ЯКІСНІ РЕАКЦІЇ НА АМІНОКИСЛОТИ
Мета роботи: опанувати методи виявлення окремих амінокислот у білках та білкових гідролізатах, дослідити амінокислотний склад запропонованих білкових розчинів.
Основні теоретичні відомості
Амінокислоти — це гетерофункціональні сполуки, що містять у своєму складі як аміно-, так і карбоксильну групи. Амінокислоти розрізняють за кількістю цих груп (моноаміномонокарбонові, моноамінодикарбонові, діаміномонокарбонові, діамінодикарбонові) та наявністю додаткових функціональних груп (наприклад, гідроксильної, сульфгідрильної) або гетероатомів (наприклад сірки), за взаємним розміщенням аміно- і карбоксильної групи (наприклад α-, β-, γ-амінокислоти). Амінокислоти різняться також характером радикалів (ациклічні та циклічні, ароматичні та циклічні неароматичні, карбоциклічні та гетероциклічні) та їх полярністю — полярні (гідрофільні) та неполярні (гідрофобні). Усі амінокислоти, за винятком гліцину, який не має радикала і хірального центру, є оптично активними сполуками, тобто обертають площину поляризованого світла. Вони поділяються на амінокислоти L- та D-стереохімічних рядів, які відрізняються просторовим розміщенням замісників, напрямленням обертання площини поляризованого світла і біологічною активністю. Особливо виділяють протеїногенні амінокислоти, тобто такі, з яких побудовані білки живих організмів. Протеїногенними є L-α-амінокислоти. Для організмів амінокислоти можуть бути замінними та незамінними, а також частково або умовно замінними. Для кожного виду живих організмів існує свій певний набір незамінних амінокислот. Наприклад, для людини незамінними є вісім амінокислот, дві амінокислоти умовно замінні — вони обов’язкові для дітей і необов’язкові для дорослих.
Амінокислотний склад — важлива характеристика білка. Від того, які саме амінокислоти та в якій послідовності входять до складу білкової молекули (від якісного і кількісного складу), залежить просторова структура білка та його функції.
Повноцінні харчові білки за амінокислотним складом відповідають амінокислотному складу білків організму.
Обладнання: штатив із пробірками, градуйовані пробірки, піпетки, крапельниці, скляні палички, ванночка з льодом, водяна баня, пальник, годинник.
1.1. Нінгідринова реакція на α-амінокислоти
Матеріали та реактиви: гідролізат білка або 1 %-й розчин
α-амінокислоти; 0,1 М розчин нінгідрину; розчини білків 1, 2, 3, запропоновані викладачем.
Порядок виконання роботи
Нінгідринова реакція характерна для аміногруп, які розміщені в α-положенні відносно карбоксильної групи. Під час нагрівання з нінгідрином α-амінокислоти окиснюються і розпадаються на альдегід, вуглекислий газ та аміак, нінгідрин відновлюється до дикетооксигідриндену:
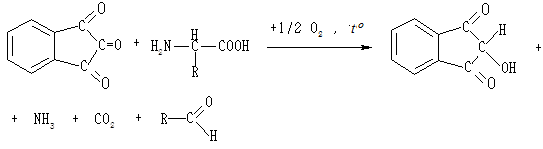
Виділений аміак реагує з іншою молекулою нінгідрину та з дикетооксигідринденом з утворенням сполуки, яка забарвлює розчин в інтенсивний фіолетово-синій колір.
У пробірку вносять 2—3 краплі розчину α-амінокислоти (або гідролізату білка), додають 1—2 краплі 0,1 М розчину нінгідрину, злегка підігрівають і спостерігають за зміною забарвлення розчину.
1.2. Ксантопротеїнова реакція
Матеріали та реактиви: розчин тирозину (1 %-й) або білка; концентрована азотна кислота; аміак; розчини білків 1, 2, 3, запропоновані викладачем.
Порядок виконання роботи
У пробірку вносять 1—2 краплі розчину тирозину (або білка), 2—3 краплі концентрованої азотної кислоти, нагрівають і спостерігають за зміною забарвлення розчину. Потім по одній краплі додають під час перемішування розчин аміаку до зміни забарвлення.
Ксантопротеїнова реакція є характерною для ароматичних амінокислот фенілаланіну, тирозину, триптофану, бензольне кільце яких нітрується за дії концентрованої азотної кислоти з утворенням нітросполук, що забарвлюють розчин у жовтий колір; забарвлення переходить у жовтогаряче при додаванні аміаку.
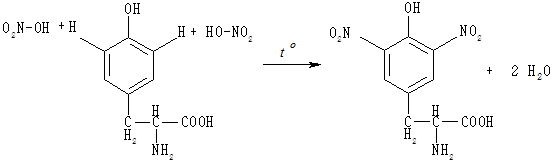
Ксантопротеїнова реакція дуже чутлива, тому за її допомогою легко виявляють не лише ароматичні амінокислоти, але й білки, до складу яких вони входять.
1.3. Реакція Фоля на сірковмісні амінокислоти (вільні
або у складі пептидів та білків)
Матеріали та реактиви: водний 0,01 %-й розчин цистеїну; реактив Фоля (до 10 %-го розчину ацетату свинцю додають 10 %-й розчин гідроксиду натрію до розчинення утвореного осаду); концентрований розчин гідроксиду натрію; розчини білків 1, 2, 3, запропоновані викладачем.
Порядок виконання роботи
У пробірку вносять 1 мл розчину цистеїну, 2 мл концентрованого розчину гідроксиду натрію та 1 мл реактиву Фоля. Суміш ретельно перемішують і кип’ятять на водяній бані 2 хв. Під час кип’ятіння в лужному середовищі пептидів або білків, що містять сірковмісні амінокислоти, від них легко відщеплюється сірка у вигляді сірководню, який у лужному середовищі утворює сульфід натрію. Рівняння реакції за участю цистеїну має такий вигляд:

Сульфід натрію можна виявити за допомогою іонів важких металів, наприклад свинцю, які утворюють з іонами сірки нерозчинний сульфід свинцю чорного кольору. Розчинний ацетат свинцю під час взаємодії з гідроксидом натрію утворює плюмбіт натрію, який у ході реакції із сульфідом натрію утворює чорний осад сульфіду свинцю:
Через 3—5 хв випадає чорний осад сульфіду свинцю.
1.4. Реакція Міллона на тирозин
Матеріали та реактиви: водний 0,01 %-й розчин тирозину; реактив Міллона (40 г ртуті розчиняють у 57 мл концентрованої азотної кислоти та розводять двома об’ємами води, дають відстоятися і використовують надосадову рідину); розчини білків
1, 2, 3, запропоновані викладачем.
Порядок виконання роботи
Фенольний гідроксил ароматичної амінокислоти тирозину бере участь у реакції з реактивом Міллона (суміш нітратів і нітритів ртуті (І) і (II), розчинених в концентрованій азотній кислоті). При цьому утворюється ртутна сіль тирозину, що має червоне забарвлення:
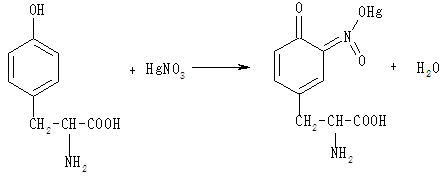
До 3 мл розчину тирозину додають 1 мл розчину Міллона, ретельно перемішують. Через 10 хв розчин забарвлюється в червоний колір. Для прискорення реакції розчин можна підігріти.
1.5. Реакція Адамкевича на триптофан
Матеріали та реактиви: водний 0,01 %-й розчин триптофану, льодяна оцтова кислота, яка завжди містить невелику кількість гліоксилової кислоти, концентрована сірчана кислота, розчини білків 1, 2, 3, запропоновані викладачем.
Порядок виконання роботи
До 0,5 мл розчину триптофану додають 0,5 мл льодяної оцтової кислоти, що містить гліоксилову кислоту. Одержану суміш спочатку нагрівають, потім охолоджують і по стінці пробірки обережно по краплинах додають 1 мл концентрованої сірчаної кислоти, слідкуючи, щоб рідини не змішувалися. Через 10 хв на межі поділу двох шарів утворюється червоно-фіолетове кільце.
Триптофан у кислому середовищі вступає в реакцію з гліоксиловою кислотою (альдегідами), утворюючи забарвлені в червоно-фіолетовий колір продукти конденсації:
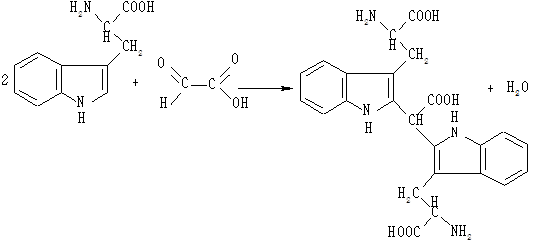
Реакцію можна прискорити нагріванням на водяній бані.
1.6. Реакція Вуазене на триптофан
Матеріали та реактиви: водний 0,01 %-й розчин триптофану, водний 2,5 %-й розчин формальдегіду, концентрована сірчана кислота, 0,5 %-й розчин нітрату натрію, розчини білків 1, 2, 3, запропоновані викладачем.
Порядок виконання роботи
До 2 мл розчину триптофану додають одну краплю розчину формальдегіду, суміш перемішують і вливають порціями по кілька крапель 6 мл концентрованої сірчаної кислоти, охолоджуючи пробірку у ванночці з льодом. Суміш знову перемішують і дають відстоятися 10 хв. Триптофан, конденсуючись із формальдегідом, утворює забарвлений продукт конденсації біс-2-триптофанілметан:
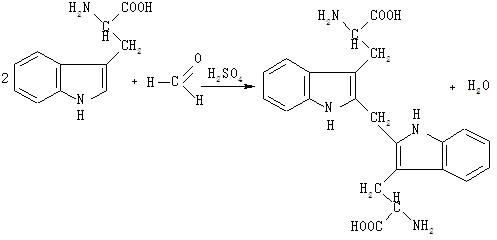
1.7. Реакція Паулі на гістидин і тирозин
Матеріали та реактиви: водний 0,01 %-й розчин гістидину,
1 %-й розчин сульфанілової кислоти в 5 %-у розчині соляної кислоти, 0,5 %-й розчин нітриту натрію, 10 %-й розчин карбонату натрію, розчини білків 1, 2, 3, запропоновані викладачем.
Порядок виконання роботи
До 1 мл розчину сульфанілової кислоти додають 2 мл розчину нітриту натрію, перемішують, негайно доливають 2 мл розчину гістидину, знову ретельно перемішують і додають 6 мл розчину карбонату натрію. Під час взаємодії сульфанілової кислоти з нітритом натрію (калію) в кислому середовищі відбувається реакція діазотування. Її продуктом є діазобензолсульфонова кислота, яка в реакції з гістидином (чи тирозином) утворює сполуку вишнево-червоного кольору:
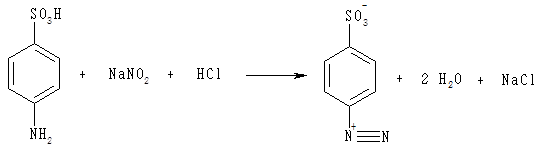
Після перемішування розчин забарвлюється в червоно-вишневий колір.
Оброблення експериментальних даних
Перевірте розчини білків 1, 2, 3 на наявність амінокислот (див. досліди 1.1 — 1.7). Побудуйте таблицю, в якій позначте, які амінокислоти містяться в кожному з досліджуваних розчинів білка.
Контрольні запитання та завдання
1. Наведіть протеїногенні амінокислоти, напишіть їх структурні формули, позначте радикали.
2. Позначте незамінні, умовно замінні, замінні для людини амінокислоти.
3. Класифікуйте амінокислоти всіма відомими вам способами.
4. Які амінокислоти дають позитивну нінгідринову реакцію? Напишіть загальну формулу таких амінокислот.
5. Ксантопротеїнова реакція — принцип методу. Які амінокислоти можна виявити цією реакцією? Напишіть формули цих амінокислот.
6. Які амінокислоти можна виявити реакцією Фоля? Поясніть принцип цієї реакції.
7. Наведіть визначення енольного та фенольного гідроксилів, а також приклади сполук, що містять їх. Якою реакцією виявляється фенольний гідроксил тирозину?
8. Поясніть принцип якісних реакцій на триптофан.
9. Напишіть реакцію Паулі для гістидину.
10.Чи є амінокислоти хіральними сполуками? Напишіть формули амінокислот проекційними формулами Фішера.
11.Яка протеїногенна амінокислота не має радикала, а яка — аміногрупи?