БІОХІМІЯ - Лабораторний практикум - НАУ 2015
МОДУЛЬ I
БІОХІМІЧНІ КОМПОНЕНТИ КЛІТИНИ
Лабораторна робота 2
ЯКІСНА РЕАКЦІЯ НА ПЕПТИДИ ТА БІЛКИ. РОЗДІЛЕННЯ БІЛКІВ МЕТОДОМ ВИСОЛЮВАННЯ. ВИЗНАЧЕННЯ ОСНОВНИХ СКЛАДОВИХ КОМПОНЕНТІВ НУКЛЕОПРОТЕЇНІВ
Мета роботи: опанувати методи виявлення білків та пептидів у розчинах, розділення білків різної молекулярної маси, виявлення компонентів складних білків у гідролізатах.
Основні теоретичні відомості
Білки — це біополімери, мономерами яких є амінокислоти. Білки утворюються з амінокислот в ході реакції поліконденсації, побічним продуктом є вода. Білок складається щонайменше з п’ятдесяти амінокислотних залишків, з’єднаних між собою пептидними зв’язками, що формуються за рахунок карбоксильної та аміногрупи. Пептидні зв’язки можуть бути в кето- або в енольній формах, між цими формами існує таутомерія (динамічна ізомерія).
Білки є поліпептидами. Поліпептид містить щонайменше десять амінокислотних залишків. Пептиди, які містять від двох до десяти амінокислотних залишків, називаються олігопептидами. Найменші олігопептиди — дипептиди, вони утворюються конденсацією двох амінокислот, містять один пептидний зв’язок.
Усі пептиди, крім дипептидів, у тому числі білки, дають позитивну біуретову реакцію, яка є якісною реакцією на пептидний зв’язок; у лужному середовищі за наявності сульфату міді(II) утворюють комплексні сполуки міді, забарвлені в синьо-фіолетовий колір, інтенсивність якого залежить від кількості пептидних зв’язків у молекулі білка. Уперше реакція утворення таких комплексних сполук міді була проведена з біуретом, тому її й називають біуретовою.
Білки розрізняються за молекулярною масою, яка залежить від кількості амінокислотних залишків у молекулі. Білки є гідрофільними сполуками, вони розчиняються у воді, утворюючи колоїдні розчини. Навколо білкової молекули за рахунок диполів води, певним чином орієнтованих біля полярних та заряджених груп, утворюється гідратна оболонка, що утримує макромолекулу білка в розчиненому стані. Заряд та гідратна оболонка — це фактори стабільності білкової молекули в розчині (рисунок):
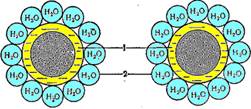
Білки в водному розчині. 1 — колоїдні частинки білка;
2 — гідратна оболонка
Висолювання — зворотне осадження білків під дією водовіднімних засобів, що позбавляють білок гідратної оболонки (солей лужних, лужноземельних металів, сульфату амонію, спирту, ацетону). Білки осаджуються розчинами солей різних концентрацій. Деякі з них уже випадають в осад за концентрації сульфату амонію близько 1/10 від концентрації насичення, глобуліни — за напівнасичення, альбуміни — за повного насичення.
Білки можуть складатися лише з поліпептидного ланцюга, такі білки називають простими. Якщо до складу білка входить небілкова частина — простетична група, такий білок називають складним. При повному гідролізі складного білка в розчині можна виявити амінокислоти і складові компоненти простетичної групи. Складні білки можна класифікувати за характером простетичної групи, наприклад: ліпопротеїни, глікопротеїни, нуклеопротеїни, хромопротеїни, металопротеїни. Більшість відомих білків — складні. Різноманітні їх функції та локалізація в клітині: нуклеопротеїни — складові апарату зберігання та реалізації генетичної інформації, глікопротеїни беруть участь у передачі сигналів між клітинами, хромопротеїни переносять кисень та оксид вуглецю між тканинами, зберігають кисень у тканинах і т. ін.
Нуклеопротеїни — складні білки, простетичною групою яких є нуклеїнові кислоти. Під час гідролізу нуклеопротеїни поступово розпадаються на складові компоненти, в гідролізаті після повного гідролізу містяться амінокислоти, азотисті основи пуринового і піримідинового ряду, пентози, фосфорна кислота.
Обладнання: штатив із пробірками, градуйовані піпетки, крапельниці, скляні палички, лійки, фільтрувальний папір, водяна баня.
2.1. Біуретова реакція для виявлення пептидних зв’язків у пептидах та білках
Матеріали та реактиви: 1 %-й розчин яєчного білка, 10 %-й розчин гідроксиду натрію (чи калію), 1 %-й розчин сульфату міді.
Порядок виконання роботи
До 3 мл яєчного білка додають 1 мл розчину гідроксиду натрію, одну-дві краплі розчину сульфату міді і перемішують.
Біурет можна одержати під час нагрівання сечовини до температури 180 °С, він не є пептидом, але має два пептидні зв’язки. У лужному середовищі біурет енолізується:
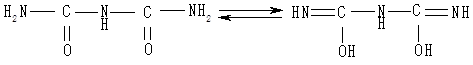
Гідроксид міді(II) для проведення біуретової реакції одержують реакцією взаємодії сульфату міді(II) із гідроксидом натрію (чи калію):
![]()
Дві молекули біурету в енольній формі взаємодіють із гідроксидом міді (II) й формують комплекс, у якому координаційні зв’язки утворені за рахунок електронних пар атомів азоту іміногруп. Комплекс біурету з міддю утворюється за такою схемою:
Подібний комплекс із міддю можуть утворювати пептиди та білки. Спочатку пептидні зв’язки в лужному середовищі енолізуються:
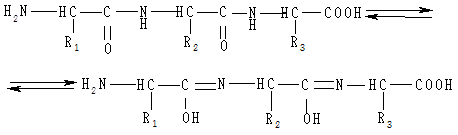
Найпростіший пептид, який дає позитивну біуретову реакцію, — трипептид:
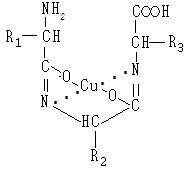
Білки, що мають пептидні зв’язки в енольній формі, взаємодіють із гідроксидом міді (II) і утворюють подібні комплекси.
Уміст пробірки забарвлюється в червоно-фіолетовий колір.
2.2. Фракційне осадження білків методом висолювання
Матеріали та реактиви: розчин сироватки крові, сульфат амонію (кристалічний та насичений розчин).
Порядок виконання роботи
У пробірку вливають 2—3 мл сироватки крові, додають такий самий об’єм насиченого розчину сульфату амонію, перемішують. В осад випадають глобуліни (50 % насичення розчину), які мають відносно велику молекулярну масу і невеликий заряд. Осад відфільтровують. До осаду на фільтрі додають невелику кількість води. В одержаному розчині містяться глобуліни, наявність яких виявляють шляхом кип’ятіння, спостерігаючи утворення осаду.
Фільтрат з розчином альбумінів розливають у дві пробірки. У першу пробірку додають кристалічний сульфат амонію до повного насичення (100 %-го насичення розчину). В осад випадають альбуміни. Уміст другої пробірки кип’ятять, спостерігають утворення осаду білків (альбумінів).
2.3. Виявлення основних компонентів у гідролізаті нуклеопротеїну
Матеріали та реактиви: гідролізат нуклеопротеїну, концентрований розчин аміаку, аміачний розчин нітрату срібла
(до 5 %-го АgNO3 додають по краплях розчин аміаку до розчинення сірого осаду); концентрована сульфатна кислота, 1 %-й спиртовий розчин α-нафтолу; реактив Фелінга (складається з двох розчинів: перший — 40 г сегнетової солі та 30 г гідроксиду натрію розчиняють, об'єм доводять до 200 мл; другий — 8 г перекристалізованого сульфіду міді (CuSO4∙5H2O) розчиняють у дистильованій воді, об'єм доводять до 200 мл; перед роботою змішують однакові об'єми першого та другого розчинів), 10 %-й NaOH, лакмус; молібденовий реактив (7,5 г молібдату амонію розчиняють у 100 мл води і додають 100 мл концентрованої нітратної кислоти).
Порядок виконання роботи
Виявлення пуринових основ
До 2 мл гідролізату нуклеопротеїну по краплях додають концентрований розчин аміаку (до лужної реакції на лакмус) та 0,5 мл аміачного розчину нітрату срібла. Пуринові основи унаслідок взаємодії з аміачним розчином нітрату срібла утворюють осад срібних солей пуринових основ, забарвлений у світло-бурий колір:
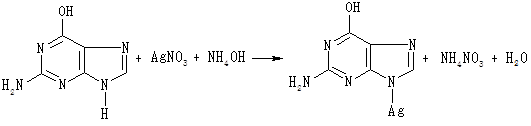
Гуанін
Спостерігають утворення осаду.
Виявлення пентоз за реакцією Подобєдова—Моліша
У пробірку вносять 1 мл гідролізату нуклеопротеїну, додають
1 мл 1 %-го спиртового розчину α-нафтолу і перемішують. Після цього обережно, не струшуючи, по стінці пробірки додають 1 мл концентрованої сульфатної кислоти. Під час взаємодії концентрованої сульфатної кислоти з пентозами вони дегідратуютья з утворенням фурфуролу, який з тимолом або α-нафтолом за наявності концентрованої сульфатної кислоти утворює продукти конденсації червоного або червоно-фіолетового кольору:
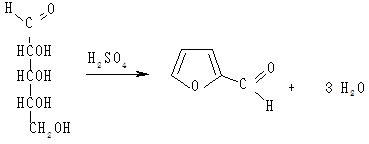
Пентоза (D-рибоза) Фурфурол
Спостерігають появу забарвлення.
Виявлення пентоз за реакцією Фелінга
У пробірку вносять 1 мл гідролізату нуклеопротеїну і нейтралізують 10 %-м розчином натрій гідроксиду (за наявності лакмусу) та додають такий самий об’єм реактиву Фелінга. Уміст пробірок перемішують і нагрівають. Реакція ґрунтується на здатності пентоз під час нагрівання в лужному середовищі окиснюватися, відновлюючи блакитний купрум(II) гідроксид до жовтого купрум(I) гідроксиду з наступним утворенням осаду купрум(І) оксиду цегляно-червоного кольору.
Спостерігають появу забарвлення.
Виявлення фосфатної кислоти
До 1 мл гідролізату нуклеопротеїну додають такий самий об’єм молібденового реактиву. Суміш нагрівають кілька хвилин на водяній бані. Фосфатна кислота під час нагрівання з молібденовим реактивом утворює триамонійфосфомолібдат, який в результаті охолодженні випадає у вигляді жовтого осаду:
12(NH4)2MoО4 + Н3РО4 + 21HNО3 →
→ 21NH4NО3 + (NH4)3PО4 · 12MoО3 · 6H2О + 6H2О
Спостерігають появу забарвлення.
Виявлення α-амінокислот нінгідриновою реакцією
(див. лабораторну роботу 1).
Оброблення експериментальних даних
Наведіть схему послідовних стадій гідролізу нуклеопротеїну, для кожної стадії вкажіть складові компоненти гідролізату та реакції, за допомогою яких вони виявляються. На яких стадіях можна осадити білок висолюванням? Запропонуйте метод експериментального підтвердження оборотності висолювання. На якій стадії біуретова реакція стає негативною?
Контрольні запитання та завдання
1. Які сполуки з пептидними зв’язками не дають позитивної біуретової реакції?
2. Напишіть таутомерні форми пептидного зв’язку.
3.Напишіть реакцію утворення трипептиду, наведіть його скорочену та повну назви.
4. Які речовини викликають оборотне осадження білків (висолювання)? Поясніть механізм висолювання. Назвіть фактори стабільності білкової молекули в розчині.
5. Які чинники викликають необоротне осадження білків?
6. Назвіть ознаки денатурації. Що називається ренатурацією?
7. Які рівні структурної організації має білкова молекула? Які зв’язки їх утворюють?
8. Що таке простетична група білка?
9. Як класифікуються складні білки? Назвіть основні класи складних білків, наведіть приклади.
10. Як можна розрізнити білки та пептиди в розчині?
11.Чи буде позитивною біуретова реакція в гідролізаті нуклеопротеїну після повного гідролізу; після неповного гідролізу? Напишіть біуретову реакцію з трипептидом.