ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
2. ВОДА
2.3. Роль буферных систем в поддержании pH в биологических системах
Почти каждый биологический процесс зависит от pH; даже незначительные изменения pH могут вызвать сильные изменения скоростей процессов. Это справедливо не только для тех реакций, в которых напрямую участвует ион Н-, но и для тех, в которых он, как может показаться, не принимает никакого участия. Ферменты, катализирующие многие реакции в клетке, и различные молекулы, на которые они так или иначе воздействуют, содержат ионизируемые группы и характеризуются определенным значением рKa. Например, протонированные аминогруппы и карбоксильные группы в аминокислотах, а также фосфатные группы в нуклеотидах выступают в качестве слабых кислот; их состояние ионизации зависит от pH среды. (Если ионизируемая группа спрятана вглубь белка, а не экспонирована на его поверхности, окруженной водным раствором, соответствующее значение рKа, т. е. кажущееся значение рKa, может сильно отличаться от рKa, в воде.) Ранее мы уже отмечали, что ионные взаимодействия важны для стабилизации белковых молекул и позволяют ферментам узнавать и связывать свои субстраты.
В клетках живых организмов поддерживается постоянное значение pH, соответствующее оптимальному состоянию ионизации биомолекул (обычно около 7). Значение pH во внеклеточной жидкости у многоклеточных организмов также строго регулируется. Постоянство pH достигается в первую очередь с помощью биологических буферов — смесей слабых кислот и сопряженных оснований.
Буферы — это смеси слабых кислот и сопряженных оснований
Буферы представляют собой водные системы, способные препятствовать изменению pH при добавлении небольших количеств кислоты (Н+) или основания (ОН-). Буферная система состоит из слабой кислоты (донора протона) и сопряженного с ней основания (акцептора протона). Примером буферной системы может служить смесь равных концентраций уксусной кислоты и ацетата, которая образуется в средней точке кривой титрования, показанной на рис. 2-16. Обратите внимание, что кривая титрования уксусной кислоты имеет относительно прямой участок, распространяющийся приблизительно на одну единицу pH в каждую сторону от средней точки, соответствующей pH 4,76. При увеличении концентрации ионов Н+ или ОН- в этой области происходит лишь слабое изменение pH, которое намного меньше, чем изменения, возникающие при добавлении такого же количества этих ионов за пределами данного участка. Этот относительно плоский участок кривой соответствует буферной зоне сопряженной кислотно-основной пары уксусная кислота/ацетат. В средней точке буферной зоны, где концентрация донора протона (уксусной кислоты) точно равна концентрации сопряженного основания (ацетата), буферная емкость системы максимальна. Это означает, что увеличение концентрации ионов 1Г или ОН- в этой области вызывает минимальные изменения pH. Значение pH в средней точке кривой титрования точно равно значению рKa, титруемой кислоты. При добавлении небольших количеств ионов Н+ или ОН- в ацетатный буфер его pH несколько изменяется, но эти изменения несоизмеримо слабее тех, которые наблюдаются при добавлении тех же количеств ионов в чистую воду или в раствор соли сильного основания и сильной кислоты (например, NaСl), не обладающей буферной емкостью.
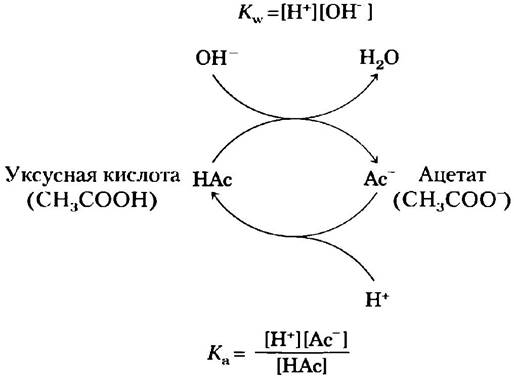
Буферная емкость является результатом равновесия двух обратимых реакций, протекающих в растворе, содержащем приблизительно равные концентрации донора протонов и сопряженного с ним акцептора. На рис. 2-18 продемонстрирован механизм действия буферной системы. Если мы добавляем к буферному раствору ионы H+ или ОН-, возникает небольшое изменение в соотношении относительных концентраций слабой кислоты и ее аниона и, следовательно, небольшое изменение pH. Уменьшение концентрации одного из компонентов буферной системы точно уравновешивается повышением концентрации другого компонента. Сумма компонентов при этом не меняется, меняется лишь их соотношение.
Рис. 2-18. Буферная система уксусная кислота/ацетат. Благодаря обратимости реакции диссоциации уксусной кислоты система может принимать как ионы Н+, так и ОН-. Донор протонов (уксусная кислота, НАс) имеет резерв связанных протонов, которые при необходимости могут выделяться и нейтрализовывать добавляемые в систему ионы ОН- с образованием Н2O. Это происходит, как только равновесие в системе нарушается и значение [Н+] [ОН-] превышает 10-14 М2 (при 25 °С). Равновесие быстро восстанавливается, так что ионное произведение воды вновь становится равным 10-14 М2, однако теперь временно концентрация Н+ оказывается снижена. В результате выражение [Н+] [Ас-]/[НАс] ниже значения Кa, так что НАс вновь диссоциирует, пока система не достигнет равновесия. Аналогичным образом, сопряженное основание (Ас-) может реагировать с добавляемыми в систему ионами Н+. И вновь две реакции диссоциации стремятся к равновесию. В соответствии с данным механизмом сопряженная кислотно-основная пара, такая как уксусная кислота/ацетат, препятствует изменениям pH, вызванным добавлением небольших количеств кислоты или основания. Буферное действие — это всего лишь следствие взаимосвязи двух обратимых реакций, стремящихся к состоянию равновесия в соответствии с константами равновесия Кw и Кa.
Для каждой сопряженной кислотноосновной пары характерна своя область pH, где она является эффективным буфером (рис. 2-17). Пара Н2РO4-/НРO42- имеет рКa = 6,86 и поэтому проявляет свойства буфера в диапазоне pH от 5,9 до 7,9; пара NН4+/NН3 с рКa = 9,25 может служить буфером в области pH от 8,3 до 10,3.
Уравнение Хендерсона-Хассельбаха, значения pH, рКа и концентрации компонентов в буферной системе связаны простым соотношением
Кривые титрования уксусной кислоты, Н2РO4- и NН4+ (рис. 2-17) мало различаются по форме. Это позволяет предположить, что все они отражают некую общую закономерность. И действительно так: форма кривой титрования любой кислоты описывается уравнением Хендерсона- Хассельбаха, анализ которого помогает понять буферные свойства и кислотно-основной баланс в крови и тканях позвоночных животных. Данное уравнение — по существу еще одна форма выражения константы ионизации кислоты. Уравнение Хендерсона-Хассельбаха для диссоциации слабой кислоты НА с образованием ионов Н+ и ОН- выглядит следующим образом:
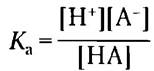
Сначала решим это уравнение относительно [Н+]:
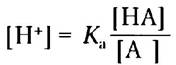
Возьмем отрицательный логарифм обеих частей уравнения:
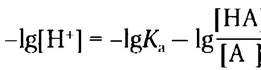
Заменяя -lg[H+] на pH и -lg/Ka на рKа, получаем:
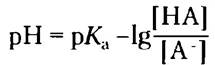
Теперь поменяем числитель и знаменатель в выражении -lg[НА][А-], для чего потребуется изменить знак, и получим уравнение Хендерсона- Хассельбаха:
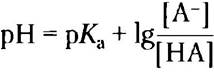 (2-9)
(2-9)
Данное уравнение описывает кривые титрования всех слабых кислот и позволяет вывести ряд важных количественных соотношений. Например, из него следует, почему рКaслабой кислоты численно равно значению pH в средней точке на кривой титрования. В данной точке [НА] = [А-], следовательно,
pH = рКа + lg1 = рKa + 0 = рKa
Уравнение Хендерсона Хассельбаха позволяет нам также: 1) рассчитать рKa при заданном значении pH и молярном соотношении донора и акцептора протонов; 2) рассчитать pH, зная рKa и молярное соотношение донора и акцептора протонов; 3) рассчитать молярное соотношение донора и акцептора протонов, если известны pH и рKa.
Слабые кислоты и основания служат буферами в клетках и тканях
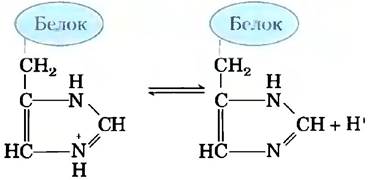
Внеклеточные и внутриклеточные жидкости многоклеточных организмов имеют характерные и практически постоянные значения pH. Первая линия защиты организма от изменений pH обеспечивается буферными системами. Цитоплазма большинства клеток содержит высокую концентрацию белков, состоящих из аминокислот, чьи функциональные группы действуют как слабые кислоты или основания. Например, рKa имидазольного кольца в боковой цепи гистидина (рис. 2-19) составляет 6,0; таким образом, белки, содержащие остатки гистидина, являются эффективными буферами в области нейтральных значений pH, а боковая цепь гистидина в этой области значений pH может существовать как в протонированной, так и в непротонированной форме.
Рис. 2-19. Ионизация гистидина. Аминокислота гистидин, входящая в состав белков, представляет собой слабую кислоту. Значение рKа протонированного азота в боковой цепи равно 6,0.
Пример 2-5. Ионизация гистидина
Рассчитайте, какова доля молекул гистидина, имеющих протонированное имидазольное кольцо при pH 7,3. Значения рKa для гистидина: рKa = 1,82, рK2 (имидазол) = 6,00 и рK3 = 9,17 (см. рис. 3-12, б).
Решение. Три ионизируемые группы гистидина имеют достаточно сильно различающиеся значения рКa, так что первая кислота (группа -СООН) полностью ионизуется до того, как вторая группа (протонированный имидазол) начинает отдавать свой препон, а вторая группа в свою очередь полностью ионизируется до того, как начинает диссоциировать третья группа (-NH3+). (С помощью уравнения Хендерсона-Хассельбаха можно показать, что слабая кислота, ионизованная лишь на 1% при pH на две единицы ниже своего значения рKа, ионизована на 99% при pH на две единицы выше значения рКa; см. также рис. 3-12, б.) При pH 7,3 карбоксильная группа гистидина полностью депротонирована (-СОО-), а α-аминогруппа полностью протонирована (-NH3+). Следовательно, можно утверждать, что при pH 7,3 частично диссоциирована лишь имидазольная группа, которая может находиться как в протонированной (обозначим ее через HisH+), так и в депротонированной форме (His).
Используем уравнение Хендерсона- Хассельбаха:
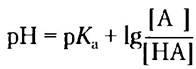
Подставляем значения рК2 = 6,0 и pH = 7,3 и получаем:

Таким образом, доля молекул гистидина, находящихся при pH 7,3 в протонированной форме HisH, составляет 1/21 (1 часть HisH+ и 21 часть молекул гистидина, находящихся в любой форме), или около 4,8%.
Нуклеотиды, такие как АТР, как и многие другие низкомолекулярные метаболиты, содержат функциональные группы, способные к ионизации. Именно они обеспечивают буферные свойства цитоплазмы. Некоторые высокоспециализированные органеллы и внеклеточные компартменты содержат в больших концентрациях соединения, которые обеспечивают их буферную емкость: органические кислоты в вакуолях растений, аммонийный буфер в моче.
Фосфатная и бикарбонатная буферные системы играют наиболее важную роль с биологической точки зрения. В фосфатной буферной системе, действующей в цитоплазме любой клетки, в качестве донора протонов выступает Н2РO4-, а в качестве акцептора протонов — НРO42-:
H2PO4- ⇄ Н+ + НРO42
Фосфатный буфер наиболее эффективно действует в области pH, близкой к значению рKa = 6,86 (рис. 2-15,2-17), т. е. в диапазоне pH от 5,9 до 7,9. Таким образом, он эффективен как раз в биологических жидкостях. Например, в большинстве цитоплазматических компартментов клеток млекопитающих pH находится в интервале от 6,9 до 7,4 (см. пример 2-6).
Функции буфера в плазме крови частично выполняет бикарбонатная система, состоящая из угольной кислоты Н2СO3 в качестве донора протона и бикарбоната НСO3- в качестве акцептора протона (K1 — это первая из нескольких констант равновесия, описывающих бикарбонатную буферную систему):
Н2СО3 ⇄ Н+ + HCO3-
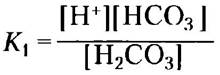
Данная буферная система сложнее других кислотно-основных пар, поскольку один из ее компонентов — угольная кислота — образуется при растворении (р) в воде диоксида углерода в соответствии с обратимой реакцией:
СO2(р) + Н2O ⇄ Н2СO3
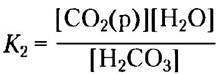
В нормальных условиях диоксид углерода — газообразное вещество, и концентрация растворенного СO2 определяется равновесием с газообразным СO2 (г):
СO2(г) ⇄ СO2(р)
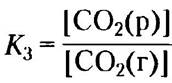
Итак, pH бикарбонатного буфера определяется концентрацией Н2СO3 и НСO3-, а концентрация Н2СO3, в свою очередь, определяется концентрацией растворенного СO2, которая зависит от концентрации СO2 в газовой фазе или парциального давления СO2 (обозначается рСO2). В итоге pH бикарбонатного буфера, находящегося в контакте с газовой фазой, определяется концентрацией НСO3 в водной фазе и рСO2 в газовой фазе.
Пример 2-6. Фосфатные буферы
а) Рассчитайте pH смеси растворов 0,042 М NaH2PО4 и 0,058 М Na2HPО4.
Решение. Применим уравнение Хендерсона-Хассельбаха, которое мы здесь выразим как
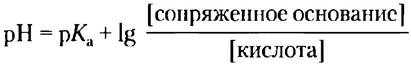
В нашем случае кислота (вещество, которое отдает протон) — Н2РO4, а сопряженное основание (вещество, которое присоединяет протон) — НРО2-4. Подставив данные нам значения концентрации кислоты и сопряженного основания и рКа (6,86), получим:
![]()
Для грубой оценки правильности решения можно применить следующий принцип: если в растворе больше сопряженного основания, чем кислоты, то оттитровано более 50% кислоты, и, таким образом, pH больше рКa (6,86; значение, при котором оттитровано точно 50% кислоты).
б) Насколько изменится pH 1 л буфера, приготовленного в примере (а), если к нему добавить 1,0 мл 10,0 н. NаОН?
Решение. 1 л буфера содержит 0,042 моль NаН2РO4. При добавлении 1,0 мл 10,0 н. NаОH (0,010 моль) эквивалентное количество (0,010 моль) NаН2РO4 переходит в Nа2НРO4, и получается 0,032 мольNаН2РО4 и 0,068 моль Nа2НРO4. pH такого раствора равен:
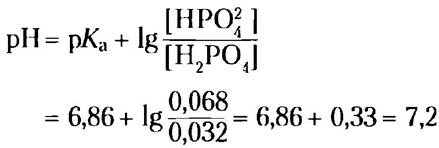
в) Насколько изменится pH 1 л чистой воды (pH = 7), если к нему добавить 1,0 мл 10,0 н. NаОН? Сравните результат с полученным в предыдущем примере.
Решение. NаОН полностью диссоциирует на ионы Na+ и ОН-, давая [ОН-] = 0,010 моль/л, или 1,0 • 10-2 М. рОН — отрицательный логарифм [ОН-], и, таким образом, рОН = 2,0. Зная, что рОН + pH = 14 для всех растворов, получаем, что pH нашего раствора равен 12.
Как видим, одно и то же количество NaOH меняет pH 1 л воды с 7 до 12, а буфера из примера (б) всего лишь с 7 до 7,2, что показывает всю силу буферных растворов!
Бикарбонатный буфер играет важную физиологическую роль, поскольку поддерживает pH плазмы крови около значения 7,4. В такой буферной системе, как было сказано выше, действуют три взаимосвязанных обратимых равновесия, в данном случае между газообразным СO2 в воздушном пространстве легких и бикарбонатом (НСО3-) в плазме крови (рис. 2-20).
Рис. 2-20. Бикарбонатная буферная система. Между СO2, находящимся в воздушном пространстве легких, и бикарбонатным буфером в плазме крови, протекающей через капилляры легких, существует равновесие. Поскольку концентрация растворенного СO2 быстро регулируется интенсивностью дыхания, бикарбонатная буферная система крови находится практически в равновесии с обширным потенциальным резервуаром СO2.
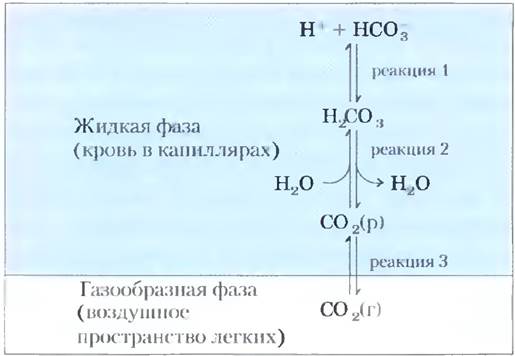
Когда ионы Н+ (например, из молочной кислоты, образующейся в мышечной ткани при большой физической нагрузке) попадают в кровь при ее прохождении через ткани, в реакции 1 на рис. 2-20 наступает новое равновесие, соответствующее более высокой концентрации Н2СO3. При этом в соответствии с реакцией 2 возрастает концентрация СO2(р) в крови, что по реакции 3 приводит к росту парциального давления СO2(г) в воздушном пространстве легких, а лишний СO2 выдыхается. Увеличение pH плазмы крови (например, в результате образования МН3 при катаболизме белков) вызывает противоположный ход событий: снижение концентрации Н+ в крови способствует усилению диссоциации Н2СО3 на Н+ и НСO3-, что заставляет дополнительное количество газообразного СО2 из легких растворяться в крови. Таким образом, интенсивность дыхания, т. е. скорость вдыхания воздуха и выдыхания СO2, может обеспечить быстрые сдвиги равновесия, что способствует поддержанию в крови постоянного значения pH. Частота дыхания контролируется стволовой частью мозга: при повышении содержания СO2 в крови или снижении pH крови дыхание учащается и становится более глубоким.
При pH 7,4, соответствующем pH плазмы крови, в растворе присутствует в основном НСO3 и совсем мало Н2СO3, а при добавлении небольшого количества основания (NН3 или ОH-) происходит титрование H2СO3, приводящее к снижению буферной емкости. Кажется, что важная роль угольной кислоты (рКа = 3,57 при 37°С) в создании буферной системы плазмы крови (pH 7,4) противоречит выдвинутому нами ранее утверждению, что наиболее эффективный буфер создается в диапазоне рКa ± 1 единица pH. Данный парадокс объясняется тем, что в крови содержится мною растворенного углекислого газа СO2(р), а его равновесие с Н2СО3 устанавливается достаточно быстро:
СO2(р) + Н2O ⇄ Н2СO3
Мы можем теперь определить константу — константу равновесия в реакции гидратации углекислого газа.
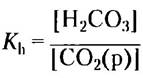
Теперь, учитывая источник СO2(р), можно записать [Н2СO3] как [СO2(р)] и подставить это выражение в уравнение кислотной диссоциации Н2СO3:
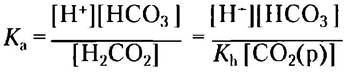
Теперь можно иначе записать равновесие в реакции диссоциации Н2СO3:
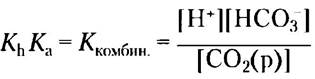
Можно рассчитать значение новой константы, Ккомбин., и соответствующее кажущееся значение рК, рКкомбин., зная экспериментально определенные значения Кh (3,0 • 103М) и Кa (2,7 • 10-4 М) при 37 °С:
Ккомбин. - (3.0 • 10-3 М) (2,7 • 10-4 М) = 8,1 • 10-7 М2
РКкомбин. = 6,1
В клинической практике часто значение кажущейся, или комбинированной, константы рКа принимают равным 6,1, что упрощает расчеты. В этом случае получаем:
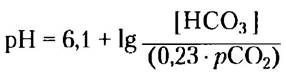
где парциальное давление углекислого газа, рСО2, выражено в килопаскалях (кПа; обычно рСО2 находится в диапазоне от 4,6 до 6,7 кПа), а 0,23 — это соответствующий коэффициент растворимости СО2 в воде; в результате 0,23 • рСО2 «1,2 кПа. Концентрация НСОэ3 в плазме обычно составляет около 24 мМ. ■
При отсутствии лечения диабет приводит к угрожающему состоянию — ацидозу
Значение pH плазмы крови человека в норме колеблется от 7,35 до 7,45, так что многие ферменты плазмы крови проявляют максимальную активность именно в этом диапазоне pH. Нарушение механизма регуляции pH, например, при тяжелых формах диабета обусловлено «перепроизводством» метаболических кислот, что вызывает падение pH крови до 6,8 и ниже (ацидоз) и может приводить к необратимым повреждениям клеток и к смерти. При некоторых других заболеваниях значение pH возрастает настолько, что тоже может стать причиной смерти.
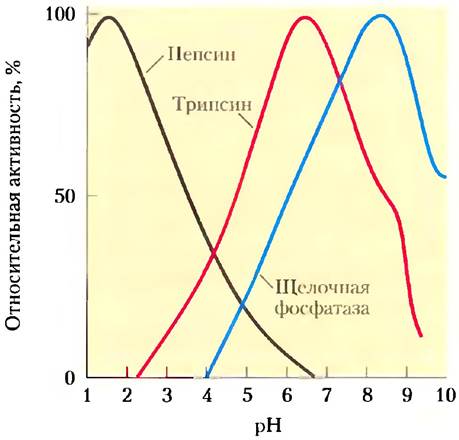
Многие особенности структуры и функционирования клеток связаны со значением pH, а каталитическая активность ферментов особенно чувствительна к этому параметру. Обычно ферменты проявляют максимальную каталитическую активность при определенном значении pH — оптимуме pH (рис. 2-21). Отклонение величины pH в любую сторону от оптимального значения часто сопровождается резким падением ферментативной активности. Таким образом, незначительные изменения pH могут приводить к большим изменениям скоростей некоторых важнейших ферментативных реакций. В связи с этим биологический контроль pH в клетке и в жидкостях организма играет необычайно важную роль во всех процессах метаболизма и клеточной активности, а изменение pH крови вызывает серьезные физиологические последствия (см. доп. 2-1).
Рис. 2-21. Оптимальный уровень pH для некоторых ферментов. Пепсин — пищеварительный фермент, находящийся в желудочном соке, pH которого составляет около 1,5. Именно такие условия оптимальны для действия пепсина. Пищеварительный фермент трипсин действует в тонком кишечнике, поэтому его оптимум pH совпадает с нейтральным значением pH в просвете тонкой кишки. Щелочная фосфатаза костной ткани — гидролитический фермент, участвующий в минерализации костного вещества.
Если больного диабетом не лечить, то недостаток инсулина или нечувствительность к инсулину (в зависимости от типа заболевания) приводит к нарушению процесса поступления глюкозы из крови в ткани и заставляет ткани использовать в качестве источника энергии, запасенные в них жирные кислоты. По причинам, которые мы рассмотрим позднее (см. разд. 23.2), эта зависимость от жирных кислот вызывает накопление в высокой концентрации двух карбоновых кислот — β-гидроксимасляной и ацетоуксусной кислоты (концентрация в плазме 90 мг в 100 мл по сравнению с <3мг в 100 мл у здорового человека; с мочой выводится около 5 г за 24 ч по сравнению с <125 мг за 24 ч в норме). Диссоциация этих кислот снижает pH крови до значения ниже 7,35, что приводит к ацидозу. Тяжелый ацидоз сопровождается головными болями, сонливостью, тошнотой, рвотой и диареей, далее могут возникнуть ступор, кома и конвульсии; по-видимому, основной причиной таких последствий является неоптимальная работа некоторых ферментов. Если у пациента обнаружена высокая концентрация глюкозы в крови, низкое значение pH плазмы и высокий уровень содержания β-гидроксимасляной и ацетоуксусной кислот в крови и моче, наиболее вероятный диагноз в таком случае — сахарный диабет.
К ацидозу могут также приводить и другие состояния. Употребление постной пищи и голодание приводят к использованию в качестве источника энергии запасных жирных кислот и в результате — к тем же последствиям, что и диабет. Очень высокая физическая нагрузка, какую испытывают, например, спринтеры или велосипедисты, приводит к временному накоплению в крови молочной кислоты. При почечной недостаточности нарушается способность организма регулировать уровень бикарбоната в крови. При заболеваниях легких (таких как эмфизема, пневмония и астма) снижается способность распределять СО2, образующийся при окислении энергетических веществ в тканях, что приводит к накоплению Н2СО3. При ацидозе следует идентифицировать и лечить вызвавшее его заболевание: диабетикам назначают инсулин, пациентам с больными легкими — стероиды или антибиотики. В особо тяжелых случаях пациентам внутривенно вводят раствор бикарбоната. ■
МЕДИЦИНА. Побыть немного кроликом (Не пытайтесь повторить этот опыт!)
Ниже представлен фрагмент записей Дж. Б. С. Холдейна, относящихся к эксперименту по контролированию уровня pH крови и опубликованных им в книге «Возможные миры» (Possible Worlds, Harper and Brothers, 1928).
«Я хотел понять, что произойдет с человеком, если его сделать более кислым или более щелочным... Кто-то скажет, что сначала следовало бы поставить эксперимент на кролике, и некоторые исследователи как раз и действуют в этом направлении, однако трудно понять, что на самом деле чувствует кролик в определенной ситуации. И действительно, некоторые кролики совершенно не готовы к сотрудничеству.
...Поэтому я и мой коллега начали ставить эксперименты друг на друге. Мой коллега доктор X. В. Дэвис и я принялись подщелачивать свой организм, усиленно дыша и употребляя в пищу около трех унций бикарбоната натрия. Подкисляли мы себя путем сидения в душной комнате с содержанием углекислого газа от шести до семи процентов. В результате мы дышали так, как будто только что закончили состязание по гребле, к тому же у нас была довольно сильная головная боль. Каждый из нас провел в комнате не более двух часов, хотя в нашей газовой камере не оставалось неискоренимого запаха горчичного газа от экспериментов военного времени, который заставлял всхлипывать каждого, кто входил в комнату. Наиболее очевидная пещь, которую следовало проделать, — выпить соляную кислоту. Если ее пить неразбавленной, она растворяет зубы и сжигает гортань, но я хотел позволить ей продиффундировать во все отделы организма. Самый крепкий раствор, который я пил, состоял из одной части концентрированной кислоты и ста частей воды. Но уже пинты для меня было достаточно, так как я получил раздражение пищевода и желудка, хотя расчеты показывали, что для достижения нужного мне эффекта мне следовало выпить полтора галлона... Я утверждал, что если глотать хлорид аммония, то в организме он частично разлагается, высвобождая соляную кислоту. Теперь это доказано... Печень превращает аммоний в безопасное вещество мочевину, и лишь затем оно попадет в сердце и головной мозг. Соляная кислота соединяется с бикарбонатом натрия, который присутствует во всех тканях, в результате чего образуется хлорид натрия и углекислый газ. Таким образом, этот газ образовывался во мне со скоростью шесть кварт в час (хотя все же менее часа).
Я был удовлетворен тем, что мне удалось воспроизвести в себе тот тин учащенного дыхания, который наблюдается на терминальной стадии болезней почек и диабета. Было давно известно, что это симптомы отравления кислотой, однако каждый случай отравления кислотой усложняется дополнительными химическими аномалиями, так что было непонятно, какие же симптомы вызваны действием кислоты как таковой».
«Теперь перенесемся в Гейдельберг, где Фройденберг и Гиорги изучали тетанию у детей... Им пришло в голову, что было бы неплохо проверить, что будет, если организм больного станет более кислым. Тетания была случайно обнаружена у нескольких пациентов, которых лечили от других недугов большими дозами бикарбоната натрия или которые потеряли большое количество соляной кислоты в результате частой рвоты. Если щелочность тканей приводит к тетании, то, возможно, кислота могла бы излечить от нее. К сожалению, мало кто возьмется лечить умирающего ребенка, помещая его в комнату, наполненную углекислым газом, или давая ему выпить соляной кислоты. Так что из этой идеи ничего не вышло; врачи давали больным известь, которую трудно проглотить, и которая нарушает пищеварение, но которая, безусловно, помогла во многих случаях заболевания тетанией.
Но когда они прочли мою статью о воздействии хлорида аммония, они стали давать его детям и были обрадованы тем, что тетания отступала уже через несколько часов. Потом этот способ использовался еще и в Англии, и в Америке, как для детей, так и для взрослых. Это лечение не устраняет причину заболевания, но приводит больного в такое состояние, в котором он имеет большой шанс выздороветь».
Пример 2-7. Лечение ацидоза бикарбонатом
Почему внутривенное введение раствора бикарбоната повышает pH плазмы крови?
Решение. Отношение [НСО3-] к [СО2(р)] определяет pH бикарбонатного буфера в соответствии с уравнением:
![]()
Если [НСО3-] возрастает, а рСО2 не меняется, то pH увеличивается.
Краткое содержание раздела 2.3. Роль буферных систем в поддержании рН в биологических системах
■ Смесь слабой кислоты (или основания) и ее соли препятствует изменениям pH, вызванным добавлением ионов Н+ или ОН-, т. е. действует в качестве буфера.
■ Значение pH раствора слабой кислоты (или основания) и ее соли можно вычислить по уравнению Хендсрсона-Хассельбаха:
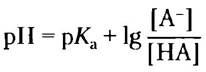
■ Значение pH внутриклеточных и внеклеточных жидкостей организма поддерживается на оптимальном (физиологическом) уровне (обычно около pH 7,0) с помощью фосфатного и бикарбонатного буферов. Для большинства ферментов такие значения pH являются оптимальными.
■ Состояния, при которых pH увеличивается, приводя к ацидозу, или снижается, приводя к алкалозу, могут угрожать жизни человека.