ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
Слово белок (протеин), которое я вам предлагаю... это производное от proteios, поскольку, по всей видимости, речь идет о первичном или исходном элементе в питании животных, которое создается растениями для травоядных, а затем становится пищей плотоядных.
Й. Я. Берцелиус. Из письма Ш. Мулдеру, 1838
3. АМИНОКИСЛОТЫ, ПЕПТИДЫ И БЕЛКИ
Белки участвуют практически в любом процессе, происходящем в клетке, демонстрируя неисчерпаемое разнообразие функций. При исследовании молекулярных механизмов биологических процессов биохимику неизбежно приходится изучать один или несколько белков. В количественном отношении белки занимают первое место среди биологических молекул. Они содержатся во всех клетках и в любой части клетки. Велико также разнообразие белков; в одной клетке можно обнаружить тысячи видов этих молекул. Кроме того, белки сильно различаются по биологическим функциям и представляют собой наиболее важные конечные продукты информационных метаболических путей, обсуждаемых в третьей части данной книги. Белки служат молекулярными инструментами, с помощью которых генетическая информация находит свое реальное воплощение.
Ключ к пониманию структуры тысяч различных белков кроется в строении относительно простых мономерных звеньев. Для построения всех белков, будь то белки самых древних линий бактерий или наиболее сложных биологических видов, используется один и тот же набор из 20 аминокислот, ковалентно связанных друг с другом в определенной линейной последовательности. Каждая аминокислота благодаря специфическим особенностям своей боковой цепи наделена химической индивидуальностью, поэтому эти 20 аминокислот можно рассматривать как алфавит «языка» белковой структуры. Белки бывают самого разного размера — от сравнительно небольших пептидов, построенных всего из нескольких аминокислотных остатков, до гигантских полимеров с молекулярной массой несколько миллионов.
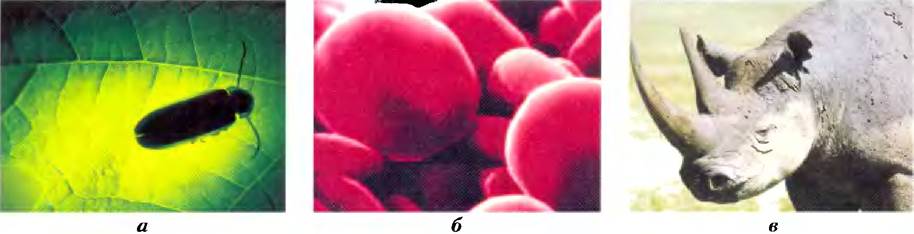
Поистине, замечательное свойство клеток — их способность соединять 20 аминокислот в различных комбинациях и последовательностях, в результате чего образуются белки с совершенно разными свойствами и биологической активностью. Из одних и тех же строительных блоков разные организмы способны создавать такие разнообразные продукты, как ферменты, гормоны, антитела, транспортные белки, мышечные волокна, белок хрусталика глаза, перья, паутина, рог носорога, белки молока, антибиотики, ядовитые вещества грибов и многие другие соединения, наделенные специфической биологической активностью (рис. 3-1). Среди этих белковых продуктов наиболее разнообразными и специализированными являются ферменты, которые катализируют практически все реакции в клетке.
Рис. 3-1. Некоторые функции белков, а) Свет, излучаемый светляком, возникает в результате реакции между белком люциферином и АТР, катализируемой ферментом люциферазой (доп. 13-1). б) Эритроциты содержат большое количество белка гемоглобина, переносящего кислород, в) Белок кератин, синтезируемый всеми позвоночными, является основным структурным компонентом волос, чешуи, рогов, шерсти, ногтей и перьев. Черные носороги — исчезающий вид, поскольку среди населения некоторых частей света бытовало мнение, что его рог может оказывать возбуждающее действие. На самом деле химические свойства измельченного рога носорога ничем не отличаются от свойств измельченных бычьих копыт или человеческих ногтей.
Структура и функции белков обсуждаются в данной и последующих трех главах книги. Мы начнем с изучения основополагающих химических свойств аминокислот, пептидов и белков. Кроме того, мы рассмотрим принципы работы с белками.
3.1. Аминокислоты
Архитектура белка — аминокислоты. Белки представляют собой полимерные молекулы, состоящие из аминокислот. Каждый аминокислотный остаток соединен с соседним остатком специфической ковалентной связью. Термин «остаток» подразумевает, что при соединении аминокислот друг с другом они теряют элементы, которые вместе составляют молекулу воды. Белки могут быть гидролизованы па составляющие их аминокислоты с помощью нескольких методов. Ранние исследования белков как раз были сфокусированы на определении аминокислот, образующихся при разложении белков. Обычно в белках находят 20 различных аминокислот. Первая аминокислота аспарагин была открыта в 1806 г., последней в 1938 г. была идентифицирована аминокислота треонин. Каждая аминокислота имеет тривиальное (традиционное) название, которое иногда происходит от источника, из которого она была впервые выделена. Аспарагин впервые обнаружили в аспарагусе, а глутаминовую кислоту — в глютене (запасном белке) пшеницы. Тирозин впервые выделили из сыра (название происходит от греч. tyros — сыр), а глицин был назван так за его сладкий вкус (от греч. glycos сладкий).
Общие закономерности структуры аминокислот
Все 20 основных аминокислот являются «-аминокислотами. Они имеют карбоксильную группу и аминогруппу, связанные с одним и гем же атомом углерода (a-атомом углерода) (рис. 3-2). Различаются аминокислоты боковыми цепями (R-группами), которые у каждой аминокислоты имеют особое строение, электрический заряд и растворимость в воде. Кроме 20 основных аминокислот существуют еще гораздо менее распространенные аминокислоты, некоторые из них образуются в процессе модификации остатков, происходящей уже после синтеза белка. Другие присутствуют в живых организмах, но не в составе белков. Основные аминокислоты имеют трехбуквенные и однобуквенные условные обозначения (табл. 3-1), которыми пользуются для сокращенной записи состава и последовательностей аминокислот в белках.
Рис. 3-2. Общая структура аминокислот. Данная структура является общей для всех аминокислот, кроме пролина — одной-единственной циклической аминокислоты. Каждая аминокислота имеет характерную R-группу (показана красным цветом), соединенную с α-атомом углерода (показан синим цветом).
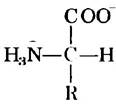
Таблица 3-1. Свойства аминокислот, входящих в состав белков
Аминокислота |
Сокращение/ символ |
Значения pKa |
|||||||||||||||
M*r |
pKa, (- COOH) |
pK2 (- NH3+) |
pKR (R-группы) |
pl |
ГИ** |
Встречаемость в белках (%)*** |
|||||||||||
Неполярные |
алифатические R- |
группы |
|||||||||||||||
Глицин |
Gly |
G |
75 |
2.34 |
9.60 |
5.97 |
20,4 |
7.2 |
|||||||||
Аланин |
Ala |
A |
89 |
2.34 |
9,69 |
6.01 |
1.8 |
7.8 |
|||||||||
Пролин |
Pro |
P |
115 |
1,99 |
10.96 |
6.48 |
1.6 |
5.2 |
|||||||||
Валин |
Val |
V |
117 |
2.32 |
9,62 |
5,97 |
4.2 |
6.6 |
|||||||||
Лейцин |
Leu |
L |
131 |
2.36 |
9.60 |
5,98 |
3,8 |
9.1 |
|||||||||
Изолейцпи |
lie |
I |
131 |
2,36 |
9,68 |
6.02 |
4.5 |
15.3 |
|||||||||
Метионин |
Met |
M |
149 |
2,28 |
9,21 |
5,74 |
1.9 |
2.3 |
|||||||||
Ароматические Фенилаланин |
R-группы Phe |
F |
165 |
1,83 |
9,13 |
5,48 |
2,8 |
3,9 |
|||||||||
Тирозин |
Туг |
Y |
181 |
2,20 |
9,11 |
10,07 |
5.66 |
21,3 |
3,2 |
||||||||
Триптофан |
Trp |
W |
204 |
2,38 |
9,39 |
5.89 |
20.9 |
1,4 |
|||||||||
Полярные R- |
незаряженные |
группы |
|||||||||||||||
Серин |
Ser |
S |
105 |
2,21 |
9,15 |
5,68 |
20,8 |
6,8 |
|||||||||
Треонин |
Thr |
T |
119 |
2.11 |
9,62 |
5,87 |
20.7 |
5,9 |
|||||||||
Цистеин**** |
Cvs |
C |
121 |
1.96 |
10,28 |
8,18 |
5,07 |
2,5 |
1,9 |
||||||||
Аспарагин |
Asn |
N |
132 |
2,02 |
8.80 |
5,41 |
23,5 |
1.3 |
|||||||||
Глутамин |
Clin |
Q |
146 |
2,17 |
9,13 |
5.65 |
23,5 |
1.2 |
|||||||||
Положительно |
заряженные R- |
группы |
|||||||||||||||
Лизин |
Lys |
K |
146 |
2,18 |
8,95 |
10,53 |
9,74 |
23,9 |
5,9 |
||||||||
Гистидин |
His |
H |
155 |
1 82 |
9.17 |
6.00 |
7,59 |
23.2 |
2.3 |
||||||||
Аргинин |
Arg |
R |
174 |
2,17 |
9.01 |
12,48 |
10,76 |
21,5 |
5,1 |
||||||||
Отрицательно |
заряженные R- |
группы |
|||||||||||||||
Аспарагиновая кислота |
Asp |
D |
133 |
1,88 |
9,60 |
3,65 |
2,77 |
23,5 |
5,3 |
||||||||
Глутаминовая кислота |
Glu |
E |
147 |
2.19 |
9,67 |
4,25 |
3,22 |
23.5 |
6.3 |
||||||||
* Значения Мr отражают структуру соединения, как это показано на рис. 3-5. При соединении аминокислот в полипептидную цепь отщепляются составляющие молекулы воды Мr=18).
** Гидропатический индекс, отражающий одновременно гидрофобность и гидрофильность R-группы. Эти значения отражают ∆G, соответствующее переносу боковой цепи аминокислоты из гидрофобного растворителя в воду. Перенос благоприятен (∆G <0; отрицательное значение индекса) для заряженных или полярных цепей и неблагоприятен (∆G >0; положительное значение индекса) для аминокислот с неполярной или более гидрофобной боковой цепью; см. гл. 11. Цит. по Kyte, J. & Doolittle, R.F. (1982) A sample method for displaying the hydrophobic character of a protein.J. Mol. Biol. 157,105-132.
*** Результаты исследования 1150 белков. Цит. по Doolittle, R.F. (1989) Redundancies in protein sequences. In Prediction of Protein Structure and the Principles of Protein Conformation (Fasman, G.D., ed.), pp. 599-623, Plenum Press, New York.
**** Цистеин обычно рассматривают как полярную молекулу, несмотря па то что он имеет положительное значение индекса гидрофобности. Это отражает способность сульфгидрильной группы выступать в роли слабой кислоты и образовывать слабую водородную связь с кислородом или азотом.
Ключевые договоренности.
Трехбуквенный код попять легко — сокращение обычно представляет собой первые три буквы названия аминокислоты. Однобуквепный код был разработан Маргарет Дейхофф (1925-1983), которую многие считают основоположницей современной биоинформатики. Однобуквенный код возник в результате попытки сократить размеры баз данных (в эру перфокарт), содержащих аминокислотные последовательности. Его легко запомнить, если попять происхождение символов. В случае шести аминокислот (CHIMSV) первая буква названия однозначно определяет только эти аминокислоты, поэтому именно она и используется в качестве символа для их обозначения. В случае пяти других аминокислот (AGLPT) первая буква не является однозначно определяющей, так что ее используют для обозначения той аминокислоты, которая чаще встречается в белках (например, лейцин встречается гораздо чаще, чем лизин). Коды для следующих четырех аминокислот выбраны по некоему фонетическому созвучию (RFYW: aRginine, Fenylalanine, tYrosine, tWîptophan). Подобрать однобуквенный код для оставшихся аминокислот было сложнее. Четыре аминокислоты (DNEQ) получили свою букву по той причине, что она имеется в их названии или созвучна их названию (asparDic, asparagiNe, glutamEke, Q-tamine). Остался лизин, но и в алфавите осталось всего несколько незанятых букв. Для обозначения лизина была выбрана буква К, поскольку она расположена к L ближе остальных. ■
Маргарет Оукли Дейхофф, 1925-1983

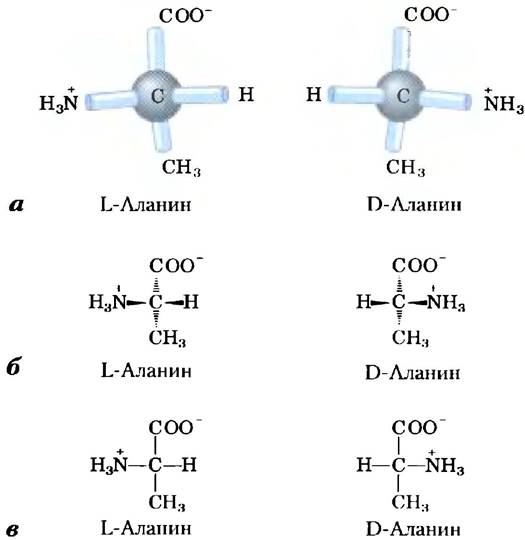
Во всех основных аминокислотах, за исключением глицина, α-атом углерода связан с четырьмя различными группами: карбоксильной группой, аминогруппой и R-группой, а также с атомом водорода (рис. 3-2; в глицине R-группа представляет собой еще один атом водорода). Таким образом, α-атом представляет собой хиральный центр (с. 36). Поскольку связывающие орбитали располагаются вокруг α-атома углерода в форме тетраэдра, четыре группы могут образовывать две различные пространственные конфигурации, т. е. аминокислоты могут существовать в виде двух стереоизомеров. Эти структуры являются зеркальными отражениями друг друга и не совпадают при наложении (рис. 3-3); они называются энантиомерами (рис. 1-19). Кроме того, все молекулы, имеющие хиральный центр, обладают оптической активностью, т. е. вращают плоскополяризованный свет (доп. 1-2).
Рис. 3-3. Стереоизомерия α-аминокислот. а) Два стереоизомера аланина L- и D-аланин являются зеркальными отражениями друг друга, не совпадающими при наложении, т. е. представляют собой энантиомеры. Существуют два варианта изображения пространственной конфигурации стереоизомеров. В перспективных изображениях формул (б) полностью закрашенные клиновидные линии обозначают связи, находящиеся над поверхностью рисунка а штриховкой показаны связи, лежащие под ней. В проекционных формулах (в) горизонтальными линиями изображают связи, находящиеся над поверхностью рисунка а вертикальными линиями — лежащие под ней. Однако очень часто при написании проекционных формул группы располагают случайным образом, не задумываясь о специфической стереохимической конфигурации молекул.
Ключевые договоренности.
Существуют две системы нумерации атомов углерода в молекулах аминокислот, что может поначалу сбить с толку. Следующие за α-атомом атомы углерода в R-цепи обычно обозначают с помощью греческих букв β, y, δ, ε и т. д. В случае большинства других органических молекул атомы углерода просто нумеруют по порядку, начиная с атома углерода (С-1), имеющего в качестве заместителя самую старшую функциональную группу. В соответствии с такой системой нумерации карбоксильный углерод в аминокислоте имеет номер С-1, а α-атом — номер С-2.
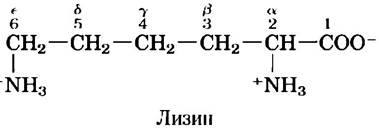
Иногда, например, в случае аминокислот с гетероциклическими R-группами, греческая система обозначений может допускать двоякое толкование, и тогда лучше пользоваться численной нумерацией. В случае аминокислот с разветвленной боковой цепью эквивалентные атомы углерода обозначают цифрами после греческих букв. Так, лейцин имеет атомы углерода 61 и 62 (см. рис. 3-5). ■
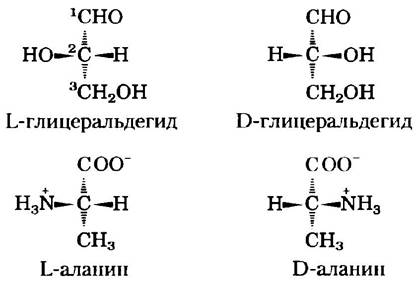
Для обозначения абсолютной конфигурации четырех заместителей у хирального (асимметрического) атома углерода применяется специальная номенклатура. Абсолютная конфигурация простых сахаров и аминокислот обозначается с помощью символов D и L (рис. 3-4), но аналогии с абсолютной конфигурацией трехуглеродного сахара глицеральдегида. Идея подобной классификации была предложена Эмилем Фишером в 1891 г. Фишер знал, какие группы окружают асимметрический атом углерода в молекуле глицеральдегида, но лишь догадывался относительно их абсолютной конфигурации; его догадка была позднее подтверждена методом рентгеновской дифракции. Во всех хиральных молекулах стереоизомеры с конфигурацией, соответствующей конфигурации L-глицеральдегида, обозначают буквой L, а стереоизомеры с конфигурацией, соответствующей конфигурации D-глицеральдегида, обозначают буквой D. Например, чтобы привести в соответствие расположение функциональных групп в молекулах L-аланина и L-глицеральдегида, нужно одинаковым образом расположить те из них, которые можно превратить друг в друга путем простой одностадийной химической реакции. В таком случае карбоксильная группа L-аланина займет ту же позицию относительно хирального центра, что и альдегидная группа L-глицеральдегида, поскольку альдегид легко превращается в карбоксильную группу в результате одностадийной реакции окисления. Исторически сложилось так, что буквы l u d использовались также и для обозначения левовращающих и правовращающих соединений (вращающих свет соответственно влево и вправо). Однако не все L-аминокислоты являются левовращающими, поэтому во избежание возможных ошибок, связанных с абсолютной конфигурацией, следует пользоваться номенклатурой Фишера (рис. 3-4). В соответствии с этой номенклатурой буквы L и D относятся только к абсолютной конфигурации четырех замещающих групп у хирального атома углерода и не имеют отношения к направлению вращения плоскости поляризации.
Рис. 3-4. Стереоиэомеры аланина и абсолютная конфигурация L- и D-глицеральдегида. В данных перспективных формулах атомы углерода расположены по вертикали, хиральный атом находится в центре. Атомы углерода пронумерованы, начиная с концевого атома в альдегидной или карбоксильной группе (выделены красным цветом), т. е. от 1 до 3 сверху вниз. При подобном расположении R-группа аминокислоты (в данном случае метильная группа аланина) всегда находится под α-атомом углерода. У L-аминокислот α-аминогруп- па расположена слева, а у D-аминокислот — справа.
Еще одной системой обозначения конфигурации вокруг хирального центра является R/S-система. Она используется в систематической номенклатуре органических соединений, в частности наиболее удобна и точна для описания конфигурации молекул с несколькими хиральными центрами (см. с. 37).
Аминокислотные остатки в белках являются L-тереоизомерами
Почти все биологические молекулы с асимметрическим атомом углерода существуют в природе в форме только одного стереоизомера — либо D, либо L. Аминокислотные остатки в белках являются исключительно L-стереоизомерами. D-Аминокислотные остатки были обнаружены лишь в нескольких небольших пептидах, в частности в составе клеточной стенки бактерий и в некоторых пептидных антибиотиках.
Присутствие в белках только L-стереоизомеров аминокислот весьма примечательно, поскольку при лабораторном синтезе молекул с хиральным центром всегда получаются рацемические смеси L- и D-изомеров, которые трудно различить и разделить. Однако для живого организма L- и D-изомеры различаются, как правая и левая руки. Для образования устойчивых повторяющихся надмолекулярных белковых структур (гл. 4) обычно важно, чтобы составляющие их аминокислоты относились к одному стереохимическому ряду. Клетки умеют специфическим образом синтезировать исключительно L-изомеры аминокислот, поскольку активные центры соответствующих ферментов являются асимметрическими, а катализируемые ими реакции стереоспецифичны.
Классификация аминокислот на основании их R-групп
Знание химических свойств аминокислот лежит в основе биохимии. Изучение аминокислот облегчается благодаря тому, что все аминокислоты можно разделить на пять основных классов в зависимости от свойств R-групп (табл. 3-1), в частности полярности или способности взаимодействовать с водой при физиологических значениях pH (около 7,0). Полярность R-групп варьирует в широких пределах — от неполярных и гидрофобных (нерастворимых в воде) до сильнополярных и гидрофильных (хорошо растворимых в воде).
Строение 20 основных аминокислот показано на рис. 3-5, а некоторые свойства перечислены в табл. 3-1. Внутри каждого класса аминокислот существует определенная градация по полярности, размерам и форме R-групп.
Рис. 3-5. Двадцать основных аминокислот, входящих в состав белков. Данные структурные формулы отражают состояние ионизации, в котором находится преобладающая часть молекул при pH 7,0. Не выделенная цветом область одинакова у всех аминокислот; розовым цветом выделены различающиеся области - боковые R-группы. Хотя R-группа гистидина изображена незаряженной, значение рКа этой группы таково, что небольшая, но все же значительная часть молекул гистидина при pH 7,0 заряжена положительно (см. табл. 3-1). Протонированная форма гистидина показана над графиком на рис. 3-12, б.
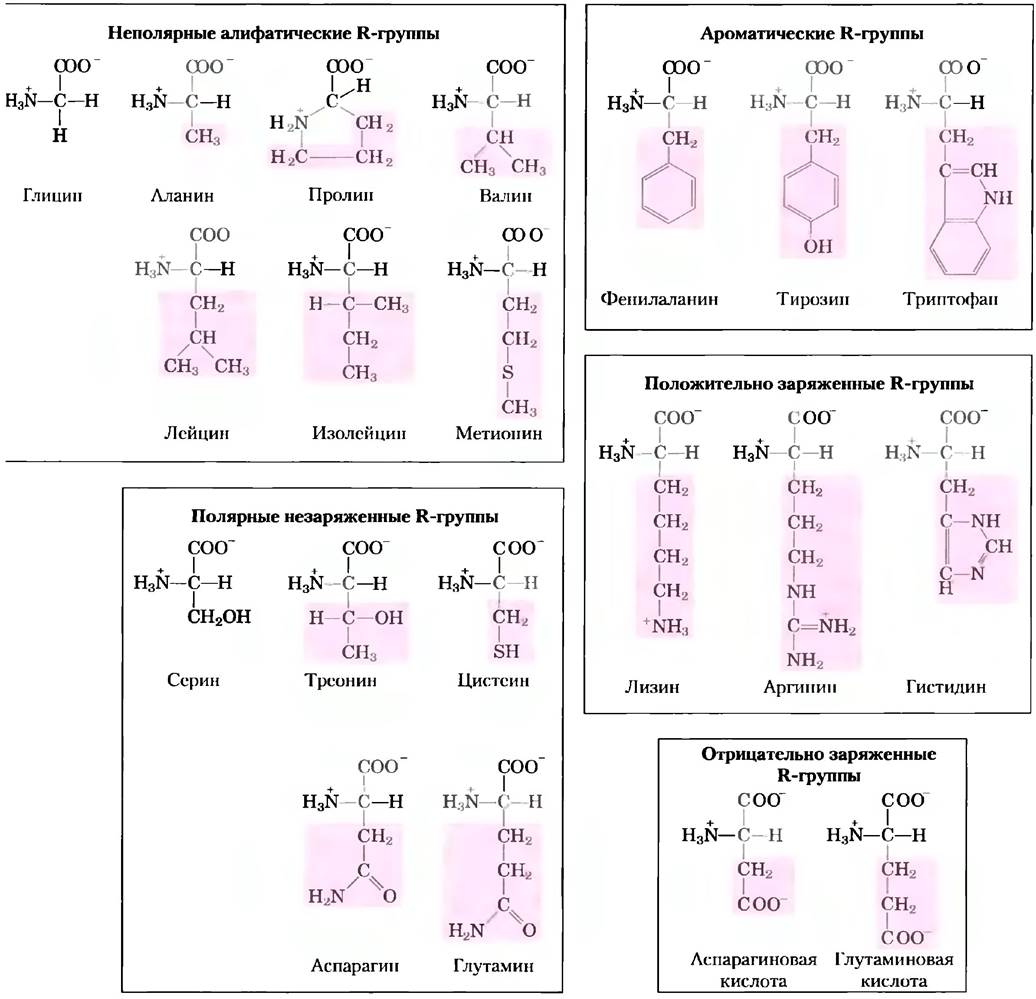
Неполярные алифатические R-группы. В аминокислотах этого класса R-группы являются неполярными и гидрофобными. Боковые цепи аланина, валина, лейцина и изолейцина в белках в результате гидрофобных взаимодействий стремятся объединяться в кластеры, что стабилизирует структуру белка. Глицин отличается самым простым строением среди всех аминокислот. Хотя по формальным признакам он является неполярной молекулой, его слишком маленькая боковая цепь не вносит никакого реального вклада в гидрофобные взаимодействия. Одна из двух аминокислот, содержащих серу - метионин — в боковой цепи имеет неполярную тиоэфирную группу. Молекула пролинасодержит алифатическую боковую цепь, образующую циклическую структуру. Аминогруппа (точнее, иминогруппа) пролина удерживается в жесткой конформации, что снижает гибкость полипептидных участков, содержащих остатки пролина.
Ароматические R-группы. Фенилаланин, тирозин и триптофан, имеющие ароматические группы в боковой цепи, — относительно неполярные и гидрофобные молекулы. Все они могут участвовать в гидрофобных взаимодействиях. Гидроксильная группа тирозина может образовывать водородные связи и является важной функциональной группой в некоторых ферментах. Тирозин и триптофан — гораздо более полярные молекулы, чем фенилаланин, что связано с наличием у тирозина гидроксильной группы, а у триптофана — индольного кольца.
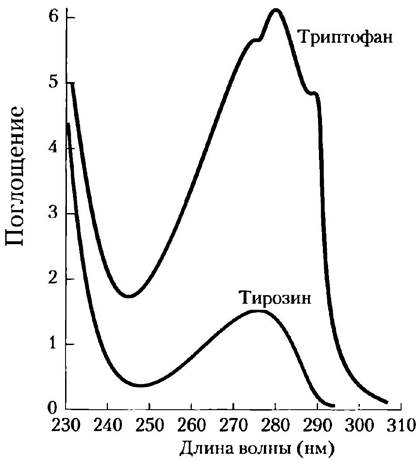
Триптофан, тирозин и в меньшей степени фенилаланин способны поглощать свет в ультрафиолетовой области (рис. 3-6, доп. 3-1), в результате чего большинство белков поглощают свет с длиной волны 280 нм. Это характерное свойство белков активно используется в биохимических исследованиях.
Рис. 3-6. Поглощение ультрафиолетового света ароматическими аминокислотами. Приведены спектры поглощения для ароматических аминокислот триптофана и тирозина при pH 6,0. Кислоты были взяты в эквимолярных количествах (10-3 М) и находились в идентичных условиях. Видно, что триптофан поглощает приблизительно в четыре раза сильнее тирозина. Заметьте, что максимумы поглощения обеих аминокислот расположены в области 280 нм. Поглощение света третьей ароматической аминокислотой — фенилаланином (не показано) — обычно оказывает лишь незначительное влияние на спектральные свойства белков.
Полярные незаряженные R-группы. Аминокислоты с такими R-группами лучше растворяются в воде, т. е. более гидрофильны, чем неполярные аминокислоты, поскольку способны образовывать с водой водородные связи. К этому классу аминокислот относятся серин, треонин, цистеин, аспарагин и глутамин. Полярность серина и треонина обеспечивается наличием в их структуре гидроксильной группы, полярность цистеина — наличием сульфгидрильной группы (которая является слабой кислотой и может образовывать водородные связи с атомами кислорода и азота), а аспарагина и глутамина — амидными группами.
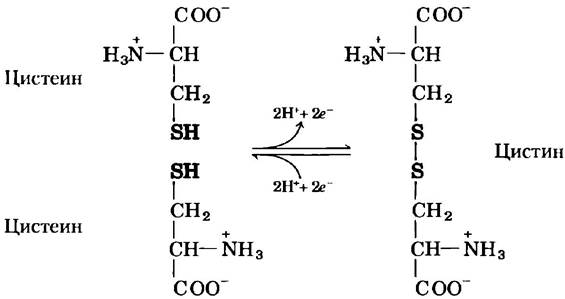
Аспарагин и глутамин амиды двух других аминокислот, также входящих в состав белков (соответственно аспарагиновой и глутаминовой кислот), в которые они легко превращаются под действием кислот или оснований. Цистеин легко окисляется с образованием ковалентно сшитого димера, называемого цистином, в котором два остатка цистеина соединены дисульфидной связью (рис. 3-7). Такие связанные сульфидными мостиками молекулы являются сильно гидрофобными (неполярными). Дисульфидные связи играют особую роль в структуре многих белков, поскольку образуют ковалентные сшивки между отдельными частями белковой молекулы или даже между разными полипептидными цепями.
Рис. 3-7. Обратимая реакция образования дисульфидной связи при окислении двух молекул цистеина. Дисульфидные мостики между остатками цистеина стабилизируют многие белковые структуры.
Положительно заряженные (основные) R-группы. Группы, несущие положительный или отрицательный заряд, наиболее гидрофильны. К аминокислотам с большим положительным зарядом R-группы при pH 7,0 относится лизин, несущий вторую аминогруппу в ε-положении алифатической цепи, агринин с положительно заряженной гуанидиновой группой, а также гистидин, имеющий имидазольную группу. Гистидин является единственной аминокислотой, содержащей ионизируемую боковую цепь с рКа в нейтральной области, поэтому при pH 7,0 он может быть положительно заряжен (протонированная форма) или не заряжен. Остатки His участвуют во многих ферментативных реакциях, выступая в роли доноров или акцепторов электронов.
Отрицательно заряженные (кислые) R-группы. R-группы двух аминокислот — аспарагиновой и глутаминовой — имеют отрицательный заряд при pH 7,0; обе аминокислоты содержат вторую карбоксильную группу.
«Нестандартные» аминокислоты также выполняют важные функции
Кроме 20 «стандартных» (основных) аминокислот белки могут содержать аминокислотные остатки, образовавшиеся при модификации обычных аминокислот, уже включенных в полипептидную цепь (рис. 3-8, а). Среди этих «нестандартных» аминокислот следует назвать производное пролила 4-гидроксипролин и производное лизина 5-гидроксилизин. Оба этих соединения обнаружены в составе коллагена — фибриллярного белка соединительной ткани, а 4-гидроксипролин, кроме того, входит в состав белков клеточной стенки растений. В мышечном белке миозине, участвующем в сокращении мышц, присутствует 6-N-метиллизин. Еще одна важная нестандартная аминокислота — это y-карбоксиглутаминовая кислота, обнаруженная в протромбине (белке, участвующем в процессе свертывания крови), а также в некоторых других белках, которые, как и протромбин, при выполнении своей биологической функции связывают ионы Са2+. Более сложным строением отличается аминокислота десмозин (производное лизина), найденная в фибриллярном белке эластине.
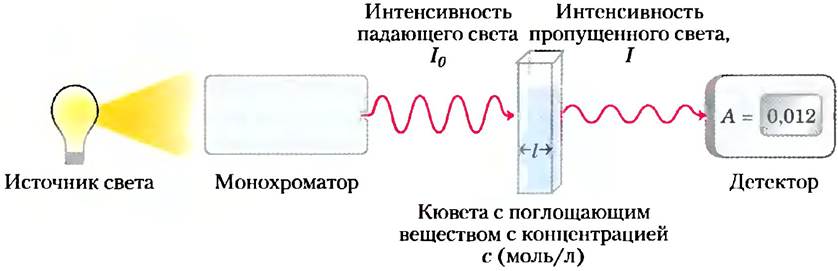
Практическая биохимия. Поглощение света: закон Ламберта-Бера
Многие биомолекулы поглощают свет с определенной длиной волны (например, см. спектр поглощения триптофана, рис. 3-6). Поглощение света, измеряемое с помощью спектрофотометра, используют для обнаружения и идентификации веществ, а также для определения их концентрации в растворе. Поглощение света пропорционально толщине поглощающего слоя (длине светового пути) и концентрации поглощающего вещества (рис. 1). Математически эго правило выражается законом Ламберта-Бера: ig(I/I0) = εсI, где I0— интенсивность падающего света, I интенсивность пропускаемого света, ε — коэффициент молярной экстинкции (в единицах л/ (моль • см)), с — концентрация поглощающего вещества (моль/л), I — толщина поглощающего слоя (см). Закон Ламберта-Бера выполняется для монохроматического света (свет с определенной длиной волны), причем поглощение света обусловлено молекулами растворителя и молекулами растворенного вещества, ориентированных случайным образом. Выражение lg(l/l0) называется поглощением и обозначается буквой А (от англ, absorbance).
Важно отметить, что при прохождении света через поглощающий слой толщиной 1 см каждый следующий миллиметр пути поглощает нс одно и то же постоянное количество света, а постоянную долю интенсивности попадающего в него света. Однако при фиксированной длине пути луча света поглощение (А) прямо пропорционально концентрации поглощающего вещества.
Коэффициент молярной экстинкции зависит от природы поглощающего вещества, типа растворителя и длины волны, а также от pH, если поглощающее вещество может существовать в нескольких состояниях ионизации, имеющих разные абсорбционные свойства.
Рис. 1. Принципиальная схема спектрофотометра. Источник света излучает в широком диапазоне длин волн, однако монохроматор пропускает свет только определенной длины волны. Монохроматический свет проходит через образец, помещенный в кювету толщиной l, где поглощается (пропорционально концентрации с поглощающего вещества). Прошедший сквозь кювету свет имеет меньшую интенсивность, которая измеряется с помощью детектора.
Следует сказать несколько слов о селеноцистеине. Эта редкая аминокислота возникает нс в результате модификации вновь синтезированной белковой цени, а встраивается в нее в процессе синтеза. В отличие от цистеина селеноцистеин содержит не серу, а селен. Эта аминокислота является на самом деле производным серина и обнаружена пока лишь в небольшом числе белков.
Некоторые остатки аминокислот в белке мот быть «на время» модифицированы, чтобы изменить работу этого белка. Добавление фосфатной, метальной, ацетильной, аденильной, АDР-рибозильной или других групп к определенным остаткам аминокислот может усилить или снизить активность белка (рис. 3-8, б). Самая частая регуляторная модификация — это фосфорилирование. Изменения ковалентных связей как способ регуляции более подробно обсуждается в гл. 6.
Рис. 3-8. «Нестандартные» аминокислоты, а) В составе белков обнаружено несколько нестандартных аминокислот, образующихся при модификации основных аминокислот. Красным цветом выделены функциональные группы, появляющиеся в результате модификации. Молекула десмозина образуется из четырех остатков лизина (выделены желтым цветом). Обратите внимание, что для обозначения атомов углерода в таких структурах используют цифры или греческие буквы. 6) Обратимо модифицированные аминокислоты, использующиеся при регуляции активности белков. Наиболее частый метод модификации — фосфорилирование, в) Орнитин и цитруллин не встречаются в белках, а являются интермедиатами в биосинтезе аргинина и в цикле мочевины.
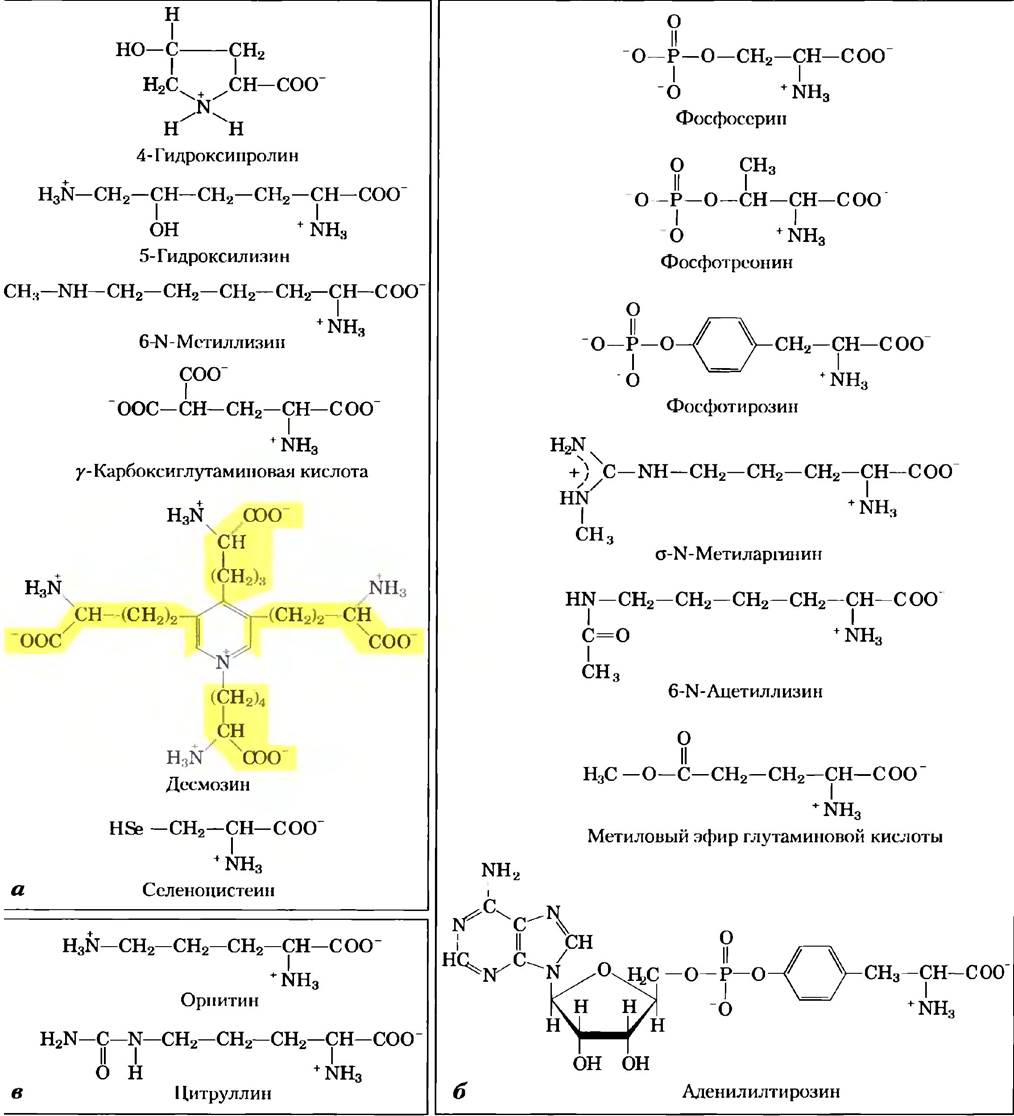
Кроме того, в клетках найдено еще около 300 аминокислот. Они выполняют множество различных функций, но не входят в состав белков. Орнитин и цитруллин (рис. 3-8, в) заслуживают отдельного упоминания, поскольку являются ключевыми метаболитами в биосинтезе аргинина (гл. 22) и в цикле мочевины (гл. 18).
Аминокислоты могут действовать как кислоты или основания
Аминогруппы и карбоксильные группы аминокислот, а также ионизируемые R-группы некоторых аминокислот выступают в роли слабых кислот и оснований. В водном растворе с нейтральным значением pH аминокислоты, не имеющие ионизируемой R-группы, присутствуют в виде биполярных ионов, или цвиттер-ионов (от нем. гибридный ион; рис. 3-9). Вещества с такой двойственной природой являются амфотерными (от греч. amphi — оба) и часто называются амфолитами (сокращение от «амфотерные электролиты»). Простая моноаминомонокарбоновая α-аминокислота, такая как аланин, по существу представляет собой двухосновную кислоту, когда находится в полностью протонированной форме, т. е. когда протон присоединен и к карбоксильной группе, и к аминогруппе. В таком случае кислота при диссоциации может отдавать два протона:
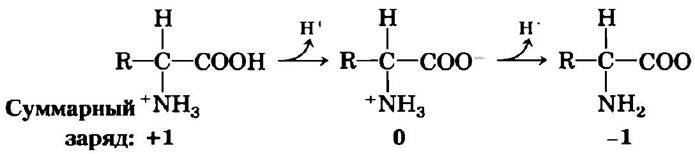
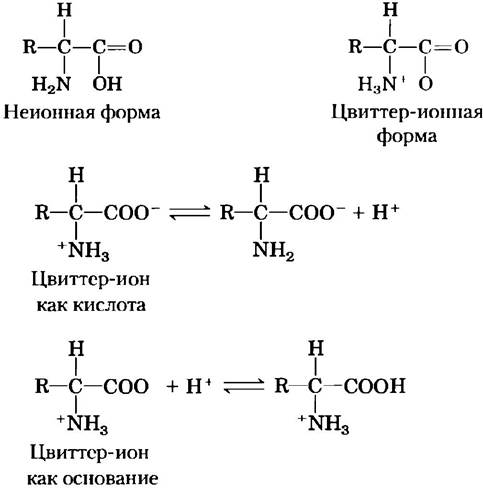
Рис. 3-9. Неионная и биполярная формы аминокислот. Неионная форма практически отсутствует в водном растворе; при нейтральном значении pH преобладает биполярная форма (цвиттер-ион). Цвиттер-ион может выступать и как кислота (донор протона), и как основание (акцептор протона).
Аминокислоты имеют характерные кривые титрования
Суть процесса кислотно-основного титрования состоит в постепенном добавлении или удалении протонов (гл. 2). На рис. 3-10 приведена кривая титрования полностью протонированного глицина. Две ионизируемые группы глицина — карбоксильную группу и аминогруппу — можно оттитровать с помощью сильного основания, такого как NаОН. Кривая титрования имеет два хорошо различимых участка, соответствующих депротонированию двух разных групп в молекуле глицина. Каждая часть кривой в отдельности напоминает по форме кривую титрования одноосновной кислоты, например, уксусной (рис. 2-16), и может быть проанализирована тем же способом. При очень низких значениях pH глицин преимущественно существует в полностью протонированном состоянии — в форме +Н3N-СН2-СООН. В средней точке первой стадии титрования, на которой -СООН-группа теряет свой протон, наблюдается равенство молярных концентраций донора протонов (+Н3N-СН2-СООН) и акцептора протонов (+Н3N-СН2-СОО-). pH в средней точке титрования (в точке перегиба) численно равно рКа титруемой протонированной группы (рис. 2-17). В случае глицина значение pH в средней точке 2,34, откуда следует, что рКa -СООН- группы глицина равно 2,34 (рК1 на рис. 3-10). Мы обсуждали в гл. 2, что pH и рКа представляют собой удобные обозначения соответственно для концентрации протонов и константы равновесия реакции ионизации. Параметр рКa отражает способность группы отдавать свой протон; если эта способность снижается в 10 раз, то значение данного параметра возрастает на одну единицу. При продолжении титрования мы достигаем следующей важной точки при pH 5,97. В этой точке перегиба кривой заканчивается удаление первого протона и начинается удаление второго. При таком значении pH глицин в основном существует в форме биполярного иона 1 Н3N-СН2-СОО (цвиттер-иона). Позднее мы кратко обсудим эту точку перегиба (рl на рис. 3-10).
Рис. 3-10. Кривая титрования аминокислоты. Представлена кривая титрования 0,1 М раствора глицина при 25 °С. Над соответствующей областью кривой приведены ионные формы, преобладающие при данном значении pH. Голубым цветом выделены области с максимальной буферной емкостью (участки кривой, близкие к значениям рK1 = 2,34 и рК2 = 9,60). Обратите внимание, что 1 эквивалент ОН- соответствует добавлению 0,1 М NаОН.
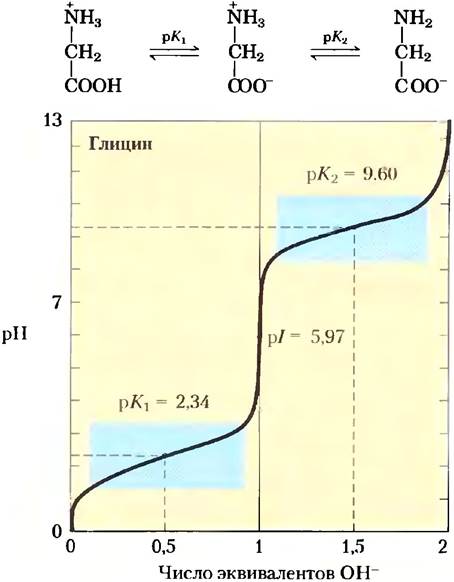
Вторая стадия титрования соответствует удалению протона с -NН3+ группы глицина. Средняя точка этой стадии титрования приходится на pH 9,60, следовательно, рКa данной группы глицина (рК2 на рис. 3-10) составляет 9,60. Титрование практически заканчивается при pH 12; на этом этапе преобладающей формой глицина является Н2N-СН2-СОО-.
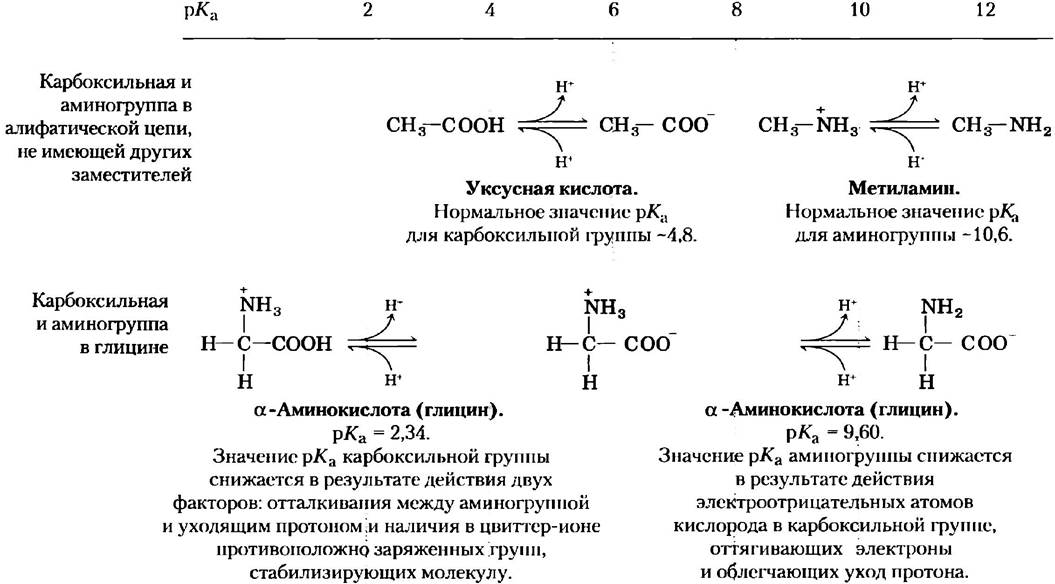
Из кривой титрования глицина мы можем извлечь ряд ценных сведений. Прежде всего, она дает нам численные значения рКa обеих ионизируемых групп: 2,34 для группы -СООН и 9,60 для группы -NН3+ Заметьте, что карбоксильная группа глицина в 100 с лишним раз более кислая (легче ионизируется), чем карбоксильная группа уксусной кислоты, которая, как было показано в гл. 2, имеет рКa 4,76 (это среднее значение рKa карбоксильной группы, соединенной с алифатической цепью, не имеющей других заместителей). Такое значительное отличие рКa глицина объясняется оттаскиванием между уходящим протоном и расположенной поблизости положительно заряженной аминогруппой у α-атома углерода (рис. 3-11). Противоположные заряды на образующемся цвиттер-ионе стабилизируют молекулу, что сдвигает равновесие реакции дальше вправо. Аналогично, значение рКa аминогруппы глицина ниже соответствующих средних значений рKa других аминогрупп. Этот эффект частично связан с наличием в карбоксильной группе молекулы электроотрицательных атомов кислорода, оттягивающих на себя электроны, что повышает стремление аминогруппы отдать протон. В результате α-аминогруппа в аминокислоте имеет более низкое значение рKa по сравнению с рКa алифатических аминов, например, рКa метиламина (рис. 3-11). Короче говоря, рКа любой функциональной группы сильно зависит от химического строения молекулы. Данный принцип часто реализуется в активных центрах ферментов, где измененные значения рКа донорных или акцепторных групп определенных аминокислотных остатков позволяют осуществить специфические реакции.
Рис. 3-11. Влияние химического строения молекулы на значение рКа. Значение рКа ионизируемых групп в глицине ниже соответствующих значений амино- и карбоксильных групп, связанных с алифатической цепью, не имеющей других заместителей. Изменение численных значений рКа объясняется внутримолекулярными взаимодействиями. Похожий эффект достигается при близости определенных групп соседних молекул, как это происходит в активном центре фермента.
Еще один важный факт, который можно извлечь из кривой титрования глицина, состоит в том, что эта аминокислота оказывает буферное действие в двух разных областях pH. Одна из них ограничивается сравнительно плоским участком кривой по обе стороны от значения первого рКа глицина (т. е. глицин может использоваться в качестве буфера в области pH 2,34 ± 1). Вторая буферная зона расположена в области pH 9,6. Заметьте, что глицин не может служить буфером при pH около 7,4, характерном для межклеточной жидкости и крови. Используя уравнение Хендерсона-Хассельбаха (с. 98), можно рассчитать, в каком соотношении нужно взять протонодонорные и протоноакцепторные формы глицина, чтобы приготовить буфер с определенным значением pH.
По кривой титрования можно предсказать электрический заряд аминокислоты
Кривые титрования, кроме прочего, содержат информацию о соотношении между суммарным электрическим зарядом молекулы и значением pH раствора. В точке перегиба на кривой титрования (при pH 5,97) глицин в основном присутствует в виде биполярного иона, полностью ионизованного, но с суммарным электрическим зарядом, равным нулю (рис. 3-10). Значение pH, при котором общий заряд молекулы равен нулю, называется изоэлектрической точкой и обозначается рl. В случае глицина, не имеющего других ионизируемых групп, значение изоэлектрической точки рассчитывается как среднее арифметическое из двух значений рКа:
![]()
Как видно из рис. 3-10, при любом значении pH выше значения рl молекула глицина имеет суммарный отрицательный заряд и в электрическом поле движется в сторону положительного электрода (анода). При любом значении pH ниже рl молекула глицина заряжена положительно и движется в сторону отрицательного электрода (катода). Чем дальше значение pH раствора глицина от его изоэлектрической точки, тем больше суммарный заряд молекул глицина. Например, при pH 1,0 почти весь глицин существует в форме +Н3N-СН2-СООН с суммарным зарядом 1,0. При pH 2,34, когда мы имеем дело со смесью равных количеств +Н3N-СН2-СООН и +H3N-CH2-COO-, средний или суммарный положительный заряд молекул равен 0,5. Аналогичным образом можно предсказать знак и величину заряда любой аминокислоты при любом значении pH.
Аминокислоты различаются по своим кислотно-основным свойствам
Благодаря сходству многих аминокислот можно сделать некоторые обобщения и упрощения, касающиеся их кислотно-основных свойств. Все аминокислоты, содержащие одну α-аминогруппу, одну α-карбоксильную группу и неионизируемую R-группу, имеют кривые титрования, сходные с кривой титрования глицина (рис. 3-10). У этих аминокислот близкие, хотя и не одинаковые, значения рКa: для -СООН группы — в диапазоне от 1,8 до 2,4, а для NН3- группы — от 8,8 до 11,0 (табл. 3-1). Различия в значениях рКaопределяются влиянием R-групп. У аминокислот с ионизируемой R-группой более сложные кривые титрования, имеющие три стадии, соответствующие трем возможным состояниям ионизации. Такие аминокислоты характеризуются тремя значениями рКa. Стадия, соответствующая титрованию 11-группы, в какой-то степени сливается с двумя другими. На рис. 3-12 приводятся кривые титрования двух аминокислот данного тина — глутаминовой кислоты и гистидина. Изоэлектрические точки таких аминокислот определяются типом их R-группы. Например, глутаминовая кислота имеет рl = 3,22, т. е. значительно ниже, чем у глицина. Это связано с наличием в молекуле двух карбоксильных групп, которые при pH 3,22 (среднее между их значениями рKа) придают молекуле суммарный заряд -1, уравновешивающий заряд +1 на аминогруппе. Аналогичным образом, рl гистидина, имеющего в протонированной форме две положительно заряженные группы, составляет 7,59 (среднее между значениями рКa, аминогруппы и имидазольной группы), т. е. гораздо выше, чем у глицина.
Рис. 3-12. Кривые титрования: а) глутаминовой кислоты и б) гистидина. Значения рКа R-групп обозначены как рКа.
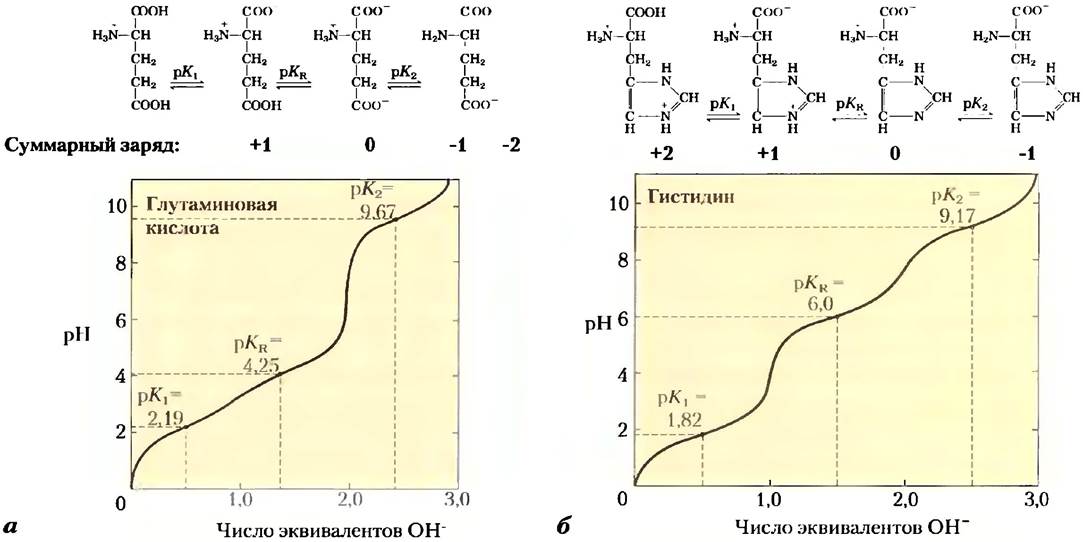
Наконец, следует еще раз напомнить, что лишь одна аминокислота гистидин содержит R-групну (рКа = 6,0), обеспечивающую значительную буферную емкость при нейтральных значениях pH, характерных для внутри- и внеклеточных жидкостей большинства бактериальных и животных клеток (табл. 3-1).
Краткое содержание раздела 3-1. Аминокислоты
■ Двадцать основных аминокислот, встречающихся в белках, содержат α-карбоксильную группу, α-аминогруппу и характерную R-группу у α-атома углерода, α-Атом углерода у всех аминокислот, за исключением глицина, является асимметрическим, в результате чего все аминокислоты могут существовать в виде двух стереоизомерных форм. Однако в белках обнаружены лишь L-стереоизомеры, пространственная конфигурация которых соответствует абсолютной конфигурации L-глицеральдегида, использующегося в качестве стандарта.
■ Другие, гораздо более редкие, аминокислоты также могут встречаться в составе белков (где они образуются в результате модификации обычных аминокислот после завершения белкового синтеза) или в качестве свободных метаболитов.
■ На основании полярности и заряда R-групп (при pH 7,0) все аминокислоты подразделяют на пять классов.
■ Аминокислоты различаются по своим кислотно-основным свойствам и характеризуются кривыми титрования. Моноаминомонокарбоновые аминокислоты с неионизируемой R-группой при низких значениях pH являются двухосновными кислотами (+Н3NСН(R) СООН), а по мере повышения pH образуют различные ионные формы. Аминокислоты с ионизируемой R-группой имеют дополнительные ионные формы в зависимости от pH среды и значения рКа R-группы.