ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
2. ВОДА
Вопросы и задачи
1. Растворимость этанола в воде.
Объясните, почему этанол СН3СН2ОН лучше растворяется в воде, чем этан CIН3CH3.
2. Расчет значения pH на основании концентрации ионов водорода.
Каков pH раствора с концентрацией протонов: а) 1,75 • 10-5 моль/л; б) 6,50 • 10-10 моль/л; в) 1,0 • 10-4 моль/л; г) 1,50 • 10-5 моль/л?
3. Расчет концентрации ионов водорода на основании значений pH.
Какова концентрация протонов в растворе с pH: а) 3,82; б) 6,52; в) 11,11?
4. Кислотность соляной кислоты в желудке.
В клинической лаборатории проводили титрование 10 мл желудочного сока, взятого у пациента через несколько часов после еды, с помощью 0,1 М раствора NaOH до нейтральной реакции. Для этого понадобилось 7,2 мл NaOH. В желудке пациента к этому времени уже не содержалось непереваренной пищи или напитков, так что считаем, что никаких буферов в желудочном соке нет. Какова была кислотность желудочного сока?
5. Расчет рн раствора сильной кислоты или сильного основания:
а) Напишите реакцию кислотной диссоциации соляной кислоты,
б) Рассчитайте pH раствора 5,0 • 10-4 М НСl,
в) Напишите реакцию кислотной диссоциации гидроксида натрия,
г) Рассчитайте pH раствора 7,0 • 10-5 М NaOH.
6. Расчет значения pH на основании концентрации сильной кислоты.
Найдите pH раствора, приготовленного разведением 3,0 мл 2,5 М НСl водой до конечного объема 100 мл.
7. Измерение содержания ацетилхолина по изменению pH.
Концентрацию медиатора ацетилхолина можно определить по изменению pH в процессе гидролиза этого вещества. При инкубации ацетилхолина с ферментом ацетил холинэстеразой он количественно превращается в холин и уксусную кислоту, которая диссоциирует с образованием ацетат-иона и иона водорода:
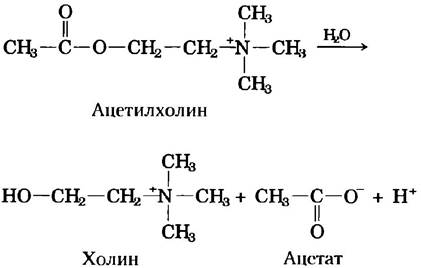
По данным анализа, водный раствор, содержащий неизвестное количество ацетилхолина, имел объем 15 мл и pH 7,65. После инкубации с ацетилхолинэстеразой pH раствора снизился до 6,87. Сколько молей ацетилхолина содержалось в 15 мл образца? Считайте, что анализируемая смесь не содержала буферов.
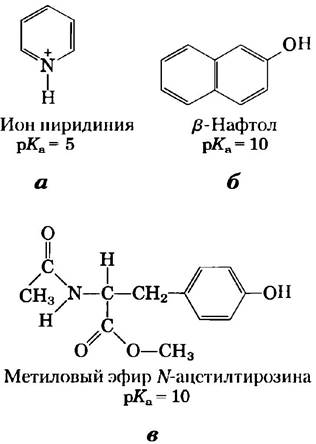
8. Физический смысл константы рКа.
Какой из перечисленных ниже водных растворов имеет самое низкое значение pH: 0,1 М НСI; 0,1 М уксусная кислота (рКа = 4,86); 0,1 М муравьиная кислота (рКа = 3,75)?
9. Приготовление уксуса.
Один из способов приготовления уксуса (далеко не самый лучший) состоит в разведении уксусной кислоты, единственного кислого компонента уксуса, до подходящего значения pH (см. рис. 2-14) и добавлении необходимых вкусовых добавок. Уксусная кислота (Мr = 60) при 25 °С представляет собой жидкость с плотностью 1,049 г/мл. Рассчитайте объем уксусной кислоты, который нужно добавить к дистиллированной воде, чтобы получить 1 л уксуса (см. рис. 2-15).
10. Идентификация сопряженного основания.
Что является сопряженным основанием в каждой приведенной ниже паре веществ?
а) RCOOH, RCOO-
б) RNH2, RNH3+
в) Н2РO4-, Н3РO4
г) H2СO3, HCO3-
11. Расчет pH раствора слабой кислоты и сопряженного основания.
Найдите pH разбавленного раствора, содержащего следующие молярные отношения ацетата калия и уксусной кислоты (рKа = 4,76): а) 2:1; б) 1:3; в) 5:1; г) 1:1; д) 1:10.
12. Зависимость растворимости от pH.
Сильно выраженная полярность воды и способность легко образовывать водородные связи делают ее прекрасным растворителем для находящихся в ионной форме (заряженных) веществ. Напротив, неионизированные и неполярные органические вещества, такие как бензол, очень плохо растворяются в воде. В принципе растворимость в воде любой органической кислоты или основания можно увеличить, переведя молекулу в заряженную форму. Например, бензойная кислота плохо растворяется в воде, однако добавление к раствору бикарбоната натрия приводит к повышению pH и депротонированию молекул бензойной кислоты с образованием бензоат-ионов, которые хорошо растворимы.

Рассмотрите приведенные ниже формулы веществ: в каком растворе они лучше растворятся — в 0,1 М NaOH или в 0,1 М НСl? Красным цветом отмечены протоны, способные диссоциировать.
13. Лечение сыпи, вызванной контактом с ядовитым плющом.
Производные катехола с длинными цепями алкильных групп, содержащиеся в ядовитом плюще и ядовитом дубе, вызывают характерную зудящую сыпь.
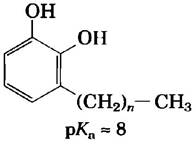
Если вы случайно дотронулись до ядовитого плюща, то какой из предложенных ниже способов обработки пораженного участка кожи следует применить и почему?
а) Промывание поверхности кожи холодной водой.
б) Промывание поверхности кожи разбавленным уксусом или лимонным соком.
в) Промывание поверхности кожи водой с мылом.
г) Промывание поверхности кожи водой с мылом и с бикарбонатом натрия (питьевой содой).
14. Значение pH и всасывание лекарственных веществ. Аспирин представляет собой слабую кислоту с рКa 3,5.
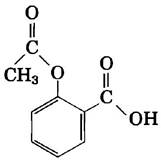
Он всасывается в кровь, проходя через клетки слизистой желудка и тонкой кишки. Для всасывания вещества необходимо, чтобы оно проникало сквозь плазматическую мембрану. Скорость этого процесса определяется полярностью молекулы: заряженные и сильно полярные вещества проникают медленно, а нейтральные гидрофобные молекулы проходят сквозь мембрану легко. Значение pH в содержимом желудка примерно равно 1,5, а в тонкой кишке — около 6. Откуда (из желудка или из кишечника) большее количество аспирина проникает в кровь и почему?
15. Расчет pH на основании молярной концентраций компонентов раствора.
Каково значение pH раствора, содержащего 0,12 моль/л NН4Сl и 0,03 моль/л NаОН (рКа пары NН4-/NH3 равно 9,25)?
16. Расчет pH после титрования слабой кислоты.
Вещество имеет значение рКa 7,4. К 100 мл 1,0 М раствора этого вещества с pH 8,0 добавили 30 мл 1,0 М соляной кислоты. Каков pH полученного раствора?
17. Свойства буфера.
Аминокислота глицин часто используется в биохимической практике в качестве основного компонента буфера. Аминогруппа глицина, имеющая рКa9,6, может существовать либо в протонированной форме (-NН3+), либо в виде свободного основания (-NН2) в соответствии с равновесием:
R-NH3+ ⇄ R-NН2 + Н+
а) В каком интервале pH глицин может быть использован в качестве эффективного буфера?
б) Какова доля молекул глицина с протонированной аминогруппой (-NН3+) в 0,1 М растворе при pH 9,0?
в) Какой объем 5 М раствора КОН нужно добавить к 1 л 0,1 М раствора глицина с pH 9,0, чтобы значение pH стало равно 10,0?
г) Каким должно быть численное соотношение между pH раствора и рКа аминогруппы глицина, чтобы 99% молекул глицина находились в протонированной форме?
18. Приготовление фосфатного буфера.
Каково отношение молярных концентраций НРО42- и Н2РO4- в растворе с pH 7,0? Фосфорная кислота (Н3РO4) имеет три значения рKа: 2,14, 6,86 и 12,4. Подсказка: в данном случае нужно знать лишь одно значение рKа.
19. Приготовление стандартного буфера для калибровки рН-метра.
Стеклянный электрод рН-метра даст электрический сигнал, величина которого пропорциональна концентрации ионов водорода. Для того чтобы по величине сигнала можно было определить значение pH, необходимо калибровать стеклянный электрод с помощью стандартных растворов с известной концентрацией ионов Н+. Определите, какие количества в граммах одпозамещенного фосфата натрия (NаН2РO4 • Н2O, мол. масса 138) и двузамещенного фосфата натрия (Nа2НРO4, мол. масса 141) необходимо взять для приготовления 1 л стандартного буфера с pH 7,00, в котором суммарная концентрация фосфатов равна 0,100 М (см. рис. 2-15). Значения рКа фосфорной кислоты возьмите из задачи 18.
20. Расчет отношения молярных концентраций сопряженного основания и слабой кислоты на основании значения pH.
Каково отношение молярных концентраций сопряженного основания и слабой кислоты (рKа = 6,0) при pH 5,0?
21. Приготовление буферного раствора с заданным значением pH и ионной силы.
Из 0,10 М растворов уксусной кислоты (рКа = 4,76) и ацетата натрия приготовьте 1,0 л 0,10 М ацетатного буфера с pH 4,0. Объясните свои действия.
22. Выбор слабой кислоты для приготовления буфера.
Раствор какого из перечисленных соединений будет иметь лучшие буферные свойства при pH 5,0: муравьиная кислота (рКa = 3,8), уксусная кислота (рКa = 4,76) или этиламин (рКа = 9,0)? Кратко поясните свой ответ.
23. Работа с буферными растворами.
Буферный раствор содержит 0,010 моль/л молочной кислоты (рKa = 3,86) и 0,050 моль/л лактата натрия, а) Определите pH буфера, б) Определите изменение pH, вызванное добавлением 5 мл 0,5 М НСl к 1 л буфера, в) Каким будет изменение pH, если такое же количество НСl добавить к 1 л воды?
24. Использование молярных концентраций для расчета pH.
Каково значение pH раствора, содержащего 0,2 М ацетат натрия и 0,6 М уксусную кислоту (рКa = 4,76)?
25. Приготовление ацетатного буфера.
Определите концентрации уксусной кислоты (рКa = = 4,76) и ацетата натрия, необходимые для приготовления 0,2 М буферного раствора с pH 5,0.
26. pH защитного секрета насекомых.
Вам посчастливилось наблюдать насекомое, защищавшееся от врагов с помощью выделения едкого вещества. Анализ этой жидкости показывает, что суммарная концентрация в ней формиата и муравьиной кислоты (Кa = 1,8 • 10-4) составляет 1,45 М; концентрация формиат-иона составляет 0,015 М. Каков pH этого раствора?
27. Расчет рКa.
Возможно, что неизвестное вещество X имеет карбоксильную группу с рКa = 2,0 и другую ионизируемую группу с рКa в диапазоне от 5 до 8. Когда к 100 мл 0,1 М раствора вещества X с pH 2,0 прибавили 75 мл 0,1 М NaOH, то значение pH выросло до 6,72. Определите рKa второй ионизируемой группы соединения X.
28. Ионные формы аланина.
Аланин — двухосновная кислота, способная претерпевать две реакции диссоциации (значения рКa см. в табл. 3-1). а) Пользуясь приведенной ниже структурой частично протонированной формыаланина (цвиттер-ион, см. рис. 3-9), изобразите химическую структуру двух других форм аланина, преобладающих в водном растворе: полностью протопированную и полностью депротонированную формы.
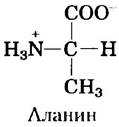
Какая из трех форм присутствует в наибольшей концентрации в растворах со следующими значениями pH: б) 1,0; в) 6,2; г) 8,02; д) 11,9? Объясните свой ответ, используя два значения рКа.
29. Регуляция pH крови путем изменения интенсивности дыхания.
а) Парциальное давление СО2 в легких может быстро меняться в зависимости от интенсивности и глубины дыхания. Например, известным средством избавления от икоты является повышение концентрации углекислого газа в легких. Этого можно добиться, если частично задерживать дыхание, медленно и неглубоко вдыхая воздух (гиповентиляция), или вдыхать и выдыхать воздух через бумажный пакет. В этих условиях парциальное давление СО2 в воздушном пространстве легких превысит норму. Объясните, как эти процедуры влияют на pH крови.
б) Бегуны на короткие дистанции непосредственно перед стартом, скажем на стометровку, примерно полминуты интенсивно и глубоко дышат (гипервентиляция). Значение pH крови при этом может подняться вплоть до 7,6. Объясните, почему повышается значение pH.
в) При беге па короткую дистанцию в мышцах из запасов глюкозы образуется большое количество молочной кислоты (СН3СН(ОН)СООН, Ка = 1,38 • 10-4). Исходя из этого факта, объясните, почему перед стремительным бегом полезна гипервентиляция легких.
30. Расчет pH крови на основании концентрации СО2 и бикарбоната.
Найдите значение pH образца плазмы крови, в котором общая концентрация СО2 составляет 26,9 мМ, а концентрация бикарбоната 25,6 мМ. Вспомните (с. 101), что нужная вам константа рКа угольной кислоты равна 6,1.
31. Влияние задержки дыхания на значение pH крови.
Значение pH внеклеточных жидкостей поддерживается за счет буферной системы бикарбонат/угольная кислота. При задержке дыхания концентрация газообразного углекислого газа СО2(г) в крови возрастает. Какое влияние, это может оказать на pH внеклеточной жидкости? Объясните свой ответ с помощью соответствующих уравнений для данной буферной системы.
Анализ экспериментальных данных
32. «Переключаемые» поверхностно-активные вещества.
Гидрофобные вещества плохо растворяются в воде, а вода очень часто используется в качестве растворителя. Это затрудняет многие процессы, такие как мытье жирной посуды, очистка поверхностей от пролитого жира, хранение салатных соусов, состоящих из водной и масляной составляющих, а также проведение химических реакций с одновременным участием гидрофильных и гидрофобных компонентов.
Поверхностно-активные вещества (ПАВ, детергенты или сурфактанты) — это класс амфифильных соединений, к которым относятся мыла, детергенты и эмульгаторы. С помощью ПАВ гидрофобные вещества можно перевести в раствор в виде мицелл (рис. 2-7). Мицелла имеет гидрофобное ядро, в которое включены гидрофобные вещества и гидрофобные «хвосты» ПАВ. Гидрофильные «головки» ПАВ покрывают внешнюю поверхность мицеллы. Суспензию мицелл называют эмульсией. Чем более выраженными гидрофильными свойствами обладает «головка» ПАВ, тем ПАВ мощнее, т. е. тем сильнее его способность переводить в эмульсию гидрофобное вещество.
Когда вы используете мыло для мытья жирной посуды, образуется эмульсия с жиром, которая легче удаляется водой, взаимодействующей с гидрофильными «головками» молекул мыла. Аналогичным образом, детергент можно использовать для перевода в эмульсию разлитого жира и облегчения его удаления водой. А эмульгаторы в готовых салатных соусах позволяют равномерно распределять частички масла в водной основе.
В некоторых ситуациях особенно удобно пользоваться «переключаемыми» ПАВ, т. е. веществами, которые могут находиться как в форме ПАВ, так и не ПАВ.
а) Представьте себе, что такой «переключаемый» ПАВ существует. Как бы вы использовали его для удаления жирного пятна и дальнейшего извлечения этого жира?
Лиу с соавторами описали прототип «переключаемого» ПАВ в своей статье «Переключаемые сурфактанты» (2006). Переключение основано на следующей реакции:
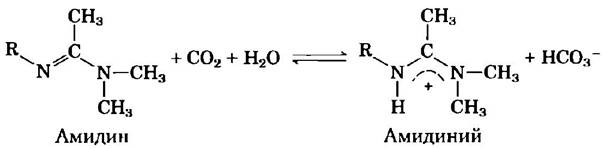
б) Учитывая, что рКа типичного иона амидиния составляет 12,4, в какую сторону (налево или направо), но вашему мнению, сдвинуто равновесие приведенной выше реакции? (Необходимые значения рКа представлены на рис. 2-16.) Поясните свой ответ. Подсказка: вспомните реакцию:
СО2 + Н2О ⇄ Н2СО3
Лиу и соавт. создали переключаемое ПАВ, в котором R = С16Нзз
в) Амидиний является мощным переключаемым ПАВ, амидин — нет. Объясните это наблюдение.
Лиу с соавторами обнаружили, что вызвать переключение между двумя формами ПАВ можно путем изменения состава газа, продуваемого через его раствор. Они продемонстрировали это переключение, измеряя электропроводность раствора. Водные растворы ионных веществ обладают более высокой проводимостью, чем растворы неионных веществ. Эксперимент начался с раствора амидиновой формы ПАВ в воде. Полученные результаты представлены ниже; пунктирные линии соответствуют переходу от одного газа к другому.

г) В какой форме находится большая часть ПАВ в точке А? А в точке В?
д) Почему электропроводность возрастает от нулевой точки к точке А?
е) Почему при перемещении от точки А к точке В электропроводность падает?
ж) Объясните, как бы вы использовали такой ПАВ для удаления жирного пятна и извлечения из него жира.