ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
Возможно, наиболее замечательным свойством (миоглобина) является его сложность и отсутствие симметрии. Его организация кажется начисто лишенной какой бы то ни было регулярности, которую инстинктивно ожидаешь найти, и оказывается гораздо более сложной, чем предсказывает любая структурная теория белка.
Джон Кендрю. Из статьи в журнале Nature, 1958
4. ТРЕХМЕРНАЯ СТРУКТУРА БЕЛКОВ
Остов типичного белка обусловлен образованием сотен ковалентных связей. Вокруг многих из этих связей возможно свободное вращение, поэтому молекула белка может принимать бесчисленное множество различных конформаций. Однако каждый белок несет специфическую химическую или структурную функцию, для реализации которой необходимо, чтобы он имел строго определенную трехмерную структуру (рис. 4-1). В конце 1920-х гг. были получены кристаллы некоторых белков, в том числе гемоглобина (Мr= 64 500) и фермента уреазы (Мr = 483 000). Учитывая, что упорядоченное расположение молекул в кристалле обычно возможно лишь при идентичности этих молекул, кристаллическое состояние очень многих белков доказывает, что даже самые крупные белки состоят из дискретных химических единиц с определенной структурой. Этот вывод в свое время полностью изменил взгляд на белки и их функции.
Рис. 4-1. Глобулярная структура химотрипсина. Чтобы дать представление о размерах, рядом с молекулой химотрипсина изображена молекула глицина. Известные трехмерные структуры белков хранятся в специальных банках данных (Protein Data Bank, PDB; см. доп. 4-4). Изображение взято из банка данных PDB (6GCH).
В данной главе мы обсудим, каким образом аминокислотная последовательность полипептидной цепи определяет трехмерную структуру белка. В связи с этим рассмотрим пять основных вопросов. Во-первых, трехмерная структура белка определяется его аминокислотной последовательностью. Во-вторых, функции белка зависят от его структуры. В-третьих, выделенный белок обычно существует в одной или нескольких стабильных структурных формах. В-четвертых, наиболее важный вклад в стабилизацию специфической структуры белка вносят не ковалентные, а другие взаимодействия. Наконец, в-пятых, среди огромного числа уникальных белковых структур можно выделить некоторые общие типы, помогающие понять принципы архитектуры белковых молекул.
Вынося на обсуждение эти темы, мы вовсе не имели в виду, что у белков статичная, неизменная трехмерная структура. Работа белка часто связана с взаимными превращениями двух или нескольких его пространственных форм. Динамические аспекты структуры белка обсуждаются далее в гл. 5 и 6. Понимание всех уровней структурной организации белков необходимо для обсуждения их функций, к которому мы перейдем в следующих главах.
4.1. Обзор белковых структур
Пространственная организация атомов в молекуле белка называется конформацией. Конформации белка — это все структурные формы, которые он может принимать без разрыва ковалентных связей. Изменения конформации могут происходить, например, в результате относительного вращения групп при одинарных связях. Из всего теоретически возможного многообразия конформаций белка с сотнями одинарных связей в биологических системах в нормальных условиях реализуется лишь один или несколько вариантов. Существование всего нескольких устойчивых конформаций белковой молекулы отражает необходимость тех изменений, которые происходят с большинством белков при связывании с другими молекулами или в каталитических реакциях. Реализуемые конформации обычно наиболее термодинамически выгодные и характеризуются наименьшим значением свободной энергии Гиббса (G). Белок в любой из функциональных конформаций называется нативным белком.
Что определяет устойчивость той или иной конформации белка? К пониманию этого мы придем постепенно — от обсуждения первичной структуры белка (гл. 3) через последующее знакомство с вторичной, третичной и четвертичной структурами. Данный традиционный подход к изучению белка мы дополним новым материалом по классификации так называемых сверхвторичных структур, образующихся при фолдинге белка. Начнем мы со знакомства с некоторыми основными принципами.
Конформация белка в значительной степени стабилизирована слабыми взаимодействиями
Если мы говорим о структуре белка, то стабильность (устойчивость) белка можно определить, как его способность сохранять свою нативную конформацию. Нативные белки в физиологических условиях стабильны лишь условно, изменение энергии ∆G от свернутого к развернутому белку не превышает 20 — 65 кДж/моль. Любая полипептидная цепь теоретически может принимать бессчетное число различных конформаций, в результате чего развернутый белок характеризуется высокой конформационной энтропией. Эта энтропия, а также водородные связи между многочисленными группами в полипептидной цепи и молекулами растворителя (воды) стремятся удержать белок в развернутом состоянии. Среди химических взаимодействий, противостоящих этим силам и стабилизирующих нативную конформацию, следует назвать дисульфидные связи и слабые (нековалентные) взаимодействия, описанные в гл. 2: водородные связи, гидрофобные и ионные взаимодействия.
Во многих белках дисульфидных мостиков нет. Условия внутри большинства клеток являются сильно восстановительными, что препятствует образованию связей -S-S-. У эукариот дисульфидные связи обнаруживаются в основном в секретируемых внеклеточных белках (например, в молекуле инсулина). В бактериальных белках дисульфидные связи также встречаются редко. Однако у термофильных бактерий и архей обычно содержится много белков с дисульфидными связями, стабилизирующими эти белки; возможно, это один из способов адаптации к существованию в условиях повышенных температур.
У большинства организмов при формировании полипептидной цепью внутриклеточного белка вторичной и третичной структур особенно важны слабые межмолекулярные взаимодействия. Образование четвертичной структуры из нескольких полипептидов тоже зависит от слабых взаимодействий.
Для разрыва одинарной ковалентной связи требуется от 200 до 460 кДж/моль, в то время как для нарушения слабых взаимодействий достаточно 4 — 30 кДж/моль. Отдельные ковалентные связи, участвующие в поддержании нативной конформации белка, такие как дисульфидные связи, удерживающие вместе части полипептидной цепи, очевидно, являются гораздо более прочными, чем отдельные слабые взаимодействия. Однако благодаря своей множественности именно слабые взаимодействия вносят основной! вклад в стабилизацию структуры белка. Обычно конформация белка с самой низкой свободной энергией (т. е. наиболее устойчивая) отличается максимальным числом реализованных слабых взаимодействий.
Стабильность белка определяется не просто суммой свободных энергий образования многих слабых взаимодействий внутри него. Каждая группа, участвующая в образовании водородной связи в свернутом белке, до сворачивания белка была связана водородными связями (приблизительно такой же силы) с водой, но эти связи разорвались. Общий вклад конкретного слабого взаимодействия в стабильность белка, или разность свободных энергий свернутого и развернутого белка, примерно равен нулю. Стабилизирующими или дестабилизирующими могут быть также взаимодействия ионов. Таким образом, чтобы понять, чем объясняется предпочтительность нативной конформации белка, нужно учесть еще и другие факторы.
При рассмотрении вкладов слабых взаимодействий в стабильность белка мы обнаружим, что обычно среди них преобладают гидрофобные взаимодействия. Чистая вода представляет собой сеть связанных водородными связями молекул Н2О. Никакие другие молекулы не имеют такого потенциала для образования водородных связей, поэтому любая другая молекула в водном растворе нарушает структуру водородных связей в воде. Любая гидрофобная молекула в водном растворе окружена структурированной оболочкой из молекул воды (сольватной оболочкой), возникающей в результате оптимальной организации водородных связей (см. рис. 2-7). Возрастающая упорядоченность молекул воды в сольватной оболочке характеризуется неблагоприятным с термодинамической точки зрения понижением энтропии. Однако если неполярные группы растворенного вещества собираются вместе и образуют кластеры, то размеры сольватной оболочки уменьшаются, поскольку в таком случае уже не вся поверхность неполярной группы экспонирована в растворе. Термодинамический результат этого — увеличение энтропии. Как было показано в гл. 2, энтропия является главной движущей силой, заставляющей гидрофобные группы ассоциировать в водном растворе. Таким образом, гидрофобные боковые цепи аминокислот склонны образовывать кластеры внутри молекулы белка, чтобы держаться подальше от воды.
В физиологических условиях образование водородных связей и ионные взаимодействия в основном являются результатом проявления все того же энтропийного фактора. Полярные группы обычно способны образовывать водородные связи с водой, т. е. обусловливают растворимость в воде. Однако число водородных связей на единицу массы в чистой воде гораздо выше, чем в любой другой жидкости или растворе, поэтому существует предел растворимости даже самых полярных молекул, поскольку их присутствие уменьшает число водородных связей на единицу массы раствора. Следовательно, даже вокруг полярных молекул образуется некая сольватная оболочка из структурированных молекул воды. Даже если в макромолекуле энергия образования внутримолекулярных водородных связей или ионных взаимодействий между двумя полярными группами в значительной степени нивелируется нарушением подобных взаимодействий между теми же группами и водой, высвобождение структурированных молекул воды при возникновении внутримолекулярных связей является движущей силой, которая способствует фолдингу. Итак, наибольшая доля выигрыша в свободной энергии, обусловленного слабыми взаимодействиями внутри белка, в водном растворе связана с ростом энтропии за счет исчезновения гидрофобных поверхностей. Этого выигрыша достаточно, чтобы компенсировать потери конформационной энтропии, связанные с принятием белком одной- единственной конформации.
Очевидно, что гидрофобные взаимодействия чрезвычайно важны для стабилизации, определенной конформации, обычно характеризующейся наличием внутри свернутой молекулы белка плотноупакованного гидрофобного ядра, состоящего из боковых цепей аминокислот. Очень важно также, чтобы все полярные или заряженные группы внутри молекулы белка имели подходящих партнеров для образования водородных связей и ионных взаимодействий. Одна водородная связь не вносит большого вклада в стабильность нативной структуры, однако наличие в гидрофобном ядре полярной или заряженной группы, нс имеющей партнера, может оказывать настолько сильное дестабилизирующее влияние, что подобная конформация может оказаться несостоятельной с термодинамической точки зрения. Выигрыш в свободной энергии, связанный с образованием пары между подобной группой и другой группой или молекулой в растворе, может превысить разницу между значениями свободных энергий свернутого и развернутого белка. Кроме того, образование водородных связей между группами белка в повторяющихся вторичных структурах является кооперативным процессом (т. с. образование одной связи повышает вероятность образования следующей связи), как это показано ниже. Таким образом, водородные связи часто вносят важный вклад в процесс укладки белка.
Стабилизировать нативную конформацию некоторых белков могут также взаимодействия между противоположно заряженными группами, образующими ионные пары (солевые мостики). Как и в случае водородных связей, в развернутой молекуле белка заряженные боковые цепи аминокислот взаимодействуют с водой и с солями, так что прекращение этих взаимодействий следует учитывать при оценке вклада солевых мостиков в стабильность упакованного белка. Однако прочность солевых мостиков возрастает при переходе к средам с меньшей диэлектрической проницаемостью (см. с. 77): от полярных водных сред (в около 80) к неполярной среде внутри белка (в около 4). Таким образом, солевые мостики, особенно те, что скрыты частично или полностью, могут играть важную роль в стабилизации структуры белка. Этот факт объясняет большое распространение скрытых солевых мостиков в белках термофильных организмов. Ионные взаимодействия также ограничивают подвижность белковой структуры и придают ей определенную уникальность, которую неспецифические гидрофобные взаимодействия обеспечить не могут.
Большинство типов белковых структур, обсуждаемых в данной главе, демонстрируют два простых правила: 1) гидрофобные аминокислотные остатки в значительной степени убраны внутрь молекулы белка для минимизации контакта с водой; 2) в молекуле белка реализуется максимальное число водородных связей. Нерастворимые и мембраносвязанные белки (которые являются предметом обсуждения в гл. 11) подчиняются несколько другим правилам, что связано с их функциями и их окружением, но и на их структуру слабые взаимодействия оказывают решающее влияние.
Пептидные связи обладают жесткостью и плоской конфигурацией
Архитектура белка—первичная структура.Число возможных конформаций полипептида ограничивают также ковалентные связи. В конце 1930-х гг. Лайнус Полинг и Роберт Кори предприняли серию исследований, на основе которых сформировались наши нынешние представления о структуре белка. Они начали с тщательного изучения структуры пептидной связи.
Лайнус Полинг, 1901-1994

Роберт Кори, 1897-1971

Известно, что α-атомы двух соседних аминокислот разделены тремя ковалентными связями, расположенными в порядке Сα—С—N—Сα. Исследования кристаллов аминокислот и простых дипептидов методом рентгеновской дифракции показали, что пептидная связь С—N несколько короче, чем связь С—N в простых аминах, и что атомы, участвующие в образовании пептидной связи, копланарны (т. е. лежат в одной плоскости). Это означает наличие резонанса или частичного обобществления двух пар электронов между карбонильным кислородом и амидным азотом (рис. 4-2, а). Кислород имеет частичный отрицательный заряд, а азот — частичный положительный заряд, в результате чего возникает слабый электрический диполь. Шесть атомов, участвующих в образовании пептидной группы, лежат в одной плоскости, причем атом кислорода карбонильной группы и атом водорода амидной группы находятся в трансположении по отношению друг к другу. На основании этих данных Полинг и Кори сделали вывод, что пептидная связь С—N не допускает свободного вращения, поскольку частично носит характер двойной связи. Вращение возможно только вокруг связей Сα-С и N-Сα. Таким образом, остов полипептид ной цепи можно изобразить как ряд жестких поверхностей, способных вращаться относительно атомов Сα (рис. 4-2, б). Жесткость пептидной связи ограничивает число конформаций, которые принимает пептидная цепь.
Рис. 4-2. Плоская структура пептидной связи, а) Каждая пептидная связь из-за наличия резонанса до некоторой степени имеет характер двойной связи, и поэтому вращения вокруг нее не происходит. 6) Соседние α-атомы в полипептидной цепи разделяют три связи. Пептидная связь N—С не допускает свободного вращения. Связи N-Сα и Сα-С способны поворачиваться; их углы поворота обозначают соответственно буквами ɸ и![]() Вращение других одинарных связей может быть затруднено из-за большого размера или заряда R-группы. в) Атомы и плоскости, определяющие угол
Вращение других одинарных связей может быть затруднено из-за большого размера или заряда R-группы. в) Атомы и плоскости, определяющие угол![]() . г) По договоренности углы ɸ и
. г) По договоренности углы ɸ и![]() составляют 180° (или -180°), когда первый и четвертый атомы максимально удалены друг от друга, а пептидная цепь полностью растянута. Если смотреть (в любом направлении) вдоль связи, претерпевающей вращение, углы ɸ и
составляют 180° (или -180°), когда первый и четвертый атомы максимально удалены друг от друга, а пептидная цепь полностью растянута. Если смотреть (в любом направлении) вдоль связи, претерпевающей вращение, углы ɸ и![]() возрастают в том случае, когда четвертый атом поворачивается по часовой стрелке по отношению к первому атому. В белке некоторые изображенные здесь конформации (например, угол 0°) являются запрещенными из-за перекрывания атомов. На рисунках от б) до г) шарики, изображающие атомы, имеют меньший размер, чем ван-дер-ваальсовы радиусы для данного масштаба.
возрастают в том случае, когда четвертый атом поворачивается по часовой стрелке по отношению к первому атому. В белке некоторые изображенные здесь конформации (например, угол 0°) являются запрещенными из-за перекрывания атомов. На рисунках от б) до г) шарики, изображающие атомы, имеют меньший размер, чем ван-дер-ваальсовы радиусы для данного масштаба.
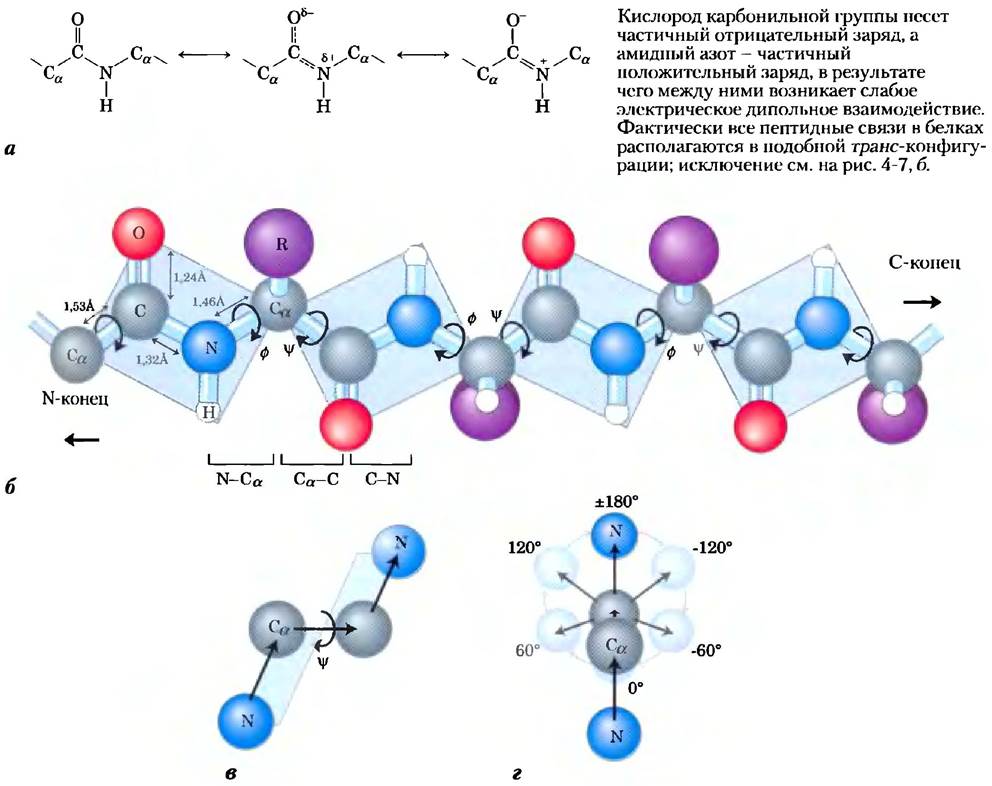
Конформационные изменения в белках описывают с помощью трех торсионных, или двугранных, углов, называемых φ (фи), Ψ (пси) и ω(омега), которые описывают вращение вокруг каждой из трех повторяющихся связей в пептидном остове. Торсионный угол — это угол пересечения двух плоскостей. В случае пептидов эти плоскости определяются направлениями связей в пептидном остове. Две последовательные связи задают плоскость. Три последовательно расположенные связи описывают две плоскости (центральная связь принадлежит обеим плоскостям; см. рис. 4-2, в), а угол между этими плоскостями как раз и описывает конформацию белка.
Ключевые договоренности.
Важные торсионные углы в пептидах описываются тремя векторами, соединяющими последовательно четыре атома основной цепи пептидного остова (рис. 4-2, б): угол ф образован связями С-N-Сα-С (вращение возможно вокруг связи N-Сα), a угол Ψ образован связями N-С-Сα-N. Оба угла составляют ±180" в том случае, когда пептидная цепь полностью растянута, и все пептидные группы лежат в одной плоскости (рис. 4-2, г). Если смотреть на центральную связь в направлении, совпадающем с направлением вектора (как показано на рис. 4-2, в, для угла φ), величина торсионного угла будет возрастать при повороте четвертого (дальнего) атома по часовой стрелке (рис. 4-2, г). Торсионный угол возрастает от -180" до 0", причем в этом положении первый и четвертый атомы заслоняют друг друга. Вращение может продолжаться от 0° до +180" (то же положение, что и при -180°), возвращая структуру в исходное положение. Третий торсионный угол, со, рассматривают не всегда. Он образуется связями Сα-С-N-Сα. В данном случае центральной связью является пептидная связь, вращение которой ограничено. Пептидная связь обычно (99,6% времени) находится в транс-конфигурации, в результате чего угол со принимает значение ±180°. В редких случаях цис- конфигурации пептидной связи ω = 0°. ■
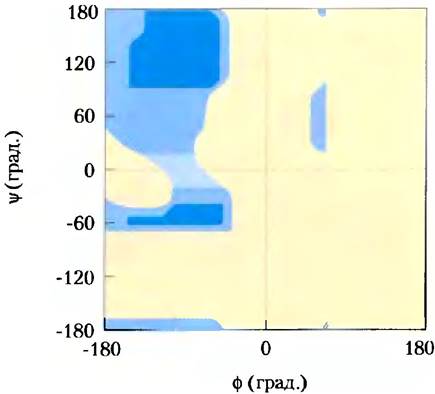
В принципе, углы φ и Ψ могут иметь любые значения от -180° до +180°, однако многие состояния являются запрещенными из-за стерических ограничений, вызванных влиянием атомов боковых цепей аминокислот. Так, например, по этой причине не реализуется конформация, при которой величины обоих углов φ и Ψ равны 0° (рис. 4-2, в). Данная конформация используется исключительно как нулевая точка для отсчета значений углов вращения. Возможные значения углов φ и Ψ можно найти из графика зависимости Ψ от φ по так называемой карте Рамачандрана (рис. 4-3), предложенной Г. Н. Рамачандраном.
Рис. 4-3. Карта Рамачандрана для остатка L-Ala. Конформация пептида описывается величинами углов φ и Ψ. Реализуются те конформации, при которых не наблюдается значительных стерических затруднений, что рассчитывается на основании известных ван-дер-ваальсовых радиусов атомов и углов поворота связей. Темно-синий цвет соответствует тем конформациям, в которых не наблюдается стерических затруднений и которые, следовательно, являются полностью разрешенными. Более светлый синий цвет соответствует конформациям, возможным в случаях неблагоприятных межатомных контактов. Самый светлый голубой цвет соответствует конформациям, которые возникают при изменении углов связей. Желтый цвет соответствует запрещенным конформациям. Отсутствие симметрии диаграммы является результатом L-стерео- изомерии аминокислотных остатков. Графики для других L-аминокислотных остатков с неразветвленными боковыми цепями выглядят очень похожим образом. Реализуемый диапазон углов связей для аминокислот с разветвленными боковыми цепями (Val Ilе, Thr) чуть уже, чем в случае Ala. Напротив, диапазон разрешенных конформаций остатка глицина, имеющего наименьшие стерические ограничения, гораздо шире. Диапазон разрешенных конформаций Pro сильно ограничен, поскольку значения φ лежат в пределах от -35° до -85°, что связано с циклической структурой боковой цепи.
Краткое содержание раздела 4.1 Обзор белковых структур
■ Каждый белок имеет определенную трехмерную структуру, связанную с его функцией.
■ Пространственная структура белка стабилизирована множеством слабых взаимодействий. Основной вклад в стабилизацию глобулярной структуры большинства растворимых белков вносят гидрофобные взаимодействия. Термодинамически наиболее устойчивые структуры характеризуются оптимальной организацией водородных связей и ионных взаимодействий.
■ Природа ковалентных связей в полипептидной цепи накладывает ограничения на структуру белка. Пептидная связь частично имеет характер двойной связи, в результате чего шесть атомов пептидной группы жестко зафиксированы в одной плоскости. Связи N—Сαи С—Сα допускают определенное вращение; соответствующие углы поворота обозначают греческими буквами φ и Ψ.