ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
Поскольку белки тем или иным образом участвуют во всех химических процессах в живом организме, определение их структуры и превращений, безусловно, окажет важнейшее влияние на развитие биологической химии.
Эмилъ Фишер. Из статьи в журнале Berichte der deutschen chemischen Gesellschaft zu Berlin, 1906
5. ФУНКЦИИ БЕЛКОВ
Знание трехмерной структуры белков очень важно для понимания их функций. Однако структура, изображенная на плоском листе бумаге, обманчиво статична. Белки — это динамичные молекулы, чьи функции почти всегда связаны с взаимодействиями с другими молекулами, а эти взаимодействия регулируются удивительными, иногда очень тонкими изменениями конформации белка. В этой главе мы обсудим, каким образом белки взаимодействуют с другими молекулами и как эти взаимодействия связаны с динамической структурой белка. Вряд ли можно переоценить значение молекулярных взаимодействий для функционирования белков. В гл. 4 мы показали, что функция фибриллярных белков в качестве структурных элементов клеток и тканей зависит от устойчивых, длительных взаимодействий между идентичными полипептидными цепями. В данной главе мы увидим, что функции многих других белков реализуются через взаимодействия со множеством различных молекул. Большинство этих взаимодействий мимолетны, тем не менее они могут быть основой сложных физиологических процессов, таких как перенос кислорода, иммунные реакции и сокращение мышц (эти три темы мы рассмотрим более подробно). На данных примерах можно проиллюстрировать ключевые принципы функционирования белков, причем с некоторыми из них вы уже познакомились в предыдущей главе. Основные принципы следующие.
В функционировании многих белков важную роль играет обратимое связывание других молекул. Молекула, которая обратимо связывается с белком, называется лигандом.Лигандом может быть любая молекула, в том числе и другой белок. Краткосрочность взаимодействия белка с лигандом имеет важнейшее значение для жизни, поскольку позволяет организму быстро и обратимо реагировать на изменение внешних условий и метаболических процессов.
Участок связывания лиганда на молекуле белка называется центром связывания; он подходит соответствующему лиганду по размеру, форме, заряду, а также по гидрофильности (гидрофобности). Кроме того, это взаимодействие является специфическим: белок связывается всего с одним или несколькими типами молекул из окружающего его множества самых разных соединений. Молекула белка может иметь центры связывания для нескольких различных лигандов. Подобные специфические взаимодействия играют важнейшую роль в поддержании упорядоченности в живых системах. Сейчас мы не будем обсуждать связывание воды, которая может участвовать в слабых и неспецифических взаимодействиях с белками. В гл. 6 мы отдельно остановимся на роли воды как специфического лиганда для многих ферментов.
Молекулы белков обладают большой гибкостью. Изменения их конформации могут быть едва различимыми и являться результатом внутримолекулярных колебаний и незначительных перемещений аминокислотных остатков в молекуле. Подобные изменения конформации иногда называют «дыханием» белка. Однако возможны и довольно резкие изменения конформации, при которых основные структурные элементы могут сдвигаться на несколько нанометров. Специфические конформационные изменения очень часто играют ключевую роль в функционировании белка.
Связывание белка с лигандом часто сопряжено с конформационными изменениями в молекуле белка, в результате которых достигается лучшая совместимость лиганда с центром связывания, а, следовательно, и более надежное связывание. Структурные перестройки, которыми сопровождается взаимодействие белка с лигандом, называют индуцированным соответствием.
В белках, состоящих из нескольких субъединиц, конформационные изменения в одной субъединице часто влекут за собой изменения в другой субъединице.
Взаимодействие лигандов с белками может регулироваться, что обычно достигается посредством специфических взаимодействий с еще одним или несколькими лигандами. Эти дополнительные лиганды могут вызывать конформационные изменения в молекуле белка, влияющие на связывание первого лиганда.
Говоря о функциях белков, следует отдельно остановиться на ферментах. Ферменты связывают другие молекулы и способствуют их превращениям, т. е. катализируют реакции. Молекулы, подвергающиеся изменениям в ферментативных реакциях, называют не лигандами, а субстратами, а участок молекулы фермента, где протекает ферментативная реакция, называют каталитическим или активным центром. В данной главе мы не будем останавливаться на каталитических функциях белков — этому важнейшему разделу биохимии посвящена гл. 6. Основные темы этой главы, а именно связывание, специфичность и конформационные изменения, будут развиваться в следующей главе в приложении к белкам, участвующим в химических превращениях.
5.1. Обратимое связывание белков с лигандами: белки, связывающие кислород
Возможно, миоглобин и гемоглобин являются наиболее хорошо изученными белками; для них впервые была определена трехмерная структура. Наши сегодняшние знания об этих белках — результат исследований, которые на протяжении нескольких десятилетий проводили тысячи биохимиков. Важно отмстить, что на примере этих белков можно проиллюстрировать практически все ключевые аспекты основного биохимического процесса — обратимого связывания лиганда с белком. Эти классические модельные белки могут многое рассказать о том, как белки функционируют. Кислородсвязывающий белок миоглобин и депонирование кислорода
Кислород связывается с простетической группой — гемом
Кислород плохо растворяется в воде (табл. 2-3), и если бы сыворотка крови содержала только растворенный кислород, то его поступление в ткани было бы недостаточным. Кроме того, диффузия кислорода в тканях на расстояния свыше нескольких миллиметров также неэффективна. Эволюция крупных многоклеточных организмов связана с возникновением белков, способных запасать и переносить кислород. Однако боковая цепь ни одной аминокислоты не годится для обратимого связывания молекулы кислорода. Эту функцию выполняют некоторые переходные металлы, в том числе железо и медь, обладающие высоким сродством к кислороду. Поэтому многоклеточные организмы используют для транспорта кислорода ионы металлов, чаще всего железа. Свободные ионы железа способствуют образованию очень реакционноспособных соединений кислорода, таких как гидроксильные радикалы, способные повредить ДНК и другие макромолекулы. Поэтому клетки используют железо в связанной форме, в которой оно менее активно. У многоклеточных организмов, особенно тех, в которых комплекс железа с кислородом должен переноситься на большие расстояния, железо часто встроено в связанную с белком простетическую группу — гем. (В гл. 3 мы определили простетическую группу как связанное с белком соединение, необходимое для выполнения специфической функции.)
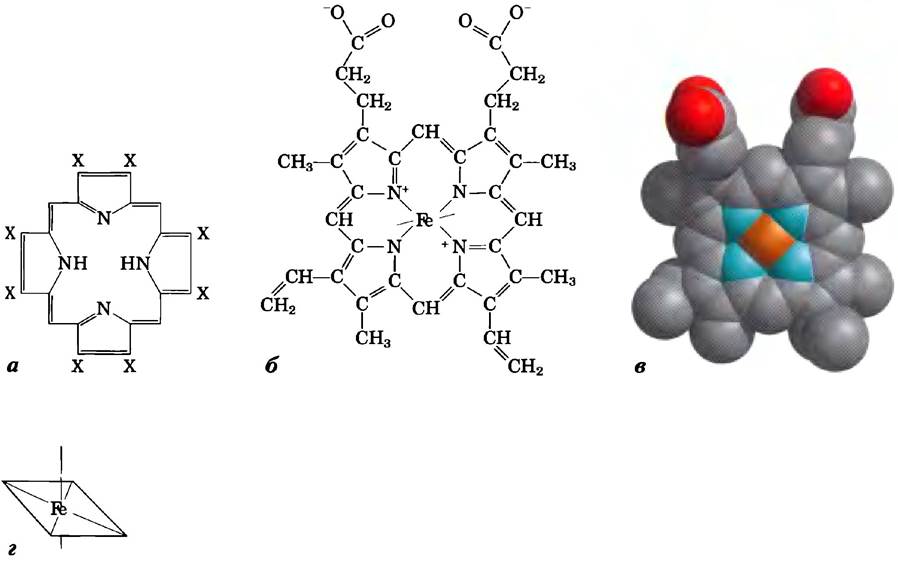
Гем представляет собой сложную циклическую структуру, называемую протопорфирином, с которой связан ион железа Fе2+ (рис. 5-1). Атом железа имеет шесть координационных связей: четыре связи образованы с атомами азота, являющимися частью плоского порфиринового кольца, а две связи направлены перпендикулярно плоскости порфиринового кольца. Координационная связь с элсктронодонорными атомами азота препятствует окислению гемового железа до состояния Fe3+. Железо в форме Fe2+ обратимо связывает молекулу кислорода, а железо в форме Fe3+ не связывает кислород. Гем обнаружен в целом ряде белков, отвечающих за перенос кислорода, а также в некоторых белках, участвующих в окислительно- восстановительных реакциях, например, в цитохромах (гл. 19).
Рис. 5-1. Структура гема. Гем обнаружен в молекулах миоглобина, гемоглобина и многих других белков — гемопротеинов. Гем представляет собой сложную полициклическую структуру (протопорфирин IX), с которой связан атом железа в форме Fе2+. а) Порфирин IX является лишь одним представителем класса порфиринов, молекулы которых состоят из пиррольных колец, связанных метиновыми мостиками и несущих заместители в положениях, обозначенных буквой X. б, в) Два способа изображения гема (РDВ ID1GGR). г) Атом железа в геме имеет шесть координационных связей: четыре расположены в плоскости порфиринового кольца и связаны с ним, а две направлены перпендикулярно этой плоскости.
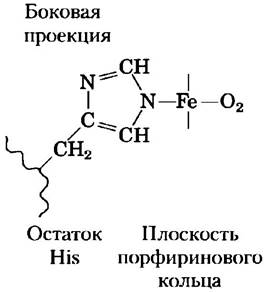
В гемовой группе, не связанной с белком, Fe2+ имеет две свободные координационные связи. Взаимодействие молекулы O2 с двумя молекулами гема (или двумя свободными ионами Fe2+) может привести к необратимому превращению Fe2+ в Fe3+. В гемсодержащих белках эта реакция не происходит, поскольку каждый гем спрятан глубоко внутри белковой структуры и доступ к двум свободным координационным связям ограничен. Одна из этих связей направлена на атом азота боковой цепи остатка His. Другая служит центром связывания молекулярного кислорода (O2) (рис. 5-2). При связывании кислорода свойства гемового железа изменяются; это, в частности, служит причиной изменения темно-красной окраски венозной крови на светло-красную окраску богатой кислородом артериальной крови. Некоторые небольшие молекулы, такие как монооксид углерода (СО) и монооксид азота (NO), имеют более высокое сродство к гемовому железу, чем молекула кислорода. При связывании с гемом молекулы СО происходит высвобождение O2, вот почему СО (угарный газ) так токсичен для аэробных организмов (подробнее см. доп. 5-1). Окружая и изолируя гем, кислородсвязывающие белки регулируют доступ к нему СО и других небольших молекул.
Рис. 5-2. Координационные связи гемового железа (вид сбоку). Две координационные связи Fe2+ направлены перпендикулярно плоскости порфиринового кольца. Одна из этих связей направлена на азот остатка His, иногда называемого проксимальным гистидином. Другая связь является центром связывания молекулы кислорода. Остальные четыре связи расположены в плоскости порфиринового кольца и связаны с ним.
В миоглобине один участок связывания кислорода
Миоглобин (Мb) имеет молекулярную массу 16 700 и является сравнительно простым кислородсвязывающим белком, обнаруженным практически у всех млекопитающих преимущественно в мышечной ткани. Он служит транспортным белком, облегчающим доставку кислорода к мышцам. Особенно богаты миоглобином мышцы морских млекопитающих, например, тюленей и китов; этим животным, проводящим длительное время под водой, миоглобин позволяет запасать необходимое
количество кислорода. Аналогичные миоглобину белки очень широко распространены и встречаются даже у некоторых одноклеточных организмов.
Миоглобин представляет собой единственную полипептидную цепь из 153 аминокислотных остатков, связанную с одной молекулой гема. Он является типичным представителем семейства глобинов, все члены которого имеют сходные первичную и третичную структуры. Полипептидная цепь миоглобина образует восемь α-спиральных участков, соединенных петлями (рис. 5-3). В α-спиральных участках сосредоточено около 78% аминокислотных остатков.
Рис. 5-3. Миоглобин (РDВ ID 1МВ0). Восемь α-спиральных участков молекулы (изображены в виде цилиндров) обозначены латинскими буквами от А до Н. Связывающие их участки обозначены как АВ, СD, ЕF и т. д. по названию тех спиралей, которые они соединяют. Некоторые связующие участки, такие как ВС или DЕ, очень короткие и не содержат ни одного остатка; обычно при изображении молекулы их не называют. (Имеющий некоторую протяженность участок между спиралями D и Е в данном случае является артефактом компьютерного моделирования.) Гем связан в кармане, образованном главным образом спиралями E и F, хотя аминокислотные остатки других участков также задействованы в его формировании.
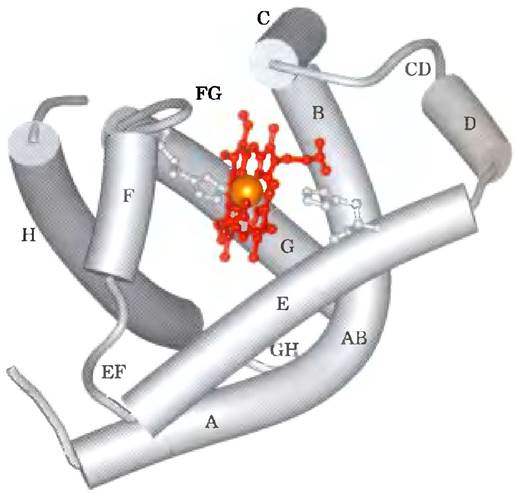
Любое детальное исследование функции белка обязательно связано с определением его структуры. На примере миоглобина мы обсудим некоторые особенности глобиновых белков. Как видно из рис. 5-3, спиральные участки молекулы обозначены буквами от А до Н. Отдельные аминокислотные остатки обозначены в соответствии с их позицией либо во всей полипептидной последовательности, либо в определенном α-спиральном участке. Например, в молекуле миоглобина остаток гистидина, связанный координационной связью с гемовым железом, обозначен как His93 (93-й аминокислотный остаток, считая от N-конца полипептидной цени миоглобина); иначе он же обозначается как His F8 (восьмой остаток в α-спирали F). Петли между спиральными участками указываются в соответствии с названиями соединяемых ими спиралей, например, АВ, CD, EF, FG и т. д.
Количественное описание взаимодействий белков с лигандами
Для выполнения своей функции миоглобин должен быть способен не только связывать кислород, но и высвобождать его по мере необходимости. При многих химических процессах происходят подобного рода обратимые взаимодействия белка и лиганда. Таким образом, количественное описание взаимодействия белка и лиганда является ключевым моментом многих биохимических исследований.
В общем случае обратимое связывание белка (Р) и лиганда (L) может быть описано простой обратимой ракцией:
Р + L ⇄ PL (5-1)
Эта реакция, которая характеризуется константой равновесия Ка:
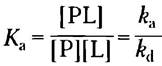 (5-2)
(5-2)
где ra и rd — это константы скорости (подробнее о них будет сказано ниже). Константа Ка — константа ассоциации (не путайте с константой диссоциации кислоты; с. 94), описывающая равновесие между комплексом и составляющими его компонентами в свободном состоянии. Константа ассоциации измеряется в М-1; чем больше значение этой константы, тем выше сродство лиганда и белка.
Константа равновесия Кa равна отношению скоростей прямой (образование комплекса) и обратной (диссоциация комплекса) реакций. Реакция образования комплекса описывается константой скорости ra, а реакция диссоциации — константой скорости rd. Как мы обсудим в следующей главе, константы скорости являются константами пропорциональности, определяющими долю вещества, реагирующего за данный промежуток времени. Если в реакции участвует одна молекула, как при диссоциации РL —> Р + L, это реакция первого порядка, а соответствующая константа скорости (rd) имеет размерность обратного времени (с-1). Если реагируют две молекулы, как при образовании комплекса Р + L —> РL, такая реакция называется реакцией второго порядка, а размерность соответствующей константы скорости (rа) — М-1 с-1.
Ключевые договоренности.
Константы равновесия принято обозначать заглавной буквой К, а константы скорости — строчной r.■
Если обе части уравнения 5-2 умножить на концентрацию лиганда, то станет видно, что отношение концентраций связанного и свободного белка прямо пропорционально концентрации свободного лиганда;
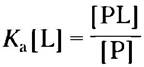 (5-3)
(5-3)
Если концентрация лиганда многократно превышает количество центров связывания лиганда на молекулах белка, то связывание лиганда с белком практически не влияет на концентрацию свободного (несвязанного) лиганда, т. е. [L] остается постоянной. Это допущение применимо к большинству лигандов, связывающихся с белками в клетке, и значительно упрощает наши вычисления.
Теперь мы можем ввести параметр θ (тета), отражающий долю занятых центров связывания лиганда на молекулах белка:
 (5-4)
(5-4)
Подставив вместо [РL] произведение Кa [Р][L] (см. уравнение 5-3) и сделав некоторые преобразования, получаем:
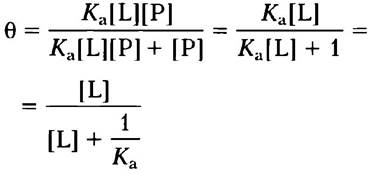 (5-5)
(5-5)
Таблица 5-1. Константа диссоциации некоторых комплексов с лигандами*
Белок |
Лиганд |
Kd(М) |
Авидин (яичный (белок)** |
Биотип |
1•10-15 |
Рецептор инсулина (человека) |
Инсулин |
1 • 10-10 |
Анти-ВИЧ антитела (человека) |
gp41 (поверхностный антиген ВИЧ-1) |
4 • 10-10 |
Никельсвязывающнй белок (E. соli) |
Ni2+ |
1 •10-7 |
Кальмодулин (крысы) * * * |
Са2+ |
3 •10-6 2 •10-5 |
Цветные полосы означают диапазон значений констант диссоциации при некоторых типичных взаимодействиях в биологических системах. Несколько реакций, такие как взаимодействие белка авидина и кофактора ферментов биотина, выходят за рамки нормального диапазона. Связывание авидина с биотином такое прочное, что реакцию можно считать необратимой. Специфичное к последовательности взаимодействие белка с ДНК характеризует белки, связывающиеся с определенной последовательностью нуклеотидов в ДНК, в отличие от обычного связывания с произвольным участком ДНК.

Данные значения констант диссоциации верны только в тех конкретных условиях, в которых они были определены. Значения Кd могут сильно изменяться (иногда на несколько порядков) при изменении концентрации солей и pH раствора, а также некоторых других параметров.
* Связь авидина с биотином (кофактором ферментов) является одной из наиболее прочных нековалентных связей, известных в биохимии на сегодняшний день.
** Кальмодулин имеет четыре центра связывания кальция. Здесь приведены значения Кd для центров связывания с наибольшим и наименьшим сродством, полученные в одном эксперименте.
Значение Ка можно определить из графика зависимости θ от концентрации свободного лиганда ([L]), как показано на рис. 5-4, а. Графиком любого уравнения вида х = у/(у + z)является гипербола, таким образом, θ представляет собой гиперболическую функцию [L]. По мере увеличения [L] доля занятых центров связывания асимптотически стремится к единице (насыщение). Концентрация лиганда, при которой занята половина центров связывания (θ = 0,5), соответствует 1/Кa.
Рис. 5-4. Графическое представление связывания лиганда. Представлена зависимость доли занятых центров связывания лиганда (θ) от концентрации свободного лиганда. Обе кривые описываются гиперболическим уравнением, а) Кривая связывания гипотетического лиганда L. Концентрация лиганда, при которой занята половина центров связывания, соответствует 1/Кa или Кd. Кривая имеет горизонтальную асимптоту при θ = 1 и вертикальную асимптоту при [L] = -1/Кa (не показана), б) Кривая связывания кислорода с миоглобином. Парциальное давление кислорода в газовой фазе над раствором выражено в килопаскалях (кПа). Кислород имеет высокое сродство к миоглобину, поэтому значение Р50 составляет всего 0,26 кПа.
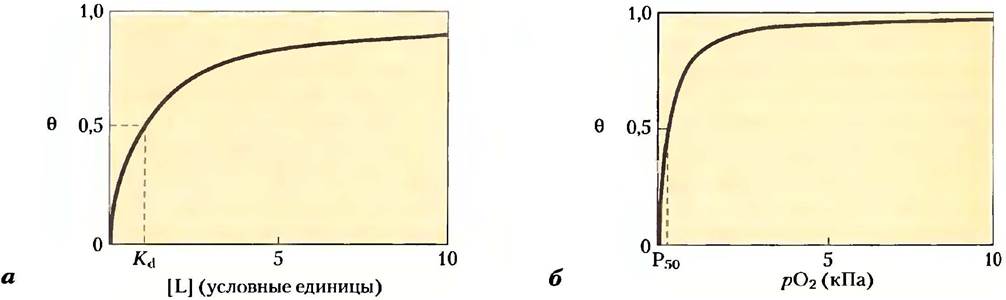
Чаще используют более понятный параметр — константу диссоциации Кa = 1 /Кa. Константа Кd измеряется в молях и характеризует реакцию высвобождения лиганда, т. е. диссоциацию комплекса РL.
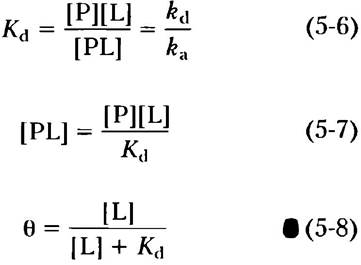
При [L] = Кd занята половина центров связывания лиганда. По мере снижения [L] все меньшая доля белка связывает лиганд. Для связывания лиганда в 90% доступных центров связывания значение [L] должно в девять раз превышать Кd.
На практике как меру сродства белка к лиганду константу Кd используют гораздо чаще, чем Кa. Заметьте, что чем меньше Кd, тем выше сродство белка к лиганду. Математические выкладки привели нас к простому утверждению: константа Кd равна молярной концентрации лиганда, при которой занята половина доступных центров связывания. В данной точке наблюдается полунасыщение белка лигандом. Чем выше сродство белка к лиганду, тем меньше концентрация лиганда, необходимая для достижения полунасыщения, т. е. тем меньше Кd. Некоторые значения констант диссоциации представлены в табл. 5-1; на масштабной линейке нанесены типичные для биологических систем значения констант диссоциации.
Пример 5-1. Константы диссоциации комплекса «Рецептор-Лиганд»
Два белка X и Y связывают один и тот же лиганд А; кривые связывания приведены ниже.
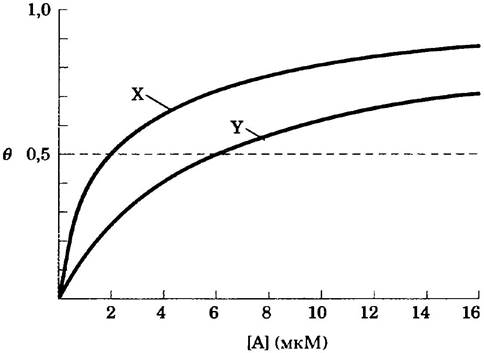
Какова константа диссоциации Кd для каждого белка? Какой белок (X или Y) обладает более высоким сродством к лиганду А?
Решение. Константы диссоциации можно найти из графиков. Если θ представляет собой долю центров связывания, занятых лигандом, то концентрация лиганда, при которой занята половина центров связывания (т. е. точка, в которой кривая связывания пересекает прямую θ = 0,5), соответствует константе диссоциации. В случае белка X Кd = 2 мкМ; в случае белка Y Кd = 6 мкМ. Поскольку половина насыщения X достигается при более низкой концентрации лиганда [А], его сродство к лиганду выше, чем сродство белка Y.
Связывание кислорода с миоглобином подчиняется описанным выше закономерностям. Однако поскольку кислород представляет собой газ, мы должны несколько видоизменить наши уравнения для их использования в лабораторной практике. Для начала вместо концентрации лиганда в уравнение 5-8 подставим концентрацию растворенного кислорода:
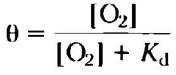 (5-9)
(5-9)
Как и для любого другого лиганда, константа Кd равна концентрации кислорода, при которой занята половина центров связывания миоглобина.
Обозначим эту концентрацию через [О2]0,5. Уравнение 5-9 примет вид:
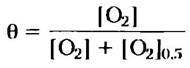 (5-10)
(5-10)
В тех случаях, когда в качестве лиганда выступает кислород, изменяемым параметром является парциальное давление кислорода в газовой фазе над раствором (рO2), поскольку его легче контролировать, чем концентрацию растворенного кислорода в жидкой фазе. Концентрация летучего вещества в растворе всегда пропорциональна его парциальному давлению в газовой фазе. Таким образом, если мы обозначим парциальное давление кислорода при его концентрации [О2]0,5 как Р50 и произведем замены в уравнении 5-10, то получим следующее выражение:
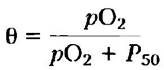 (5-11)
(5-11)
Кривая связывания миоглобина с кислородом в координатах θ от рO2 представлена на рис. 5-4, б.
Структура белка влияет на связывание с лигандом
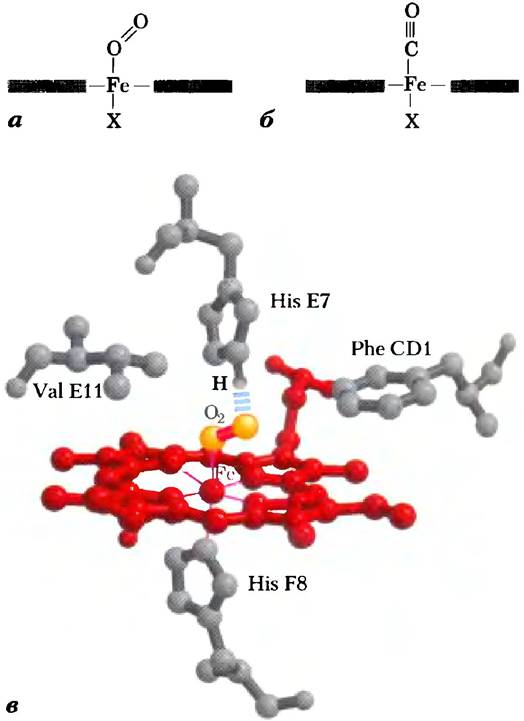
Связывание лиганда с белком редко осуществляется так просто, как может показаться при рассмотрении уравнения реакции. Это взаимодействие в значительной степени зависит от структуры белка и часто сопровождается конформационными изменениями. Например, специфичность связывания гема с лигандами изменяется, когда он встроен в молекулу миоглобина. Сродство монооксида углерода СО к свободному гему в 20 000 раз превышает сродство кислорода (т. е. Кd или Р50 для связывания СО со свободным гемом в 20 000 раз ниже, чем соответствующие значения для кислорода), однако сродство СО к гему в составе миоглобина лишь в 200 раз выше сродства кислорода. Это различие частично объясняется стерическими факторами. При связывании O2 со свободным гемом ось молекулы кислорода расположена под углом к связи Fе—О (рис. 5-5, а). Напротив, при связывании СО со свободным гемом все три атома — Fе, С и О — расположены на одной прямой (рис. 5-5, б). В обоих случаях образование связи определяется геометрией гибридных орбиталей каждого лиганда. Когда гем связан с миоглобином, остаток His64 (His Е7) на O2-связывающей стороне гема расположен слишком далеко, чтобы координировать гемовое железо, но тем не менее способен взаимодействовать с лигандом гема. Этот остаток, называемый дистальным гистидином, образует водородную связь с молекулой O2 (рис. 5-5, в), но может препятствовать линейному связыванию СО, что и объясняет относительное снижение сродства СО к гему в составе миоглобина (и гемоглобина). Это явление имеет важное физиологическое значение, поскольку СО является минорным побочным продуктом клеточного метаболизма. Возможно, существуют и какие-то другие факторы, модулирующие взаимодействие гема с СО в данных белках.
Рис. 5-5. Стерические эффекты при связывании лигандов с гемом в составе миоглобина. а) При связывании кислорода с гемом ось молекулы O2 расположена под углом к порфириновому кольцу, что вполне допускает конформация миоглобина. б) При связывании монооксида углерода со свободным гемом ось молекулы СО перпендикулярна плоскости порфиринового кольца. При связывании с гемом в составе миоглобина молекула СО должна несколько изогнуться, поскольку ее вертикальному положению мешает остаток His Е7 (дистальный His). Это ухудшает связывание СО с миоглобином. в) Еще один способ представления гема в составе миоглобина (PDB ID 1МВO), демонстрирующий расположение ключевых аминокислотных остатков. Молекула O2 образует водородную связь с дистальным His (His Е7 или His64), что еще более облегчает связывание кислорода.
Связывание кислорода с гемом в миоглобине зависит, кроме того, от колебаний молекулы белка. Гем спрятан глубоко внутри белковой глобулы, так что кислород не может напрямую проникнуть из раствора к центру связывания. Если бы белок имел жестко фиксированную структуру, кислород не мог бы хоть в сколько-нибудь значительной степени связываться или высвобождаться из комплекса с гемом. Но быстрые изгибы боковых цепей аминокислотных остатков способствуют кратковременному образованию пор в структуре белка, позволяющих кислороду проникать внутрь глобулы и выходить наружу. Компьютерное моделирование быстрых структурных флуктуаций в молекуле миоглобина подтверждает существование нескольких подобных путей. Один из основных путей открывается при вращении боковой цепи дистального His (His Е7), происходящем во временном интервале нескольких наносекунд (10-9 с). Этот факт еще раз подтверждает, что даже едва заметные конформационные изменения могут иметь решающее значение для активности белка.
Гемоглобин переносит кислород в крови
Кислородсвязывающий белок гемоглобин — транспорт кислорода.Практически весь кислород, транспортируемый кровью в организме животных, связан с гемоглобином и переносится с его помощью в составе эритроцитов (красных кровяных клеток). Нормальные эритроциты человека представляют собой небольшие двояковогнутые диски с диаметром от 6 до 9 мкм. Они образуются из стволовых клеток- предшественников — гемоцитобластов. В процессе созревания стволовые клетки образуют дочерние клетки, которые синтезируют большое количество гемоглобина и теряют ряд внутриклеточных органелл — ядро, митохондрии и эндоплазматический ретикулум. Таким образом, эритроциты представляют собой неполноценные, рудиментарные клетки, нс способные к самовоспроизведению, которые в организме человека живут не более 120 дней. Основная функция эритроцитов — это перенос гемоглобина, растворенного в цитозоле в высокой концентрации (массовая доля около 34%).
В артериальной крови, проходящей от легких через сердце к периферическим тканям, гемоглобин примерно на 96% насыщен кислородом. В венозной крови, возвращающейся к сердцу, гемоглобин насыщен кислородом лишь на 64%. Таким образом, каждые 100 мл крови оставляют в тканях около одной трети содержащегося в крови кислорода, т. е. 6,5 мл газообразного O2 (при атмосферном давлении и температуре тела).
Миоглобин, у которого кривая связывания кислорода имеет вид гиперболы (рис. 5-4, б), сравнительно малочувствителен к небольшим изменениям концентрации растворенного кислорода и потому может использоваться в качестве хранилища (депо) кислорода. Гемоглобин, состоящий из нескольких субъединиц и имеющий несколько центров связывания O2, лучше приспособлен для транспортировки кислорода. Как мы увидим далее, взаимодействие между субъединицами мультимерного белка способствует его высокой чувствительности к небольшим изменениям концентрации лиганда. Взаимодействие между субъединицами гемоглобина вызывает конформационные изменения, которые в свою очередь изменяют сродство белка к кислороду. Регулирование связывания O2 позволяет белкам, транспортирующим кислород, реагировать на изменения потребностей в кислороде в тканях.
Субъединицы гемоглобина имеют структуру, сходную со структурой миоглобина
Гемоглобин (Нb) имеет молекулярную массу 64 500 и представляет собой практически сферическую молекулу с диаметром около 5,5 нм. Этот тетрамерный белок содержит четыре простетические гемовые группы, каждая из которых соединена с одной полипептидной цепью. Гемоглобин взрослого человека состоит из глобинов двух типов — двух α-цепей (каждая содержит 141 аминокислотный остаток) и двух β-цепей (по 146 аминокислотных остатков). Хотя аминокислотные последовательности α- и
β-субъединиц совпадают менее чем на 50%, трехмерные структуры этих двух типов субъединиц очень похожи. Более того, их конформация очень напоминает структуру миоглобина (рис. 5-6), несмотря на то что три полипептидные последовательности имеют идентичные аминокислотные остатки лить в 27 позициях (рис. 5-7). Все три полипептида относятся к семейству глобинов. Правила обозначения спиральных участков, описанные выше для миоглобина, применимы и к полипептидам гемоглобина, за исключением того, что его α-субъединица не имеет короткой спирали D. Гемсвязывающий карман сформирован в каждой субъединице главным образом спиралями Е и F.
Рис. 5-6. Сравнение структуры миоглобина (PDB ID 1МВO) и β-субъединицы гемоглобина (PDB ID 1HGA).
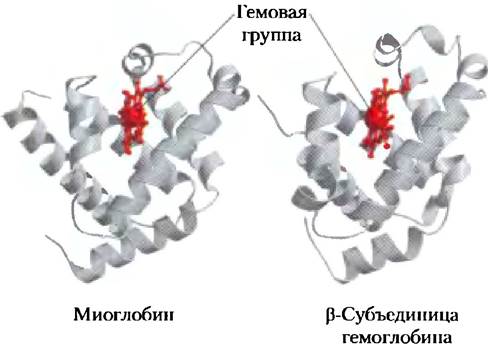
Рис. 5-7. Сравнение аминокислотных последовательностей миоглобина кита и α- и β-субъединиц гемоглобина человека. Пунктирными линиями помечены границы спиральных участков. Для оптимального выравнивания в обе последовательности Нb необходимо ввести короткие пробелы. За исключением отсутствующей спирали D в Нbа, все остальные спиральные участки можно именовать в соответствии с существующими договоренностями, что подчеркивает одинаковое расположение идентичных аминокислотных остатков во всех трех структурах (выделены цветом). Розовым цветом выделены аминокислотные остатки, которые идентичны во всех известных глобинах. Заметьте, что аминокислотные остатки с одинаковыми буквенно-численными обозначениями не обязательно находятся в одинаковых позициях в линейных полипептидных последовательностях. Например, дистальный остаток His во всех трех последовательностях называется His Е7, но в последовательностях Mb, Нb α и Нb β он представляет собой соответственно His64, His58 и His63. Не входящие в состав спиралей аминокислотные остатки, расположенные за пределами первого (А) и последнего (Н) α-спирального участка на N- и С-концах последовательности, соответственно обозначаются как NA и НС.

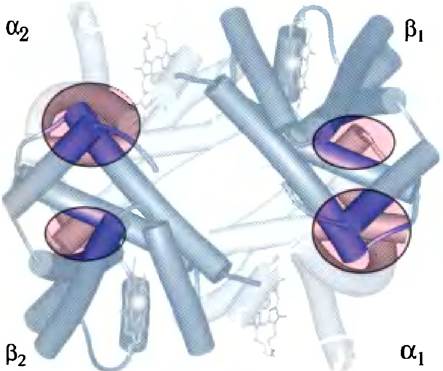
Четвертичная структура гемоглобина характеризуется сильным взаимодействием между субъединицами разных типов. В зоне контакта α1β1 (и аналогичным образом в зоне контакта α2β2) расположено более 30 аминокислотных остатков, и это обеспечивает настолько высокую прочность взаимодействия, что, хотя при обработке гемоглобина мочевиной в сравнительно мягких условиях тетрамер распадается на два ap-димера, далее эти димеры нс распадаются. В зоне контакта α1β2 (и α2β1) задействовано по 19достатков (рис. 5-8). В местах контактов преобладают гидрофобные взаимодействия, однако образуются также водородные связи и ионные пары (иногда называемые солевыми мостиками), значение которых мы обсудим далее.
Рис. 5-8. Основные взаимодействия между субъединицами гемоглобина. α-Субъединицы изображены более светлыми, β-субъединицы — более темными. Наиболее сильное взаимодействие (выделено) наблюдается между субъединицами разных типов. Связывание кислорода слабо влияет на контакт α1β1, однако в контакте α2β2 наблюдаются значительные изменения с разрывом нескольких ионных пар (РDВ ID 1HGА).
Связывание кислорода сопровождается структурными перестройками гемоглобина
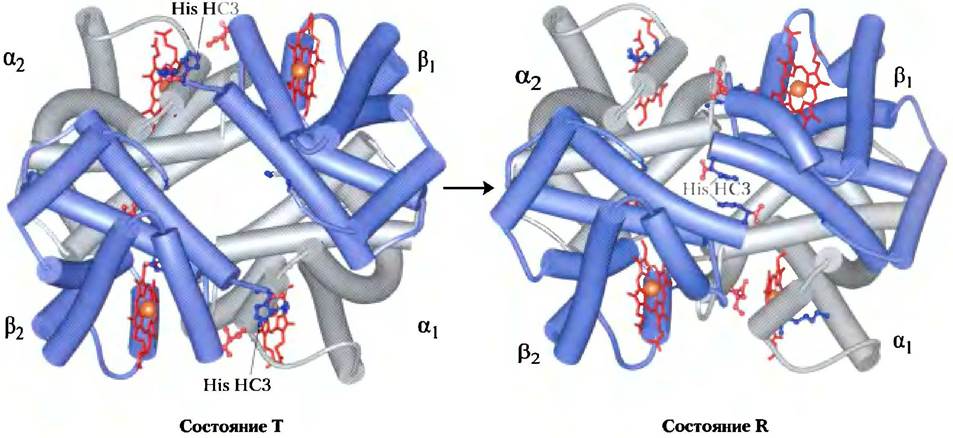
Методом рентгеноструктурного анализа было показано наличие двух основных конформаций гемоглобина, называемых R- и Т-состояниями. Кислород связывается с гемоглобином, находящимся в любом состоянии, но гораздо большее сродство он все же имеет к гемоглобину в состоянии R. Связывание с кислородом стабилизирует R-состояние.
Экспериментально показано, что в отсутствие кислорода более устойчивым является состояние Т и преобладает конформация дезоксигемоглобина. Буквы Т и R исходно обозначали соответственно напряженную (англ, tense) и релаксированную (англ. relaxed) конформацию, поскольку состояние Т стабилизировано большим количеством ионных пар, многие из которых расположены в зоне контакта α1β2 (и α2β1) (рис. 5-9). Связывание кислорода с субъединицей гемоглобина, находящейся в состоянии Т, приводит к конформационным изменениям и переходу в состояние R. В результате изменения конформации всего белка структура отдельных субъединиц изменяется слабо, однако пары αβ- субъединиц скользят одна по другой и поворачиваются, так что расстояние между β-субъединицами уменьшается (рис. 5-10). При этом разрушаются некоторые ионные пары, стабилизирующие состояние Т, и образуются новые.
Рис. 5-9. Некоторые ионные пары, стабилизирующие состояние Т дезоксигемоглобина. а) Крупный план фрагмента молекулы дезоксигемоглобина, находящейся в состоянии T (PDB ID 1HGA). Пунктирными линиями изображены ионные пары, образованные между His НСЗ и Asp FG1 из β-субъединицы (показана синим цветом), а также между Lys С5 из a-субъединицы (показана серым цветом) и α-карбоксильной группой His НСЗ из β-субъединицы. (Вспомните, что НСЗ — это С-концевой остаток β-субъединицы.) б) Взаимодействия между указанными, а также другими ионными парами схематически изображены на линейных полипептидных цепях субъединиц гемоглобина.
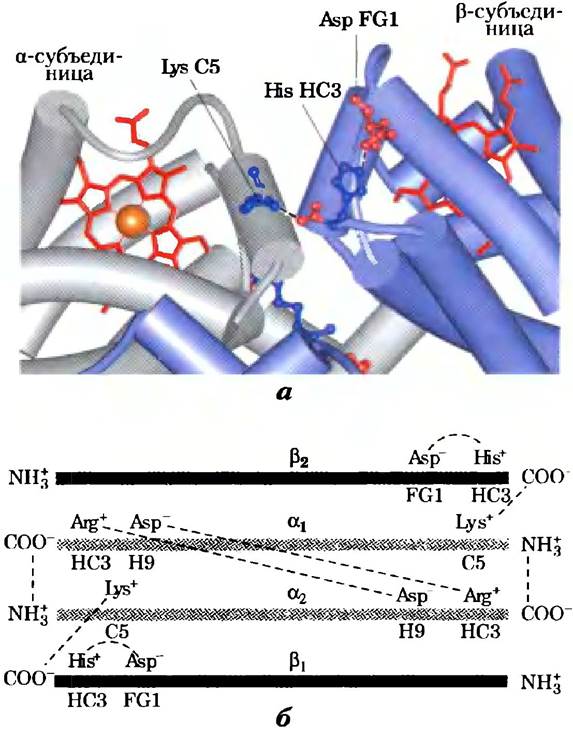
Рис. 5-10. Переход из состояния Т в состояние R (PDB ID 1HGA и 1ВВВ). β-Субъединкцы изображены синим цветом, α-субъединицы — серым, как и на рис. 5-9. Положительно заряженные боковые цепи и концевые остатки, участвующие в образовании ионных пар, выделены синим цветом, а их отрицательно заряженные партнеры выделены красным цветом. Изображены, но не подписаны остатки Lys С5 в каждой α-субъединице и остатки Asp FG1 в каждой β-субъединице (ср. рис. 5-9, а). Заметьте, что молекулы повернуты несколько иначе, чем на рис. 5-9. Переход из состояния Т в состояние R сильно смещает пары субъединиц, вызывая изменения в некоторых ионных парах. Особенно важно, что остаток His НСЗ на С-конце β-субъединицы, участвующий в образовании солевого мостика в состоянии Т, в состоянии R поворачивается к центру молекулы и не образует ионной пары. Еще одним важным результатом перехода T —> R является сужение кармана между β-субъединицами.
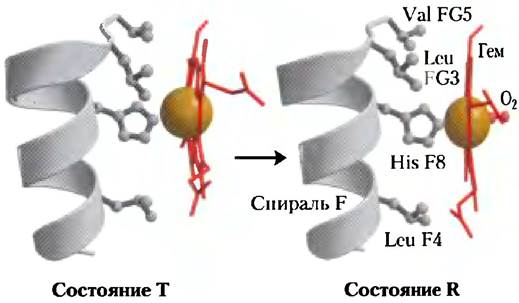
Макс Перутц предположил, что сигналом к осуществлению перехода Т -—> R является изменение положения боковых цепей ключевых аминокислотных остатков, окружающих гем. В состоянии Т порфириновое кольцо несколько сжато, так что гемовое железо чуть выдвинуто в сторону проксимального гистидина (His F8). При связывании кислорода гем принимает более плоскую конформацию, что заставляет сдвинуться проксимальный His и F-спираль (рис. 5-11). Эти сдвиги приводят к корректировке ионных пар в зоне контакта α1β2.
Рис. 5-11. Конформационные изменения в области гема при связывании кислорода с дезоксигемоглобином (РDВ ID 1HGА и 1ВВВ). Сдвиг спирали F при связывании гема с молекулой O2 считают одним из тех изменений в структуре молекулы, которые провоцируют переход Т —> R.
Связывание кислорода с гемоглобином — кооперативный процесс
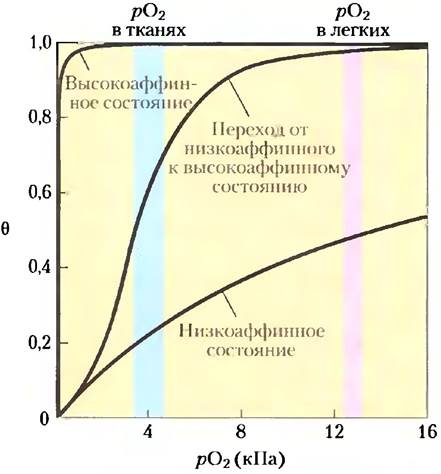
Гемоглобин должен эффективно связывать кислород в легких, где рO2 составляет приблизительно 13,3 кПа, и высвобождать его в тканях, где рO2 примерно равно 4 кПа. Миоглобин или любой другой белок, характеризующийся гиперболической кривой связывания с кислородом, не подходит для выполнения этой задачи по причинам, показанным на рис. 5-12. Белок, обладающий высоким сродством к кислороду, будет эффективно связывать его в легких, но не будет высвобождать в тканях в достаточном количестве. Если белок имеет сравнительно низкое сродство к кислороду, позволяющее высвобождать его в тканях, он нс сможет связывать достаточное количество кислорода в легких.
В случае гемоглобина эта проблема решается путем перехода из низкоаффинного состояния (состояния Т) в высокоаффинное (состояние R) по мере связывания молекул O2. В результате кривая связывания гемоглобина с кислородом имеет S-образный (сигмовидный) характер (рис. 5-12). Белок, состоящий из одной субъединицы с одним центром связывания лиганда, не может иметь S-образную кривую связывания, даже при условии, что это связывание сопровождается конформационными изменениями, поскольку каждая молекула лиганда связывается независимо и нс может влиять на взаимодействие с другими молекулами. Напротив, присоединение O к одной субъединице гемоглобина изменяет сродство к кислороду других субъединиц. Первая молекула O2, взаимодействующая с дезоксигемоглобином, связывается слабо, поскольку субъединица находится в состоянии Т. Но это взаимодействие приводит к конформационным изменениям, затрагивающим соседние субъединицы, в результате чего облегчается присоединение следующих молекул O2. Действительно, переход Т —> R во второй субъединице осуществляется быстрее, если в первой субъединице произошло связывание O2. Последняя (четвертая) молекула кислорода связывается с гемом в субъединице, уже находящейся в состоянии R, и поэтому сродство гемоглобина к четвертой молекуле кислорода гораздо выше, чем к первой.
Рис. 5-12. Сигмовидная кривая, отражающая кооперативность связывания. Сигмовидную (S-образную) кривую можно рассматривать как гибридную кривую, отражающую переход от низкоаффинного к высокоаффинному состоянию. Сигмовидная кривая свидетельствует о том, что кооперативное связывание делает гемоглобин более чувствительным к небольшим изменениям концентрации O2 между тканями и легкими. В результате становится возможным связывание кислорода в легких (где парциальное давление кислорода высокое) и его высвобождение в тканях (где рО2 низкое).
Белок, в котором связывание лиганда в одном центре молекулы влияет на связывание в другом центре, называется аллостерическим белком. Термин «аллостерический» происходит от греческих слов alios («другой») и stereos («твердый» или «форма»). Таким образом, аллостерическими называют белки, принимающие «другую форму» или конформацию при связывании лигандов (модуляторов). Конформационные изменения, индуцированные модулятором (или модуляторами), представляют собой переходы между менее активной и более активной формами белка. Модуляторы аллостерических белков могут быть ингибиторами или активаторами. Если роль лиганда и модулятора выполняет одно и то же вещество, такое взаимодействие называют гомотропным, в противном случае взаимодействие называют гетеротропным. Некоторые белки имеют два или несколько модуляторов и, следовательно, могут участвовать как в гомотропных, так и в гетеротропных взаимодействиях.
Кооперативное связывание лиганда с мультимерным белком, подобное тому, какое мы наблюдали в случае взаимодействия гемоглобина
с кислородом, является формой аллостерического взаимодействия, которое часто происходит в мультимерных белках. Связывание одного лиганда изменяет сродство остальных центров связывания, так что кислород в данном случае выступает и в качестве лиганда, и в качестве активирующего гомотропного модулятора. На каждой субъединице есть только один центр связывания О2, и аллостерические эффекты, приводящие к кооперативному связыванию, опосредованы кон-
формационными изменениями, передаваемыми от одной субъединицы к другой в результате их взаимодействий. Сигмовидная кривая связывания свидетельствует о кооперативности взаимодействия. Такой тип связывания гораздо более чувствителен к концентрации лиганда и используется во многих мультисубъединичных белках. Принципы аллостерического взаимодействия применимы также и к регуляторным ферментам, как мы увидим далее в гл. 6.
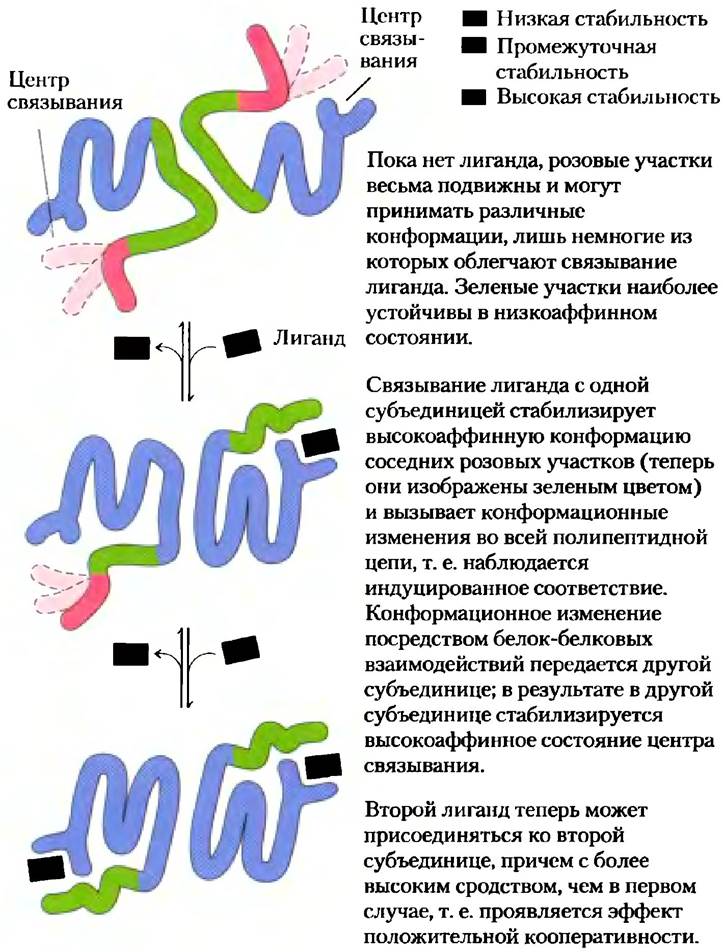
Кооперативные конформационные изменения зависят от различий в структурной стабильности отдельных частей белка, обсуждавшихся в гл. 4. Центр связывания аллостерического белка обычно построен из устойчивых фрагментов, поблизости от которых расположены сравнительно лабильные участки, способные часто менять свою конформацию или находящиеся в беспорядочном перемещении (рис. 5-13). При связывании лиганда подвижные части центра связывания стабилизируются в определенной конформации, что вызывает изменение конформации прилежащих участков полипептидной цепи. Если бы весь центр связывания имел жестко зафиксированную структуру, то при связывании лиганда лишь небольшие структурные изменения могли бы возникать в нем самом и распространяться на другие участки белка.
Рис. 5-13. Структурные перестройки в мультисубъединичном белке в процессе кооперативного связывания лиганда. Структурная стабильность белковой молекулы в разных участках может быть различной. На данной схеме представлен гипотетический димерный белок, имеющий участки высокой (синий цвет), промежуточной (зеленый цвет) и низкой стабильности (розовый цвет). Центр связывания лиганда построен из участков как с высокой, так и с низкой стабильностью, так что сродство белка к лиганду сравнительно небольшое. Конформационные изменения, происходящие при связывании лиганда, переводят белок из низкоаффинного в высокоаффинное состояние — вариант индуцированного соответствия.
Подобно миоглобину, гемоглобин может связывать не только кислород, но и другие лиганды. Важным примером является связывание монооксида углерода (угарного газа), который связывается с гемоглобином примерно в 250 раз лучше, чем кислород. Вдыхание СО может вызвать очень тяжелые последствия для здоровья человека (доп. 5-1).
Кооперативное связывание лиганда можно описать количественно
Кооперативное связывание кислорода с гемоглобином впервые было проанализировано Арчибальдом Хиллом в 1910 г. Именно на этой работе основан общий подход к изучению кооперативного взаимодействия лигандов с мультисубъединичными белками.
Для белка, имеющего n центров связывания, уравнение 5-1 можно привести к виду
Р + nL ⇄ РLn (5-12)
а выражение для константы ассоциации можно записать следующим образом:
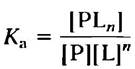 (5-13)
(5-13)
Аналогично уравнению 5-8 запишем выражение для θ
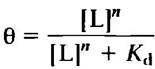 (5-14)
(5-14)
Произведем перестановку и возьмем логарифм обеих частей уравнения:
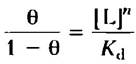 (5-15)
(5-15)
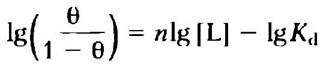 (5-16)
(5-16)
где Кd = [L]n 0,5.
Выражение 5-16 называют уравнением Хилла, а график в координатах lg [θ/(1 — θ)] от lg[L] называют графиком Хилла. В соответствии с уравнением угол наклона графика Хилла должен быть равен п. Но угол наклона, определенный на основании экспериментальных данных, на самом деле отражает не число центров связывания, а степень взаимодействия между ними. Поэтому угол наклона графика Хилла, названный коэффициентом Хилла (nH), является мерой кооперативности. Если коэффициент Хилла равен единице, связывание лиганда не кооперативное, что возможно даже в мультисубъединичном белке, если его субъединицы не взаимодействуют друг с другом. Значение nH>1 указывает на наличие положительной кооперативности при связывании лиганда. Именно такая ситуация наблюдается в случае гемоглобина, когда связывание одной молекулы лиганда способствует связыванию других молекул. Теоретический верхний предел значения nH равен n. В подобном случае взаимодействие полностью кооперативное: все центры связывания на молекуле белка должны связывать лиганд одновременно, и не должно существовать частично насыщенных лигандом молекул белка. На практике этот предел никогда не достигается; измеряемое значение nH всегда меньше реального числа центров связывания лиганда в белке.
Значение nH <1 говорит об отрицательной кооперативности, т. е. о явлении, при котором связывание одной молекулы лиганда препятствует связыванию остальных. Детально описанных случаев отрицательной кооперативности известно мало.
Для того чтобы применить уравнение Хилла к связыванию кислорода с гемоглобином, нам следует заменить [L] на рO2 и Кd на Pn50:
![]() (5-13)
(5-13)
Дополнение 5-1. МЕДИЦИНА. Угарный газ: невидимый убийца
Озеро Пауэлл, Аризона, США, август 2000 г. Семья проводила каникулы на арендованной плавучей барже. Они включили электрический генератор, поскольку пользовались кондиционером и смотрели телевизор. Примерно через четверть часа два брата в возрасте 8 и 11 лет спрыгнули в воду с кормовой палубы. Прямо под ней находилась вытяжка генератора. Всего за две минуты оба мальчика надышались угарным газом, накопившимся в пространстве под палубой, и утонули. Этот случай, а также многие другие, произошедшие в 1990-е гг. на плавучих баржах подобной конструкции, привели к тому, что эти суда были отозваны для реконструкции вытяжки генераторов.
Монооксид углерода (СО, угарный газ) — газ без цвета и запаха; во всем мире ежегодно более половины умерших от отравления погибли от действия угарного газа. Сродство СО к гемоглобину примерно в 250 раз превышает сродство кислорода. В результате сравнительно невысокий уровень СО в воздухе может привести к трагическим последствиям. Комплекс, образующийся при связывании СО с гемоглобином, называют карбоксигемоглобином (СОНb).
Некоторое количество СО образуется в результате естественных процессов, однако локальное высокое содержание этого газа в воздухе, как правило, является результатом деятельности человека. Очень большой вклад в повышение уровня СО вносят выхлопные газы и газообразные отходы производств, поскольку СО — побочный продукт неполного сгорания ископаемого топлива. Только в США ежегодно около 4000 человек становятся жертвой отравления СО (как случайно, так и преднамеренно). Многие несчастные случаи связаны с накоплением СО в замкнутых пространствах, например, в домах при неаккуратном протапливании печи. Однако отравиться СО можно и на открытом воздухе, вдыхая выхлопы генераторов, лодочных моторов, тракторов, различных транспортных средств или газонокосилок.
Концентрация СО в атмосфере редко достигает опасного уровня: обычно она колеблется от 0,05 ppm (частей на миллион) в отдаленных и малонаселенных районах до 3-4 ppmв некоторых городах северного полушария. По нормам, принятым в США, количество поглощенного человеком за восьмичасовой рабочий день СО не должно превышать 50 ppm. Высокое сродство СО к гемоглобину означает, что СОНb может накапливаться в организме человека, постоянно находящегося вблизи источника СО, пусть даже с низким уровнем содержания этого газа.
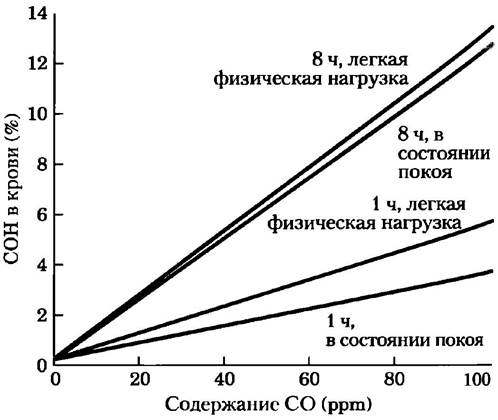
В среднем у здорового человека до 1% общего гемоглобина крови связано в комплексе СОНb. Поскольку СО содержится в табачном дыме, у многих курильщиков уровень связанного в виде СОНЬ гемоглобина составляет 3-8%, а у заядлых курильщиков может достигать 15%. У людей, которые на протяжении нескольких часов дышат воздухом с содержанием 570 ppm СО, уровень СОНb достигает 50%. Были разработаны точные методы, позволяющие определять уровень СОНb в крови на основании содержания СО в атмосфере (рис. 1). На плавучих баржах, имеющих генератор с таким выхлопным устройством, как то, что послужило причиной смерти мальчиков на озере Пауэлл, уровень СО под кормовой палубой достигал 6-30 тыс. ppm, а уровень кислорода там снижен с 21 до 12%. Даже на кормовой палубе концентрация СО составляла около 7200 ppm; этого вполне достаточно, чтобы вызвать смерть за считанные минуты.
Рис. 1. Соотношение между уровнем СОНb в крови и концентрацией СО в воздухе. Эксперименты проводили в четырех типах условий, причем сравнивали результаты краткого и длительного воздействия СО, а также воздействие СО на человека в состоянии покоя и при физической нагрузке.
Как влияет СОНb на состояние человека? Если в комплексе связано менее 10% всего гемоглобина, то симптомы практически не наблюдаются. При уровне 15% у некоторых людей начинаются головные боли, а при 20-30% эти боли становятся очень сильными и обычно сопровождаются тошнотой, головокружением, нарушением ориентации и зрения. Подобные симптомы обычно исчезают, если пациенту дают дышать кислородом. При уровне СОНb от 30 до 50% неврологические проявления становятся более тяжелыми, а при 50% СОНb человек теряет сознание и может впасть в кому; возможна остановка дыхания. Если человек подвергался воздействию СО длительное время, то некоторые нарушения могут стать необратимыми. Смерть обычно наступает при уровне СОНЬ выше 60%. Вскрытие тел мальчиков, погибших на озере Пауэлл, показало, что уровень СОНb у них составлял 59 и 52%.
На связывание СО с гемоглобином оказывают влияние несколько факторов, в том числе физическая нагрузка (рис. 1) и изменение давления воздуха на разной высоте над уровнем моря. Из-за высокого базового уровня СОНb в крови курильщики часто ощущают симптомы от воздействия СО быстрее, чем некурящие. Люди сзаболеваниями сердца, легких и крови, при которых снижается доступ кислорода к тканям, также могут ощущать симптомы отравления при более низком уровне СО, чем здоровые люди. Особенно высокому риску при повышении уровня СО подвергается плод в утробе матери, поскольку гемоглобин плода имеет еще более высокое сродство к СО, чем гемоглобин взрослого. Известны случаи отравления угарным газом беременных женщин, когда плод погибал, а мать оставалась жива.
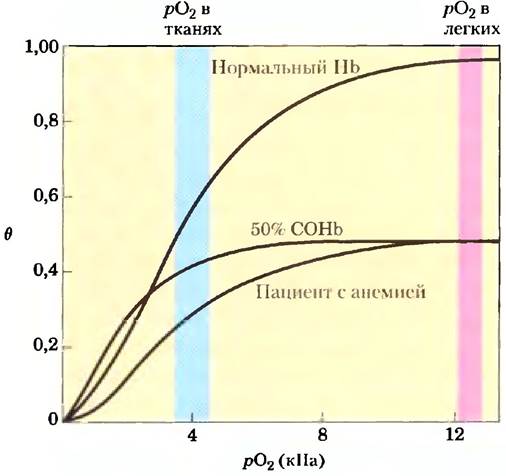
Может показаться странным, что связывание половины гемоглобина в комплексе СОНЬ приводит к гибели, в то время как люди с тяжелой анемией, при которой уровень Нbснижен вдвое, живут практически нормально. Дело заключается в том, что связывание СО не только удаляет часть гемоглобина, способного переносить кислород, но и воздействует на сродство к кислороду свободных субъединиц гемоглобина. При связывании СО с одной или двумя субъединицами тетрамера гемоглобина сродство к O2 у остальных субъединиц повышается (рис. 2). Такой гемоглобин может эффективно связывать кислород в легких, но очень неохотно высвобождает его в тканях. Недостаток кислорода в тканях быстро приводит к тяжелым последствиям. Кроме того, воздействие не ограничивается только связыванием гемоглобина; СО взаимодействует с другими гемовыми белками и многими металлопротеинами. Все детали этих взаимодействий еще не выяснены, однако считается, что именно здесь кроется причина некоторых долгосрочных проявлений острого, но не смертельного отравления СО.
Рис. 2. Кривые связывания кислорода для нормального гемоглобина, гемоглобина пациента с анемией, у которого функционирует лишь 50% гемоглобина, а также гемоглобина пациента, у которого 50% субъединиц гемоглобина образуют комплексы с СО. Указаны значения рO2 в легких и тканях человека.
При подозрении на отравление угарным газом необходимо как можно быстрее удалить пострадавшего от источника СО, однако это не всегда приводит к быстрой нормализации состояния. При перемещении пострадавшего в нормальную атмосферу кислород начинает вытеснять СО из комплекса с гемоглобином. Но содержание СОНb снижается довольно медленно; время полувыведения СО составляет от 2 до 6,5 ч в зависимости от индивида и факторов окружающей среды. Если пациенту через маску вводят чистый кислород, то скорость выведения СО увеличивается приблизительно в четыре раза. Если подавать чистый кислород под давлением 3 атм (303 кПа), то время замены СО на O2сокращается до нескольких десятков минут. Таким образом, при отравлении СО необходима быстрая и специализированная медицинская помощь.
В предотвращении отравлений могут быть полезны домашние детекторы СО. Это простой и недорогой способ защиты от возможной трагедии. После подготовки материала для данного дополнения мы сами незамедлительно приобрели несколько новых детекторов СО для своих квартир.
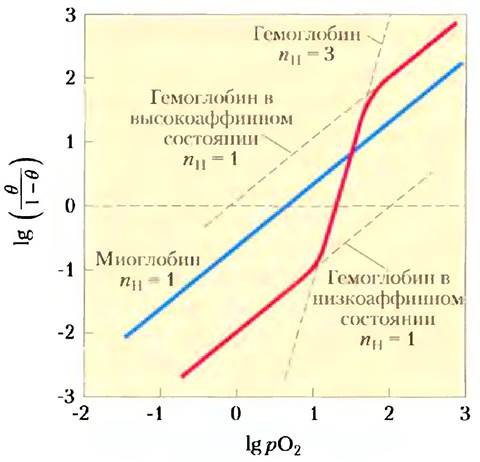
Графики Хилла для миоглобина и гемоглобина представлены на рис. 5-14.
Рис. 5-14. Графики Хилла для связывания кислорода с миоглобином и гемоглобином. В случае nH = 1 неоперативность не наблюдается. В случае гемоглобина максимальная степень кооперативности nH = 3. Хотя это значение указывает на высокую степень кооперативности, оно все же ниже числа центров связывания кислорода в молекуле гемоглобина. Это обычная ситуация для белков с аллостерическим механизмом действия.
Две модели кооперативного связывания
Биохимикам уже многое известно относительно Т- и R-состояний гемоглобина, однако механизм перехода Т —> R ясен не до конца. Большой вклад в решение этой проблемы внесли две модели, описывающие кооперативное связывание лигандов с белками, имеющими несколько центров связывания.
Первая модель была предложена Жаком Моно, Джеффри Уайменом и Жаном-Пьером Шанже в 1965 г. и называется моделью Моно- Уаймена-Шанже или симметричной моделью (рис. 5-15, а). В данной модели предполагается, что субъединицы белка, участвующего в кооперативном взаимодействии с лигандом, функционально идентичны, что каждая субъединица может существовать, по крайней мере, в двух конформациях, и что все субъединицы одновременно переходят из одной конформации в другую. В рамках данной модели не допускается, что белок может иметь субъединицы, находящиеся в разных конформациях. Две конформации находятся между собой в равновесии. Лиганд способен связываться с любой конформацией, но с разным сродством. Последовательное связывание молекул лиганда с белком в низкоаффинной конформации (которая наиболее устойчива в случае отсутствия лиганда) повышает вероятность перехода в высокоаффинное состояние.
Рис. 5-15. Две основные модели, объясняющие взаимные превращения активной и неактивной форм белков при кооперативном связывании лигандов. В принципе, эти модели применимы к любым белкам (в том числе и ферментам, см. гл. 6), способным к кооперативному связыванию лигандов; в данном случае изображены белки, состоящие из четырех субъединиц, поскольку изначально модели были предложены для гемоглобина, а) В симметричной модели (иначе называемой моделью «все или ничего» или моделью Моно-Уаймена-Шанже) предполагается, что все субъединицы одновременно находятся в одинаковой конформации — либо неактивной и с низким сродством (О), либо в активной с высоким сродством к лиганду (□). В зависимости от константы равновесия между этими формами (К1) связывание одной или большего числа молекул лиганда (L) будет сдвигать равновесие в сторону активной формы. Субъединицы, связавшие лиганд, выделены цветом. б) В последовательной модели (модели индуцированного соответствия) каждая субъединица независимо от остальных может находиться либо в активной, либо в неактивной форме. В результате возможно существование большого числа конформационных состояний белка.
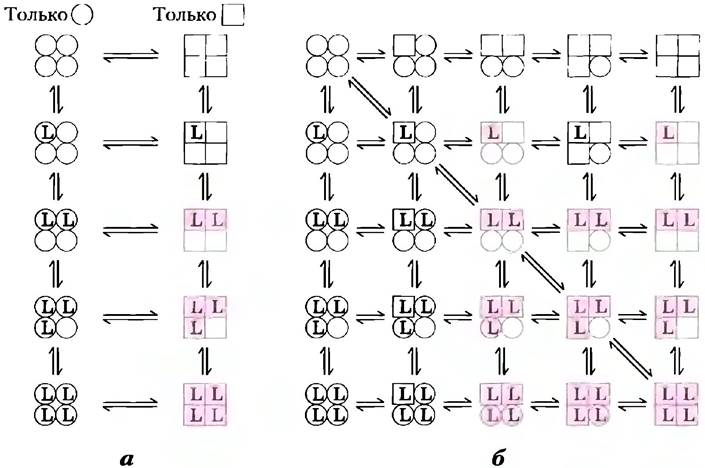
В соответствии со второй моделью, называемой последовательной моделью, предложенной Даниэлем Кошландом с коллегами в 1966 г., связывание лиганда может индуцировать конформационные изменения в отдельной субъединице. Конформационные изменения в одной субъединице приводят к аналогичным изменениям в соседней, а также повышают вероятность связывания второй молекулы лиганда. Данная модель допускает существование большего числа промежуточных состояний, чем симметричная модель. Две описанные модели не являются взаимоисключающими. Симметричная модель (которую иногда называют моделью «все или ничего») может рассматриваться как частный случай последовательной модели. В гл. 6 мы будем пользоваться этими моделями для описания поведения аллостерических ферментов.
Гемоглобин переносит Н+ и СO2
Гемоглобин не только переносит от легких к тканям практически весь кислород, необходимый клеткам, но он также переносит образующиеся при дыхании клеток Н+ и СO2 от тканей в легкие и почки, где они выводятся из организма. Газообразный СO2, образующийся при окислении органических молекул в митохондриях, вступает в реакцию с водой и образует бикарбонат:
СO2 + Н2O ⇄ Н+ + НСO3
Данную реакцию катализирует карбоангидраза, которой особенно много в эритроцитах. Диоксид углерода не очень хорошо растворяется воде, и если бы он не превращался в бикарбонат, то образовывал бы пузырьки в крови и тканях. Как видно из уравнения реакции, гидратации СО2 приводит к повышению концентрации (снижению pH) в тканях. Связывание кислорода с гемоглобином очень сильно зависит от pH и концентрации СО2, так что взаимные превращения СО2 и бикарбоната играют важнейшую роль в регуляции связывания и высвобождения кислорода в крови.
Гемоглобин переносит около 40% Н+ и 15-20% СО2, образующихся в тканях, к легким и почкам (остаток Н+ поглощается бикарбонатным буфером плазмы крови, а остаток СО2переносится в виде растворенных НСО3- и СО2). Связывание Н+ и СО2 обратно пропорционально связыванию кислорода. При относительно низком значении pH и высокой концентрации СО2 в периферических тканях сродство гемоглобина к кислороду снижается по мере связывания Н+ и СО2, и кислород высвобождается. И наоборот, в капиллярах легких по мере выделения СО2 и повышения pH крови сродство гемоглобина к кислороду возрастает, и белок может связывать большее количество О2 для доставки к периферическим тканям. Это влияние pH и концентрации СО2 на связывание и высвобождение кислорода гемоглобином называют эффектом Бора по имени датского физиолога Кристиана Бора (отца физика Нильса Бора), открывшего этот эффект в 1904 г.
Равновесная реакция связывания гемоглобина с одной молекулой кислорода выглядит следующим образом;
Нb + O2 ⇄ НbO2
Однако это уравнение неполное. Чтобы учесть влияние концентрации Н+, перепишем его в следующем виде:
ННb + O2 ⇄ НbO2 + Н+
где HHb+ — это протонированная форма гемоглобина. Из данного уравнения следует, что кривая насыщения гемоглобина кислородом зависит от концентрации Н+ (рис. 5-16). Гемоглобин связывает как O2, так и H+, но с обратным сродством: при высокой концентрации кислорода (в легких) гемоглобин связывает кислород и высвобождает протон, а при низкой концентрации кислорода (в периферических тканях) гемоглобин связывает протон и высвобождает O2.
Рис. 5-16. Влияние pH на связывание кислорода с гемоглобином. Значение pH крови в легких составляет 7,6, а в тканях — 7,2. Эксперименты по связыванию кислорода с гемоглобином часто проводят при pH 7,4.
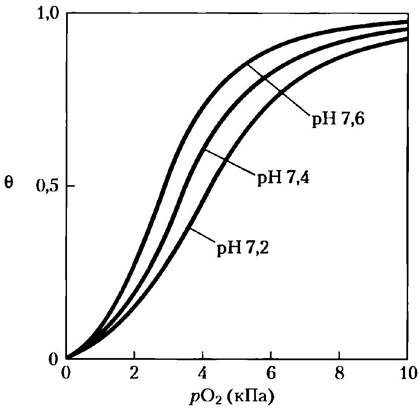
Кислород и Н+ связываются в разных участках молекулы гемоглобина. Кислород связывается с атомом железа в геме, а H+ — с одним из нескольких аминокислотных остатков белка. Основной вклад в эффект Бора вносит His146 (His НСЗ) β-субъединицы. В протонированном состоянии этот остаток образует ионную пару с Asp94 (Asp FG1), что способствует стабилизации дезоксигемоглобина в состоянии Т (рис. 5-9). Образование ионной пары стабилизирует протонированную форму His НСЗ, что отражается на аномально высоком значении рКa этой группы в состоянии Т. При переходе в состояние R рКa этого остатка гистидина возвращается к нормальному значению 6,0, поскольку ионная пара распадается; в оксигемоглобине при pH 7.6 (нормальное значение pH крови в легких) этот остаток в основном находится в депротонированной форме. По мере повышения концентрации Н+ происходит протонирование His НСЗ, способствующее высвобождению кислорода и переходу в состояние Т. Аналогичный эффект оказывает протонирование N-концевых остатков α-субъединиц некоторых других остатков His и, возможно, каких-то других групп.
Таким образом, четыре полипептидные цени гемоглобина взаимодействуют друг с другом не только при связывании кислорода в гемовых группах, но и при связывании протона со специфическими аминокислотными остатками. И это еще не все. Гемоглобин связывает также СО2, причем опять-таки этот процесс находится в обратной зависимости от связывания кислорода. Углекислый газ связывается с концевой α-аминогруппой каждой из четырех глобиновых цепей, в результате чего образуется карбаминогемоглобин:
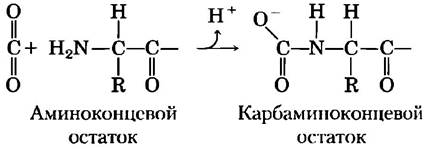
В результате данной реакции выделяется ГГ, который вносит свой вклад в эффект Бора. Карбаматные группы также участвуют в образовании солевых мостиков (нс показаны на рис. 5-9), что способствует стабилизации состояния Т и высвобождению кислорода.
При высокой концентрации углекислого газа (в периферических тканях) часть СО2 связывается с гемоглобином, и сродство гемоглобина к кислороду снижается, что приводит к высвобождению О2. И наоборот, при связывании гемоглобина с кислородом в легких происходит высвобождение СО2. Именно благодаря способности молекулы гемоглобина передавать информацию о связывании лиганда от одной субъединицы к другой этот белок оказывается великолепно приспособленным для переноса эритроцитами О2, СО2 и Н-.
Связывание кислорода с гемоглобином регулируется 2,3-бисфосфоглицератом
Взаимодействие 2,3-бисфосфоглицерата (БФГ) с гемоглобином является примером гетеротропной аллостерической регуляции.
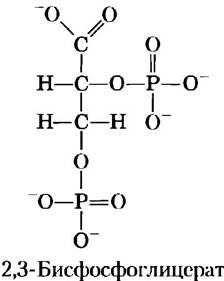
БФГ в довольно высокой концентрации содержится в эритроцитах. Выделяемый гемоглобин обычно содержит связанный БФГ, который бывает трудно удалить полностью. На самом деле, кривые связывания О2 с гемоглобином, которые мы рассматривали до сих пор, были получены в присутствии связанного БФГ. Известно, что БФГ значительно снижает сродство гемоглобина к кислороду; существует обратная зависимость между связыванием БФГ и связыванием О2. Следовательно, можно записать уравнение еще одной реакции связывания гемоглобина с лигандом;
Нb-БФГ + O2 ⇄ НbO2 + БФГ
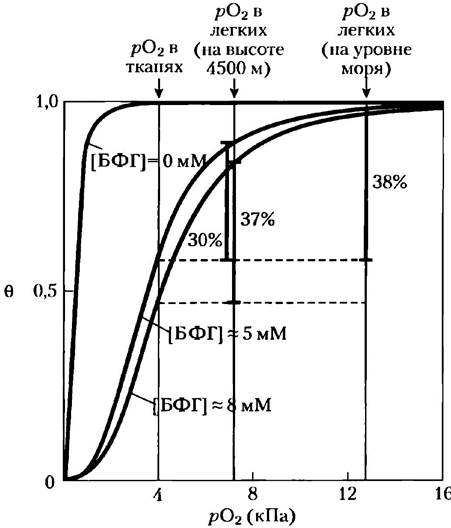
БФГ связывается с молекулой гемоглобина на некотором расстоянии от центра связывания кислорода и регулирует сродство гемоглобина к O2 в зависимости от парциального давления кислорода в легких. БФГ играет важную физиологическую роль при адаптации человека к пониженному уровню рO2 на больших высотах. У здорового человека, проведшего какое-то время на берегу океана, связывание кислорода с гемоглобином отрегулировано таким образом, что доставляемое к тканям количество O2 соответствует ~ 40% от максимального количества, которое способна переносить кровь (рис. 5-17). Представьте себе, что этот человек в короткий срок попадает в горы на высоту 4500 метров над уровнем моря, где рO2 сравнительно низкое. Доставка кислорода к тканям в такой ситуации снижается. Однако спустя всего несколько часов концентрация БФГ в крови начинает повышаться, что приводит к снижению сродства гемоглобина к кислороду. Коррекция уровня БФГ в крови оказывает небольшой эффект на связывание O2 в легких, но весьма значительный — на его высвобождение в тканях. В результате доставка кислорода к тканям восстанавливается на нормальном уровне — около 40% от максимально возможного количества переносимого кровью кислорода. При возвращении человека с гор наблюдается обратная ситуация. Кроме того, концентрация БФГ в эритроцитах повышена у людей, страдающих от гипоксии; это патологическое состояние возникает вследствие недостаточного снабжения периферических тканей кислородом из-за нарушения работы легких или системы кровообращения.
Рис. 5-17. Влияние БФГ на связывание кислорода с гемоглобином. В норме концентрация БФГ в крови человека составляет 5 мМ на уровне моря и 8 мМ на больших высотах. Заметьте, что гемоглобин лучше связывает кислород при полном отсутствии БФГ; кривая связывания при этом имеет вид гиперболы. В действительности измеряемый коэффициент Хилла для кооперативного связывания O2 при удалении БФГ снижается слабо (от 3 до 2,5), но ход кривых в присутствии БФГ и без него значительно различается. У человека, находящегося на уровне моря, гемоглобин в легких почти насыщен кислородом, а в тканях насыщен примерно на 60%, так что количество оставляемого в тканях кислорода соответствует 40% от максимального количества, которое может переносить кровь. На больших высотах доставка кислорода к тканям снижается примерно на четверть и составляет 30% от максимума. Однако повышение концентрации БФГ снижает сродство гемоглобина к кислороду, так что в тканях вновь остается около 40% переносимого кровью кислорода.
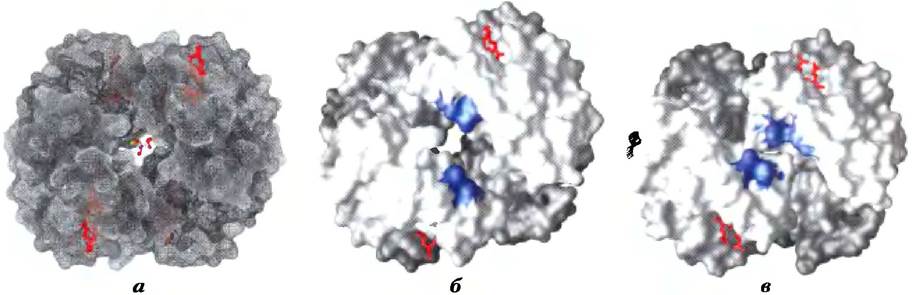
Центр связывания БФГ расположен в полости между β-субъединицами гемоглобина в состоянии Т (рис. 5-18). Эта полость выстлана положительно заряженными группами аминокислотных остатков, которые могут взаимодействовать с отрицательнозаряженными группами БФГ. Каждый тетрамер гемоглобина может связывать лишь одну молекулу БФГ. При связывании с гемоглобином БФГ стабилизирует состояние Т и тем самым снижает сродство гемоглобина к кислороду. Переход в состояние R сужает полость, в которой связывается БФГ, и мешает связыванию. В отсутствие БФГ гемоглобин легче переходит в состояние R.
Рис. 5-18. Связывание БФГ с дезоксигемоглобином. а) Связывание БФГ стабилизирует состояние Т дезоксигемоглобина, поверхность которого изображена здесь в виде сетки (РDВ ID 1НGА). б) Отрицательно заряженные группы БФГ взаимодействуют с положительно заряженными группами (на данном сплошном изображении поверхности выделены синим цветом), окружающими полость между β-субъединицами в состоянии Т. в) При присоединении кислорода к гемоглобину и переходе в состояние R (РDВ ID 1ВВВ) полость для связывания БФГ исчезает (сравните б) и в) с рис. 5-10).
БФГ играет важную роль в регуляции связывания кислорода с гемоглобином при развитии плода. Плод должен экстрагировать кислород из крови матери, поэтому гемоглобин плода должен иметь более высокое сродство к кислороду, чем гемоглобин матери. Гемоглобин плода содержит не β-, а y-субъединицы, и представляет собой тетрамер состава α2y2. Этот тетрамер гораздо слабее связывает БФГ, чем гемоглобин взрослого, и, следовательно, имеет более высокое сродство к кислороду. Кислородсвязывающие белки — аллостерическая регуляция гемоглобина
Серповидноклеточная анемия — «молекулярная болезнь» гемоглобина
Определяющую роль аминокислотном последовательности для формирования вторичной, третичной и четвертичной структур глобулярного белка можно продемонстрировать на примере серповидноклеточной анемии — наследственного заболевания человека. В человеческой популяции существует около 500 вариантов гемоглобина, большинство из которых встречаются довольно редко. Многие варианты различаются лишь одной аминокислотой. Обычно такие замены почти не влияют на структуру и функции гемоглобина, однако некоторые из них приводят к серьезным последствиям. Каждый вариант молекулы гемоглобина является продуктом измененного гена. Такие вариантные формы генов называют аллелями. Поскольку обычно существует две копии каждого гена, каждый конкретный человек может иметь две копии одного аллеля (быть гомозиготным по данному гену) или по одной копии двух различных аллелей (быть гетерозиготным по данному гену).
Серповидноклеточная анемия проявляется, когда человек унаследовал аллель аномального гемоглобина от обоих родителей. В крови таких больных гораздо меньше эритроцитов, и они имеют неправильную форму. Обращает на себя внимание не только большое количество незрелых клеток, но и наличие длинных, тонких эритроцитов, имеющих форму полумесяца или серпа (рис. 5-19). При дезоксигенации гемоглобин из серповидных клеток — гемоглобин S — становится нерастворимым и образует пучки трубчатых волокон (рис. 5-20), а нормальный гемоглобин (гемоглобин А) при дезоксигенации остается растворимым. Именно нерастворимые волокна дезоксигемоглобина S определяют неправильную форму эритроцитов, причем число серповидных эритроцитов в крови возрастает при высвобождении кислорода.
Рис. 5-19. а) Нормальные эритроциты, имеющие двояковогнутую форму, б) Эритроциты различной формы, в том числе шиповидные и серповидные, в крови больных серповидноклеточной анемией.
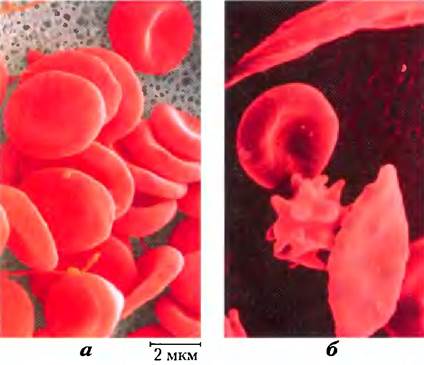
Рис. 5-20. Нормальный и серповидный гемоглобин. а) Различие между конформацией гемоглобина А и гемоглобина S вызвано заменой единственной аминокислоты в двух β-цепях. б) В результате данной замены гемоглобин S имеет на поверхности небольшой гидрофобный участок, способствующий слипанию молекул и образованию нерастворимых нитевидных волокон.
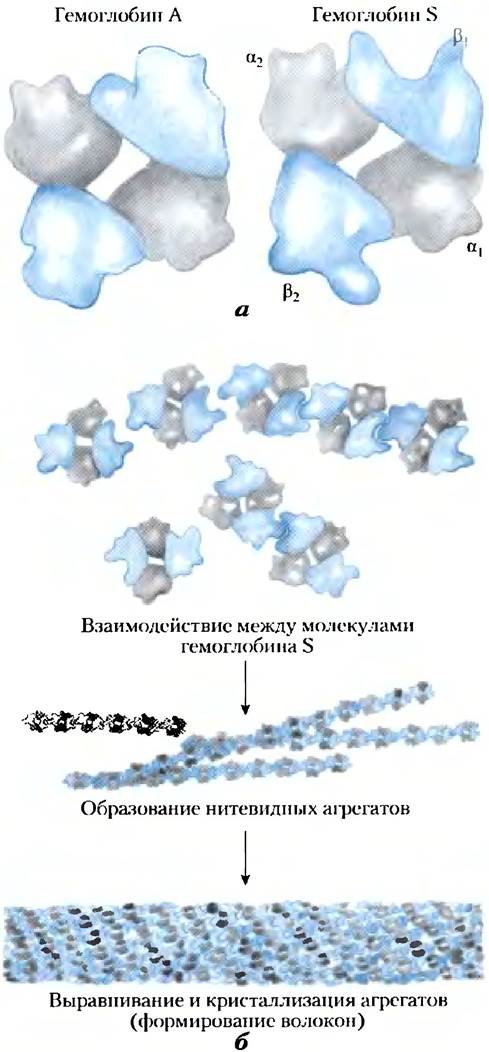
Аномальные свойства гемоглобина S объясняются заменой всего одной аминокислоты — остаток Glu в положении 6 в двух β-цепях замещается остатком Val. В остатке валина R-группа не несет электрического заряда, тогда как глутаминовая кислота при pH 7,4 имеет отрицательный заряд. В результате у гемоглобина S на две отрицательно заряженные группы меньше, чем у нормального гемоглобина А — по одной в каждой β-цепи. Замена остатка Glu на Val приводит к образованию «липкого» гидрофобного контакта в шестом положении β-цепи, расположенном на внешней поверхности молекулы. В итоге молекулы дезоксигемоглобина S слипаются и образуют аномально длинные нитевидные агрегаты, характерные для данного заболевания. Кислородсвязывакнцие белки — дефект Нb приводит к серьезным генетическим заболеваниям.
Как уже было сказано, серповидноклеточная анемия проявляется у людей, гомозиготных по аномальному аллелю, кодирующему β-субъединицы гемоглобина. У гетерозиготных людей, получивших аномальный аллель только от одного родителя, проявляется менее тяжелое состояние, называемое серповидноклеточным признаком. При данном состоянии менее 1% эритроцитов при дезоксигенации приобретают серповидную форму. Такие люди живут практически нормальной жизнью, просто им следует избегать слишком больших физических нагрузок и других воздействий на систему кровообращения.
Серповидноклеточная анемия является тяжелым и опасным для жизни заболеванием. Больные с трудом выполняют физическую работу. Они быстро устают, испытывают головокружения и задыхаются, кроме того, у них наблюдаются шумы в сердце и учащается пульс. Содержание гемоглобина в крови таких людей составляет половину от нормального значения (нормальный уровень гемоглобина — 15-16 г/100 мл), поскольку серповидные клетки очень хрупкие и легко повреждаются, это приводит к анемии («малокровию»). Еще более серьезным последствием заболевания является закупорка капилляров крупными клетками аномальной формы, что сопровождается болями и нарушает нормальную работу органов. Именно это и является основной причиной ранней смерти многих людей, страдающих данным заболеванием.
Без медицинского вмешательства больные серповидноклеточной анемией умирают в детском возрасте. Тем не менее это заболевание на удивление часто встречается в некоторых странах Африки. Исследования, посвященные распространенности аллеля серповидного гемоглобина, показали, что его наличие в некоторой степени защищает гетерозигот от летальной формы малярии. Естественный отбор способствовал установлению такого баланса между опасностью гомозиготного состояния и устойчивостью к малярии при гетерозиготном состоянии. ■
Краткое содержание раздела 5.1 Обратимое связывание белков с лигандами: белки, связывающие кислород
■ В организме белки часто взаимодействуют с другими молекулами. Молекула, которая связывается с белком, называется лигандом, а участок белка, где происходит связывание, называется центром связывания. При связывании лиганда белки могут подвергаться конформационным изменениям, в результате чего возникает так называемое индуцированное соответствие. В мультисубъtдиничных белках связывание лиганда с одной субъединицей может влиять на связывание с другой субъединицей. Связывание лиганда может регулироваться.
■ Миоглобин содержит гемовую простетическую группу, связывающую кислород. Гем состоит из единственного атома железа в форме Fе2- в комплексе с порфирином. Миоглобин связывает кислород обратимым образом; это связывание можно описать с помощью константы ассоциации Кa или константы диссоциации Кd. В мономерных белках, каким является миоглобин, зависимость доли занятых центров связывания от концентрации лиганда описывается гиперболической функцией.
■ Нормальный гемоглобин взрослого человека состоит из четырех гемсодержащих субъединиц: двух α- и двух β-субъединиц; существует большое структурное сходство между всеми субъединицами гемоглобина и молекулой миоглобина. Гемоглобин может существовать в двух состояниях: Т и R. Пока не произошло связывание кислорода, состояние Т более устойчиво. Связывание кислорода способствует переходу гемоглобина в состояние R.
■ Связывание кислорода с гемоглобином — кооперативный аллостерический процесс. При связывании O2 в одном центре происходят конформационные изменения, влияющие на другие центры связывания (аллостерический эффект). Конформационные переходы между состояниями Т и R, опосредованные взаимодействием субъединиц, способствуют кооперативному связыванию. В результате связывание кислорода с гемоглобином описывается S-образной кривой и может быть проанализировано с помощью графика Хилла.
■ Для описания кооперативного связывания лигандов с мультисубъединичными белками предложено две модели: симметричная модель и последовательная модель.
■ Гемоглобин связывает не только кислород, но еще H+ и СO2, что приводит к образованию ионных пар, стабилизирующих состояние Т, и снижению сродства гемоглобина к кислороду (эффект Бора). Кроме того, связывание кислорода модулируется 2,3-бисфосфоглицератом (БФГ), который взаимодействует с гемоглобином в состоянии Т и стабилизирует это состояние.
■ Серповидноклеточная анемия — наследственное заболевание, вызванное одной аминокислотной заменой (Glueна Val6) в обеих β-цепях гемоглобина. Такая замена приводит к образованию гидрофобного участка на поверхности гемоглобина и способствует слипанию молекул в пучки волокон. У гомозиготных по этому дефекту людей проявляется серьезное заболевание.