ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
5. ФУНКЦИИ БЕЛКОВ
5.2. Комплементарное взаимодействие между белками и лигандами: иммунная система и иммуноглобулины
Мы уже показали, как конформация белков зависит от связывания небольших лигандов (O2 и СO2) с гемом, и сама влияет на это связывание. Однако большая часть взаимодействий белков с лигандами происходит без участия простетических групп. Центр связывания лиганда чаще всего напоминает центр связывания БФГ на молекуле гемоглобина — это просто полость в молекуле белка, в которой расположены определенные аминокислотные остатки, обеспечивающие специфичность связывания. Общим свойством центров связывания является эффективное распознавание даже очень близких по структуре лигандов.
У всех позвоночных есть иммунная система, способная различать «свои» и «чужие» молекулы, а затем уничтожить те, что воспринимаются как «чужие». Так иммунная система борется с вирусами, бактериями и другими патогенами, и молекулами, способными нанести вред организму. На физиологическом уровне реакция иммунной системы на чужеродную частицу или организм представляет собой сложный и координированный процесс взаимодействий между разными классами белковых и других молекул и различных типов клеток. А на уровне отдельных белков иммунный ответ служит примером того, как на основе обратимого связывания лигандов и белков строится чрезвычайно чувствительная и специфическая биохимическая система.
Иммунный ответ определяется действием ряда специализированных клеток и белков
За иммунный ответ отвечают разные типы лейкоцитов (белых клеток крови), в том числе макрофаги и лимфоциты, происходящие из недифференцированных стволовых клеток костного мозга. Лейкоциты могут выходить из кровотока и патрулировать ткани, причем каждая клетка способна синтезировать один или несколько белков, распознающих и связывающих чужеродные молекулы.
Иммунитет складывается из действия двух взаимодополняющих систем — гуморальной и клеточной. Гуморальный иммунитет (от лат. humor — жидкий) направлен против бактериальных инфекций и внеклеточных вирусов (тех, что попадают в жидкости организма), но может также реагировать на введение в организм и отдельных белков. Клеточный иммунитет разрушает хозяйские клетки, пораженные вирусом, а также уничтожает некоторых паразитов и чужеродные ткани.
Главным элементом гуморального иммунитета являются растворимые белки, называемые антителами или иммуноглобулинами (Ig). Иммуноглобулины связываются с бактериями, вирусами и крупными чужеродными молекулами, которые должны быть уничтожены. Иммуноглобулины, составляющие до 20% белков крови, образуются в В-клетках (В-лимфоцитах), называемых так потому, что они окончательно созревают в костном мозге (англ. bone marrow).
Главным элементом клеточного иммунитета являются определенные Т-клетки (Т-лимфоциты, чье название происходит от тимуса, где они заканчивают свое созревание), а именно цитотоксические Т-клетки (ЦТЛ), или клетки-киллеры. В распознавании инфицированных клеток или паразитов принимают участие белки, находящиеся на поверхности цитотоксических клеток — Т-клеточные рецепторы. Рецепторы — это белки, обычно расположенные на внешней поверхности клетки и выходящие за пределы плазматической мембраны. Рецепторы узнают и связывают внеклеточные лиганды, вызывая при этом определенные процессы в клетке.
Кроме цитотоксических Т-клеток существуют Т-клетки-помощники, или Т-хелперы (ТH). Их функция состоит в образовании растворимых сигнальных белков цитокинов, к которым, в частности, относятся интерлейкины. Т-хелперы взаимодействуют с макрофагами. ТН лишь косвенным образом участвуют в уничтожении инфицированных клеток и патогенных организмов, избирательно стимулируя те цитотоксические Т-клетки и В-клетки, которые связывают конкретный антиген. В результате данного процесса, называемого клональной селекцией, возрастает количество иммунных клеток, которые могут реагировать на появление этого антигена. Роль ТН особенно ярко проявляется в случае вируса иммунодефицита человека (ВИЧ), вызывающего синдром приобретенного иммунодефицита (СПИД). Первой мишенью ВИЧ как раз являются ТН. Уничтожение этих клеток постепенно разрушает всю иммунную систему. Функции различных типов лейкоцитов отражены в табл. 5-2.
Таблица 5-2.
Тин клеток |
Функции |
Макрофаги |
Потощают крупные частицы и клетки путем фагоцитоза |
В-лимфоциты (В-клетки) |
Синтезируют и секретируют антитела |
Т-лимфоциты (Т-клетки) Цитотоксические Т-клетки (ЦТЛ, клетки-киллеры) |
Взаимодействуют с инфицированными клетками хозяина посредством Т-клеточных рецепторов |
Т-хелперы (ТН) |
Взаимодействуют с макрофагами и секретируют цитокины (интерлейкины), стимулирующие пролиферацию ЦТЛ. ТН и В-клеток |
Каждый белок иммунной системы, будь то антитело, образованное В-клеткой, или рецептор Т-клетки, специфическим образом связывает молекулы с определенной химической структурой, отличая их от всех остальных молекул. В организме человека может вырабатываться более 108 различных антител, каждое из которых отличается определенной специфичностью. Такое необычайное разнообразие делает возможным узнавание и связывание практически любой химической структуры на поверхности вирусов или чужеродных клеток. Огромное разнообразие антител является результатом сборки генов иммуноглобулинов из отдельных фрагментов по механизму генетической рекомбинации (гл. 25, рис. 25-26).
Некоторые особенности взаимодействия антител или Т-клеточных рецепторов с узнаваемыми ими молекулами являются специфическими для иммунной системы, и для их описания используется специальная терминология. Любые молекулы или патогены, способные вызвать иммунный ответ, называются антигенами. Антигеном может быть вирус, клеточная стенка бактерии, отдельный белок или другая макромолекула. Сложный антиген может связываться с несколькими различными антителами. Каждое антитело и каждый Т-клеточный рецептор связываются лишь с одной конкретной молекулярной структурой антигена, называемой антигенной детерминантой, или эпитопом.
Иммунная система не реагирует на небольшие молекулы, которые являются обычно промежуточными или конечными продуктами клеточного метаболизма. Молекулы с молекулярной массой менее 5000, как правило, не вызывают иммунного ответа. Однако в лабораторных условиях небольшие молекулы можно присоединить с помощью ковалентной связи к крупным белкам, и этот комплекс в целом будет вызывать иммунный ответ. Такие малые молекулы называются гаптенами. Антитела, образующиеся в ответ на введение в организм комплекса белка с гаптеном, способны связываться и со свободными гаптенами. Подобные антитела иногда используют для разработки аналитических тестов, о которых речь пойдет дальше, или в качестве каталитических антител (доп. 6-3). Теперь вернемся к более детальному рассмотрению антител и их способности связываться с антигенами.
Антитела имеют два идентичных центра связывания антигена
В основном класс антител представлен иммуноглобулинами G (IgG); в сыворотке крови на них приходится значительная доля от всего белка. Молекулы IgG построены из четырех полипептидных цепей двух больших, называемых тяжелыми цепями, и двух легких цепей, которые связаны между собой нековалентными связями и дисульфидными мостиками в крупный комплекс с молекулярной массой 150 000. Тяжелые цени IgG взаимодействуют между собой на одном конце молекулы, а затем разделяются, и каждая взаимодействует с одной легкой цепью, в результате чего молекула имеет Y-образную структуру (рис. 5-21).
Рис. 5-21. Структура иммуноглобулина G. а) В молекуле IgG пары легких и тяжелых цепей соединяются, образуя Y-образную структуру. Два антигенсвязывающих участка молекулы образуются при комбинации вариабельных доменов легких (VL) и тяжелых цепей (VH). При действии папаина молекула разделяется на Fc- и Fab-фрагменты. Fc-фрагмент молекулы содержит связанный углеводный участок (см. б), б) Ленточная модель первой полной молекулы IgG, которая была кристаллизована (PDB ID 1IGT). Хотя молекула имеет две одинаковые тяжелые цепи (показаны двумя оттенками синего цвета) и две идентичные легкие цепи (два оттенка красного цвета), кристаллическая структура характеризуется асимметричной конформацией. Конформационная гибкость, по всей видимости, играет важную роль в функционировании иммуноглобулинов.
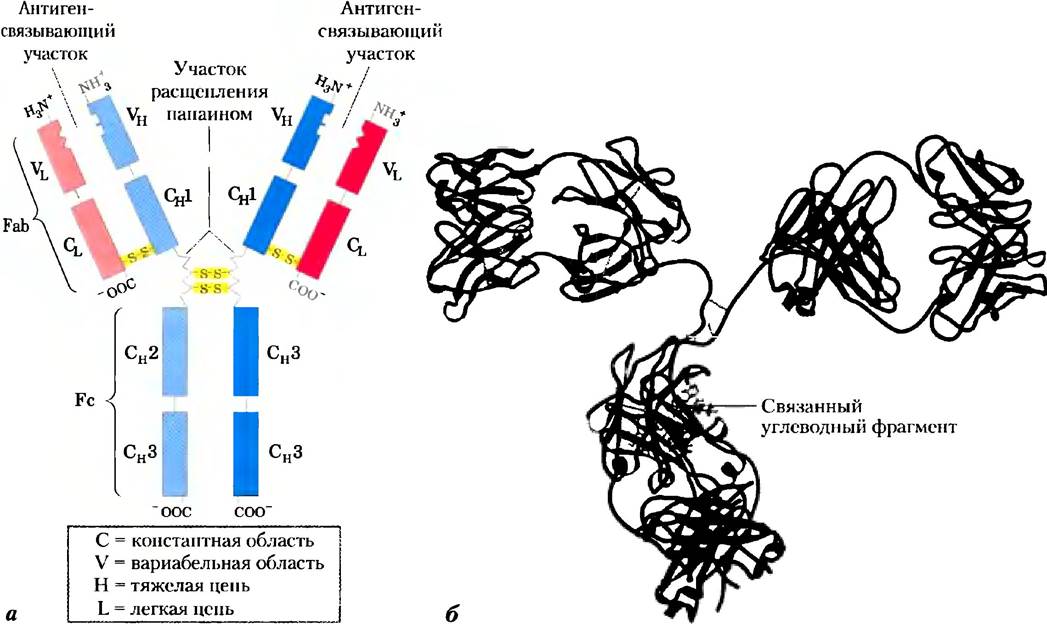
Протеазы могут расщеплять молекулу иммуноглобулина в местах «шарниров», отделяющих «ствол» IgG от его «ветвей». Расщепление панаином приводит к разделению «ствола», называемого Fc-фрагментом, поскольку он обычно легко кристаллизуется (от англ. crystallize), и двух «ветвей», называемых Fab-фрагментами (от англ. antigenbindingfragment). На каждом из Fab-фрагментов есть по одному участку связывания антигена.
Структура иммуноглобулинов была впервые определена Джеральдом Эдельманом и Родни Портером. Каждая цепь иммуноглобулина содержит четко идентифицируемые домены, причем некоторые из них обладают одинаковой структурой во всех типах IgG, а другие различаются. Консервативные (константные) домены несут характерные структурные мотивы, называемые иммуноглобулиновой складчатостью, которые встречаются во всех белках с β-структурой (гл. 4). Три константных домена есть в каждой тяжелой цепи, а один — в легкой цепи. Как тяжелые, так и легкие цепи несут по одному вариабельному домену, в которых наблюдается максимальное количество аминокислотных замен. Вместе вариабельные домены тяжелых и легких цепей образуют центр связывания антигена (рис. 5-21,5-22).
Рис. 5-22. Связывание IgG с антигеном. Для оптимального связывания антигена центр связывания на молекуле IgG часто претерпевает небольшие конформационные изменения. Такое индуцированное соответствие представляет собой общее явление при взаимодействиях белков с лигандами.
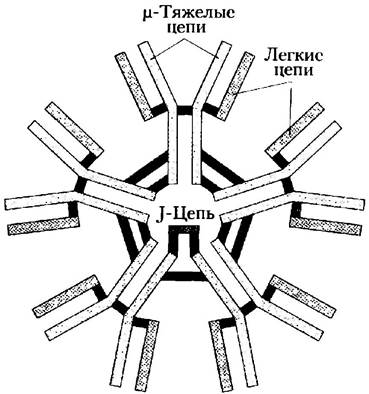
У многих позвоночных встречается пять классов иммуноглобулинов, и IgG — лишь один из них. Каждый класс несет свою тяжелую цепь: α, δ, ε, y и μ соответственно в IgA, IgD, IgE, IgG и IgM. Во всех иммуноглобулинах присутствует один из двух классов легких цепей: к или λ. Общая структура IgD и IgE напоминает строение IgG. IgM встречаются либо в мономерной форме в связанном с мембраной состоянии, либо в секретируемой форме в виде пентамера (рис. 5-23). IgA в основном обнаруживается в таких секретах, как слюна, слезы и молоко; они могут существовать в виде мономеров, димеров или тримеров. IgM — это первые антитела, которые начинают вырабатывать В-лимфоциты в процессе созревания, а также основные антитела, появляющиеся на ранних стадиях первичного иммунного ответа. Некоторые В-клетки вскоре переключаются на производство IgD (с тем же центром связывания антигена, что и у ранее синтезированного этой клеткой IgM), однако функции IgD окончательно не выяснены.
Рис. 5-23. Пентамерная структура IgM. Пентамерная структура удерживается благодаря дисульфидным связям (показаны желтым цветом). J-цепь представляет собой полипептид с Mr = 20 000; эта цепь обнаружена в IgA и IgM.
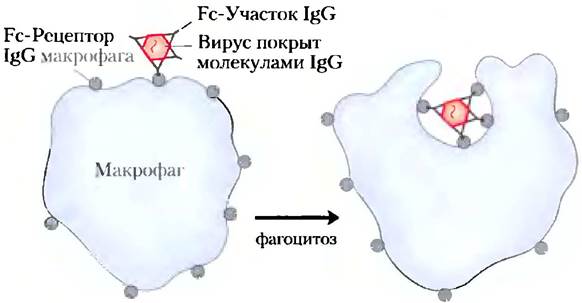
Иммуноглобулины G являются основными антителами, которые синтезируется при вторичном иммунном ответе, инициируемом В-клетками памяти, т. е. при развитии иммунного ответа на антигены, с которыми иммунная система уже встречалась ранее. При связывании IgG с попавшей в организм бактерией или вирусом они стимулируют некоторые лейкоциты, такие как макрофаги, способные поглощать и разрушать патогенные организмы, а также активируют некоторые другие элементы иммунного ответа. Кроме того, еще один класс рецепторов на поверхности макрофагов узнает и связывает Fc-фрагменты IgG. После связывания Fc-рецепторов с комплексом антитела и патогена макрофаг поглощает этот комплекс путем фагоцитоза (рис. 5-24).
Рис. 5-24. Фагоцитоз вируса, связанного с антителами. Fс-фрагменты антител связываются с Fс-рецепторами на поверхности макрофагов, что приводит к «заглатыванию» и разрушению вируса.
IgE играют важную роль при развитии аллергических реакций: они взаимодействуют с базофилами (фагоцитирующими лейкоцитами) в крови и с часто встречающимися в тканях тучными клетками, секретирующими гистамин. С помощью своего Fc-фрагмента иммуноглобулин Е связывается с Fc-рецепторами на базофилах или тучных клетках. В таком состоянии IgE выполняет роль своего рода рецептора антигена. После связывания антигена клетки начинают секретировать гистамин и другие биологически активные амины, способствующие расширению сосудов и повышению их проницаемости. Такое воздействие на сосуды, по всей видимости, облегчает перемещение клеток иммунной системы и белков к местам воспаления, но, кроме того, вызывает симптомы аллергии. Пыльца и другие аллергены воспринимаются организмом как чужеродные вещества и провоцируют иммунный ответ, который в норме направлен на уничтожение патогенов. ■
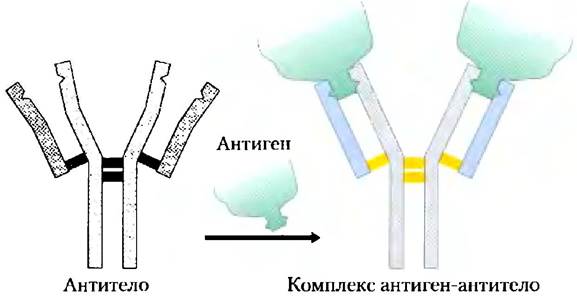
Антитела связывают антигены прочно и с высокой специфичностью
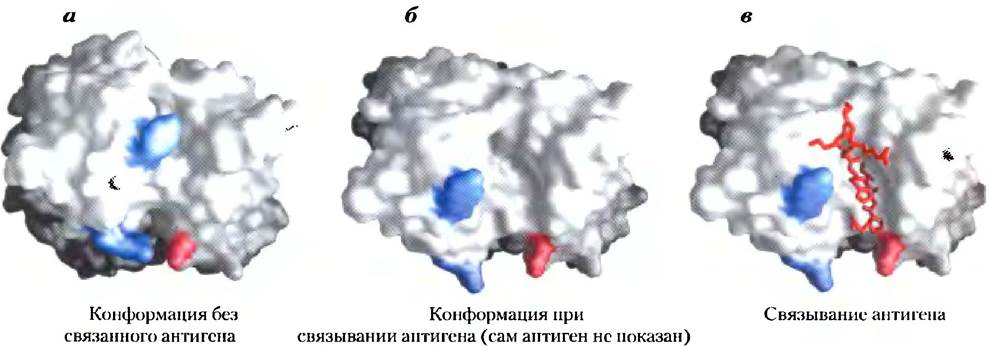
Специфичность связывания антигенов антителами определяется аминокислотными остатками вариабельных областей тяжелых и легких цепей антител. Многие остатки в этих областях меняются от белка к белку, но в разной степени. Некоторые остатки, в частности те, что образуют антигенсвязывающий участок, являются гипервариабельными, т. е. характеризуются особенно сильной изменчивостью. Специфичность связывания определяется химической комплементарностью антигена и его центра связывания на молекуле антитела, а именно формой молекулы и расположением заряженных, неполярных и образующих водородные связи групп. Например, центр связывания, несущий отрицательно заряженную группу, может связывать антиген с положительным зарядом в соответствующей позиции. Во многих случаях комплементарность достигается в результате взаимного влияния антигена и центра связывания, которое возникает по мере их сближения. Конформационные изменения, происходящие при этом в молекуле антитела и (или) антигена, позволяют комплементарным группам взаимодействовать наилучшим образом. Проиллюстрировать сказанное выше можно на примере образования комплекса между пептидом ВИЧ (модельный антиген) и Fаb-фрагменом (рис. 5-25). В этом случае особенно хорошо видны структурные изменения, происходящие при связывании антигена.
Рис. 5-25. Индуцированное соответствие при связывании антигена с IgG. Изображена поверхность Fab-фрагмента IgG. С ним связывается небольшой пептид вируса иммунодефицита человека (ВИЧ). Чтобы легче было проследить за изменениями структуры молекулы, два остатка тяжелой цепи выделены синим цветом, а один остаток легкой цепи — красным. а) Вид сверху на антигенсвязывающий участок Fab-фрагмента IgG (PDB ID 1GGC). б) Вид в той же проекции, но теперь Fab-фрагмент находится в конформации, в которой он связывает антиген (PDB ID 1GGI). Сама молекула антигена в данном случае не показана, чтобы удобнее было разглядеть изменения, произошедшие в центре связывания. Обратите внимание, что полость для связывания лиганда расширилась, а некоторые группы изменили свое положение в пространстве, в) Тот же вид в присутствии связанного антигена (модель в виде стержней красного цвета).
Обычно связь антитела с антигеном очень прочная — константа диссоциации Кd - 10-10 (вспомните, что чем ниже Кd, тем прочнее связь). Величина определяется энергией различных ионных, гидрофобных, ван-дер-ваальсовых взаимодействий и водородных связей, стабилизирующих комплекс. Энергия связывания, необходимая для достижения Kd = 10-10, примерно равна 65 кДж/моль.
Взаимодействие антитела с антигеном лежит в основе многих аналитических методов
Необыкновенно высокое сродство и специфичность связывания антител с антигенами лежат в основе широкого применения этой системы в аналитических целях. Используют два типа антител: поликлональные и моноклональные. Поликлональные антитела образуются множеством разных В-лимфоцитов в ответ на конкретный антиген, например, при введении определенного белка в организм животного. Такие В-лимфоциты образуют антитела, связывающие специфические, но разные эпитопы антигена. Таким образом, поликлональные препараты представляют собой смесь антител, узнающих разные участки белка. Напротив, моноклональные антитела синтезируются популяцией идентичных В-клеток (клоном), выращенных в клеточной культуре. Эти антитела гомогенны, в том смысле что они связываются с одним и тем же эпитопом. Методы получения моноклональных антител были разработаны Георгом Кёлером и Сезаром Мильнтейном.
Георг Кёлер, 1946-1995

Сезар Мильштейн, 1927-2002

Специфичность антител находит практическое применение. Определенные антитела можно соединить ковалентной связью с носителем и использовать для колоночной хроматографии (рис. 3-17, в). При пропускании через колонку смеси белков антитела будут специфическим образом связывать только определенные белки и удерживать их на колонке, в то время как остальные белки будут вымываться. Искомый белок затем можно смыть с колонки раствором соли или другого реагента. Это мощный метод, использующийся для очистки белков.
В другом универсальном аналитическом методе к антителам пришивают радиоактивную метку или другой маркер, позволяющий легко их идентифицировать. При связывании антител с исследуемым белком по метке можно судить о наличии белка в растворе или о его локализации в геле или даже живой клетке. Некоторые методы, использующие данный подход, проиллюстрированы на рис. 5-26.
Рис. 5-26. Аналитические методы с использованием антител. Специфическое взаимодействие антитела с антигеном лежит в основе целого ряда методов, использующихся для идентификации и количественного анализа белков в сложных смесях, а) Схематическое представление общего подхода. б) Определение антител против вируса простого герпеса (HSV) в крови методом ИФА. Лунки покрывают антигеном HSV, с которым связываются антитела против HSV. В качестве вторичных антител используют антитела против IgG человека, конъюгированные с пероксидазой хрена. Последовательность шагов приведена на рис. а; чем больше антител против HSV содержится в образце крови, тем выше интенсивность желтой окраски в лунке, в) Иммуноблот. На дорожках 1-3 нанесены образцы протеинкиназы, полученные на последовательных стадиях очистки. После проведения SDS-электрофореза гель был окрашен с помощью красителя Кумасси синего. На дорожках 4-6 нанесены те же образцы, которые после электрофоретического разделения были перенесены на нитроцеллюлозную мембрану. Затем мембрану в определенных условиях обработали антителами против протеинкиназы. Цифры между фотографиями геля и мембраны указывают расположение маркерных белков с известными молекулярными массами (кДа).
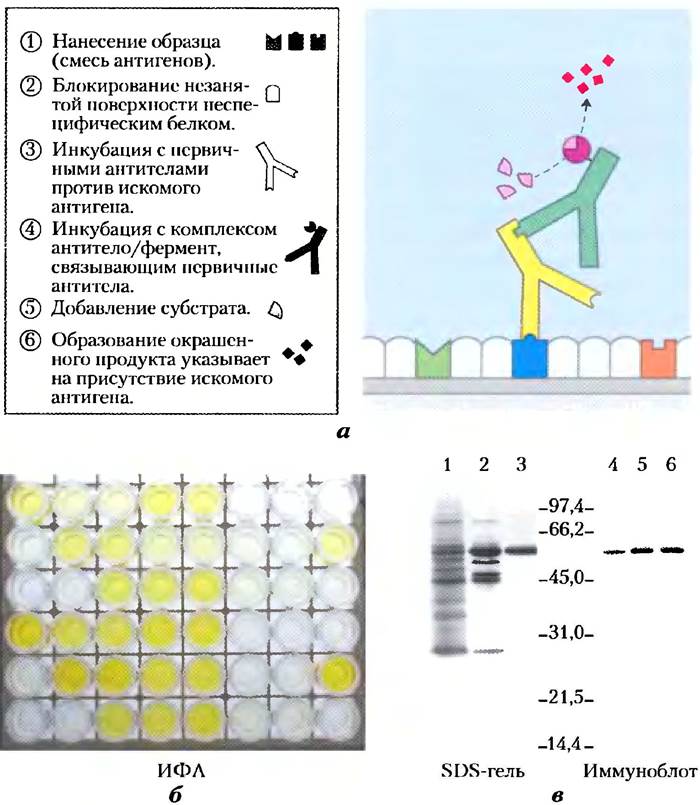
Метод твердофазного иммуноферментного анализа ИФА, или ELISA (от англ. enzyme- linked immunosorbent assay), позволяет провести быстрый количественный анализ антигена в образце (рис. 5-26, б). Образец белка наносят на инертную поверхность; чаще всего для этой цели используют 96-луночный полистирольный планшет. Затем лунку промывают раствором недорогого и неспецифического белка (часто используют казеин из обезжиренного сухого молока), чтобы предотвратить адсорбцию белков, добавляемых на следующих стадиях. После этого в лунку вносят раствор первичных антител — антител против искомого белка. Несвязанные антитела отмывают и добавляют раствор антител против первичных антител с ферментативной меткой, позволяющей проводить реакцию с образованием окрашенного продукта. Оставшиеся в растворе вторичные антитела отмывают и добавляют субстрат для связанной со вторичными антителами ферментативной метки. Количество образующегося продукта, определяемое по интенсивности окрашивания, пропорционально концентрации исследуемого белка в образце.
В методе иммуноблоттинга (или вестерн- блоттинга) белки, предварительно разделенные с помощью электрофореза, под действием электрического тока переносят из геля на нитроцеллюлозную мембрану (рис. 5-26, в). Мембрану блокируют неспецифическим белком, как при проведении И ФА, а затем последовательно обрабатывают первичными антителами, вторичными антителами с ферментативной меткой и субстратом. Окрашенный продукт образуется только в тех полосах, где содержится искомый белок. Иммуноблоттинг позволяет детектировать минорные компоненты белковых смесей и приблизительно определять молекулярную массу исследуемого белка. Иммуноблоттинг.
В следующих главах мы еще столкнемся с другими аспектами действия антител. Они играют чрезвычайно важную роль в медицине и могут многое сообщить об особенностях белков и генов.
Краткое содержание раздела 5.2 Комплементарное взаимодействие между белками и лигандами: имунная система и иммуноглобулины
■ Иммунный ответ определяется действием специализированных лейкоцитов и связанных с ними белков. Т-лимфоциты синтезируют Т-клеточные рецепторы. В-лимфоциты синтезируют иммуноглобулины. В процессе клональной селекции Т-хелперные клетки индуцируют пролиферацию В-клеток или цитотоксических Т-клеток, вырабатывающих соответственно иммуноглобулины или Т-клеточные рецепторы, способные связывать определенный антиген.
■ У человека обнаружено пять классов иммуноглобулинов, каждый из которых выполняет свою биологическую функцию. В количественном отношении преобладает IgG. Молекулы IgG имеют Y-образную форму и состоят из двух тяжелых и двух легких цепей. На двух концах молекулы, каждый из которых образован одной тяжелой и одной легкой цепью, расположены гипервариабельные области, формирующие два антигенсвязывающих участка.
■ Каждый иммуноглобулин обычно связывается только с одним участком большого антигена (например, белка) — с эпитопом. Процесс связывания часто сопряжен с конфирмационными изменениями, приводящими к индуцированному соответствию между антителом и антигеном.