ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
5. ФУНКЦИИ БЕЛКОВ
5.3. Энергозависимые взаимодействия белков: актин, миозин и молекулярные моторы
Живые организмы движутся. Клетки движутся. Органеллы и макромолекулы внутри клеток тоже движутся. Основная часть этих движений возможна благодаря активности удивительного класса белков — молекулярных моторов. С помощью химической энергии, источником которой обычно служит АТР, крупные агрегаты моторных белков претерпевают циклические конформационные изменения; эти изменения складываются в унифицированные, направленные воздействия — от крошечных, разводящих хромосомы в делящейся клетке, до невероятной силы, которую развивает в прыжке камышовый кот весом до двадцати килограммов.
Взаимодействия между моторными белками, как вы уже можете предсказать, являются результатом ионных, гидрофобных, ван-дер-ваальсовых взаимодействий и водородных связей в центрах связывания на молекулах белков. Однако в моторных белках эти взаимодействия достигают невероятно высокого уровня пространственной и временной организации.
Действие моторных белков лежит в основе сокращения мышц, перемещения органелл вдоль микротрубочек, вращения жгутиков бактерий и движения некоторых белков вдоль нити ДНК. Белки кинезины и динеины движутся вдоль микротрубочек в клетке и тянут за собой органеллы или перестраивают хромосомы в процессе деления клетки. Взаимодействие динеина с микротрубочками вызывает движение ресничек и жгутиков эукариотических клеток. Движение жгутиков бактерий связано с активностью сложного вращательного мотора в основании жгутика (рис. 19-39). На различных этапах метаболизма ДНК-хеликазы, полимеразы и другие белки должны перемещаться вдоль молекулы ДНК (гл. 25). В данной главе на примере хорошо известных сократительных белков скелетных мышц позвоночных мы рассмотрим, каким образом белки превращают химическую энергию в движение.
Миозин и актин — основные белки мышц
Движущей силой мышечных сокращений является взаимодействие двух белков — миозина и актина. Эти белки организованы в виде нитей, скольжение которых друг относительно друга приводит к сокращению мышц. Вместе актин и миозин составляют более 80% белковой массы мышц.
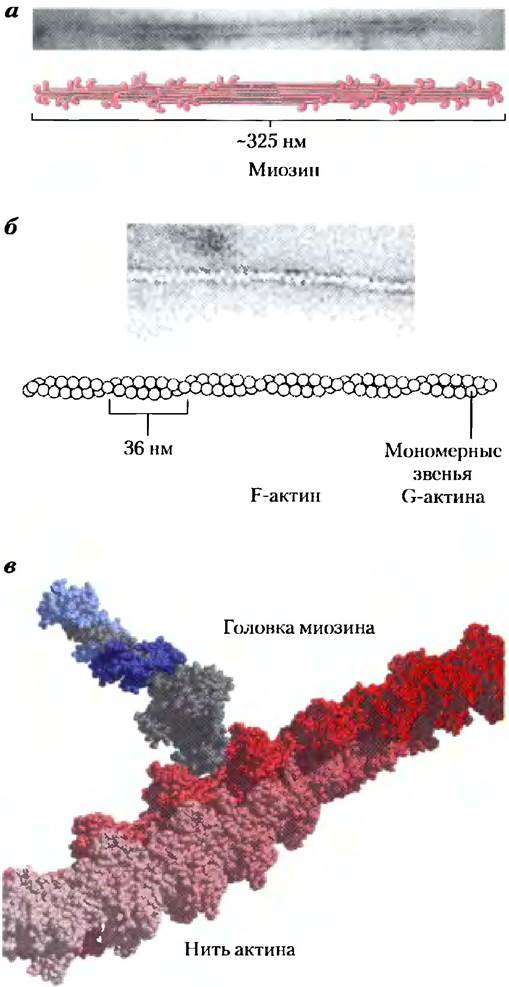
Миозин (Мr ≈ 540 000) состоит из шести полипептидных цепей — двух тяжелых (Мr ≈ 220 000) и четырех легких (Mr ≈ 20 000). Тяжелые цепи составляют основу структуры миозина. С-концы тяжелых цепей организованы в виде протяженных α-спиралей и переплетаются между собой, образуя левую суперскрученную спираль, напоминающую спираль α-кератина (рис. 5-27, а). На N-конце каждая тяжелая цепь содержит большой глобулярный домен с участком, на котором происходит гидролиз ATP. С глобулярными доменами связаны легкие цепи. При быстрой обработке протеазой трипсином длинный «хвост» молекулы миозина расщепляется, в результате чего образуются два фрагмента, называемые тяжелым и легким меромиозином (рис. 5-27, б). Содержащий глобулярную часть субфрагмент S1, или просто «головка» миозина, отделяется от тяжелого меромиозина при обработке папаином. «Головка» миозина представляет собой моторный участок, с помощью которого осуществляется сокращение мышц. Фрагмент S1 можно кристаллизовать, его структура определена Эйвеном Рэйментом и Хейзел Холден (рис. 5-27, в).
Рис. 5-27. Миозин, а) Миозин имеет две тяжелые цепи (изображены разными оттенками розового цвета), С-концы которых образуют протяженные суперскрученные «хвосты», а N-концы содержат глобулярные домены («головки»). С каждой «головкой» миозина связаны две легкие цепи (показаны синим цветом), б) Расщепление трипсином и папаином приводит к разделению «головки» (S1-фрагмента) и «хвоста» молекулы, е) Ленточная модель S1-фрагмента миозина. Тяжелая цепь изображена серым цветом, две легкие цепи — разными оттенками синего (координаты модели предоставлены Эйвеном Рэйментом).

В клетках мышц молекулы миозина агрегируют, образуя толстые нити, или филаменты (рис. 5-28, а). Эти палочковидные структуры служат стержнем сократительной единицы. В толстых нитях сотни молекул миозина организованы таким образом, что их «хвосты» образуют длинную биполярную структуру. Глобулярные домены выступают с каждой стороны нити в регулярном порядке.
Рис. 5-28. Основные элементы мышцы, а) Молекулы миозина агрегируют с образованием биполярных структур, называемых толстыми нитями, б) F-актин представляет собой нить мономерных звеньев G-актина; две нити F-актина навиваются друг на друга, образуя правозакрученную спираль, в) Пространственная модель нити актина (изображена с помощью разных оттенков красного цвета), одно из мономерных звеньев которой связано с «головкой» миозина (синий и серый цвет) (координаты предоставлены Эйвеном Рэйментом).
Вторым важным белком мышц является актин, которым богаты практически все эукариотические клетки. В мышцах молекулы мономерного актина — G-актина (глобулярный актин; Мr = 42 000) связаны в длинные полимерные цени F-актина (фибриллярный актин). Тонкие нити (филаменты) (рис. 5-28, в) образованы F-актином при участии белков тропонина и тропомиозииа. Формирование тонких нитей происходит по мере последовательного присоединения мономерных молекул актина к одному концу. Кроме того, каждая молекула актина связывает молекулу АТР и гидролизует ее до ADP, так что каждый мономер актина в составе нити находится в комплексе с ADP. Таким образом, гидролиз АТР под действием актина происходит только при сборке нитей; АТР не передаст энергию непосредственно в момент сокращения мышцы. Каждый мономер актина в составе тонкой нити может специфически и прочно связываться с одной головкой молекулы миозина (рис. 5-28, в).
Упорядоченные структуры тонких и толстых нитей образуются при участии других белков
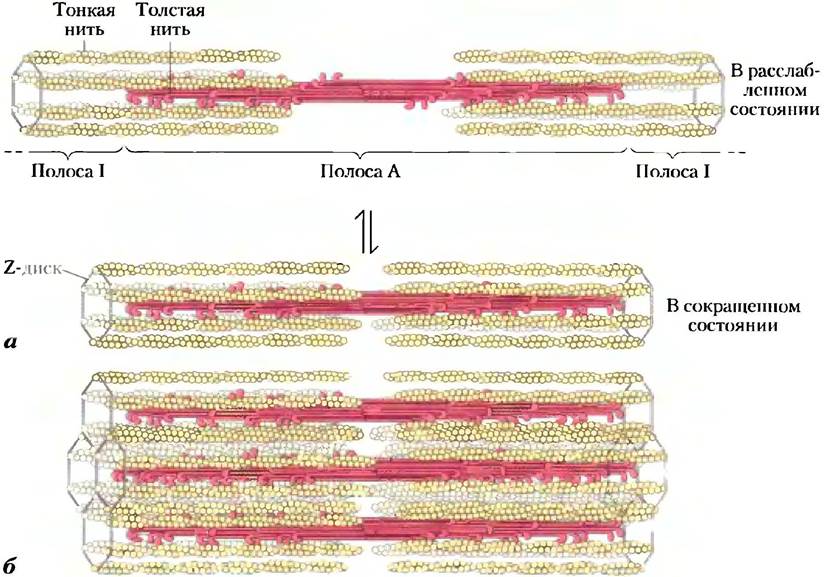
Скелетные мышцы состоят из параллельных пучков мышечных волокон. Каждое волокно представляет собой одну очень большую многоядерную клетку с диаметром от 20 до 100 мкм. Эти клетки образуются в результате слияния многих клеток и часто распространяются на длину всей мышцы. Волокно состоит примерно из 1000 миофибрилл диаметром 2 мкм, каждая из которых содержит огромное количество регулярным образом упакованных тонких и толстых нитей в комплексе с другими белками (рис. 5-29). Каждую миофибриллу окружает система плоских мембранных везикул — саркоплазматический ретикулум. Под электронным микроскопом в мышечном волокне можно различить чередующиеся области высокой и низкой электронной плотности, называемые полосами А и I (рис. 5-29, б, в). Эти полосы возникают в результате специфической укладки тонких и толстых нитей, при которой они частично перекрываются. Полоса I представляет собой область пучка, который в поперечном сечении состоит только из тонких нитей. Более темная полоса А соответствует участку сосредоточения толстых нитей, а также включает в себя места перекрывания параллельно идущих тонких и толстых нитей. Полоса I в середине разделена Z-диском — тонкой структурой, расположенной перпендикулярно к оси тонкой нити и служащей в качестве якоря, к которому прикрепляются тонкие нити. Полоса А в свою очередь также разделена посередине линией М, или М-диском, — областью высокой электронной плотности в центре толстых нитей. Целиком вся сократительная единица, состоящая из пучков толстых нитей, перемежающихся на обоих концах с пучками тонких нитей, называется саркомером. Перемежающееся расположение пучков позволяет тонким и толстым нитям скользить друг относительно друга (механизм см. ниже), в результате чего происходит постепенное сокращение каждого саркомера (рис. 5-30).
Рис 5-29. Структура скелетных мышц. а) Мышечное волокно состоит из одной вытянутой многоядерной клетки, образующейся в результате слияния многих клеток-предшественников. Внутри волокна множество миофибрилл (на данном рисунке для простоты их изображено только шесть) окружены мембраной саркоплазматического ретикулума. Под электронным микроскопом видны полосы, образованные тонкими и толстыми нитями миофибрилл. При сокращении мышцы полоса I сужается, и соседние Z-диски сближаются друг с другом; б) расслабленная мышца; в) мышца в сокращенном состоянии.

Рис. 5-30. Сокращение мышцы. Толстые филаменты (нити) представляют собой биполярные структуры, образованные в результате ассоциации большого числа молекул миозина. а) Мышечное сокращение происходит в результате скольжения тонких и толстых нитей друг относительно друга, так что Z-диски соседних полос I сближаются. б) Тонкие и толстые нити перемежаются, так что каждая толстая нить окружена шестью тонкими.
Тонкие нити актина одним концом прикреплены к Z-диску. В образовании этого контакта участвуют также белки α-актинин, десмин и виментин. Тонкие нити, кроме того, содержат гигантский белок небулин (состоит примерно из 7000 аминокислотных остатков), который, как полагают, организован в виде α-спирали, перекрывающей длину всей нити. Аналогичным образом М-линия организует толстые филаменты. В этом участвуют такие белки, как парамиозин, С-белок и М-белок. Еще один класс белков — титины —наиболее крупные из известных на сегодняшний день белков, состоящих из единственной полипептидной цепи (титин сердечной мышцы человека состоит из 26 926 аминокислотных остатков). Титин связывает толстые филаменты с Z-диском, обеспечивая дополнительный уровень организации всей структуры. Считается, что небулин и титин служат своего рода «молекулярной линейкой», регулирующей длину и толщину соответственно тонких и толстых филаментов. Титин простирается от Z-диcкa до М-линии, регулируя длину самого саркомера и предотвращая перерастяжение мышцы. Длина саркомера в разных тканях различается, что, в частности, связано с наличием в организме позвоночных нескольких вариантов титина.
Толстые нити миозина скользят по тонким нитям актина
Взаимодействие между актином и миозином, как и всех белков с лигандами, основано на действии слабых сил. Если с миозином не связана молекула АТР, то головка миозина связывается с актином (рис. 5-31). Если миозин связывает молекулу АТР и гидролизует ее до ADP и фосфата, происходит циклическая серия конформационных изменений, при которых миозин высвобождает одну субъединицу F-актина и связывает следующую за ней.
Рис. 5-31. Молекулярный механизм мышечного сокращения. Конформационные изменения в «головке» миозина, сопряженные с циклом гидролиза АТР, приводят к диссоциации миозина из комплекса с одной субъединицей актина и его связыванию с другой, расположенной дальше вдоль тонкой нити. Так происходит скольжение толстых нитей вдоль тонких (см. рис. 5-30).
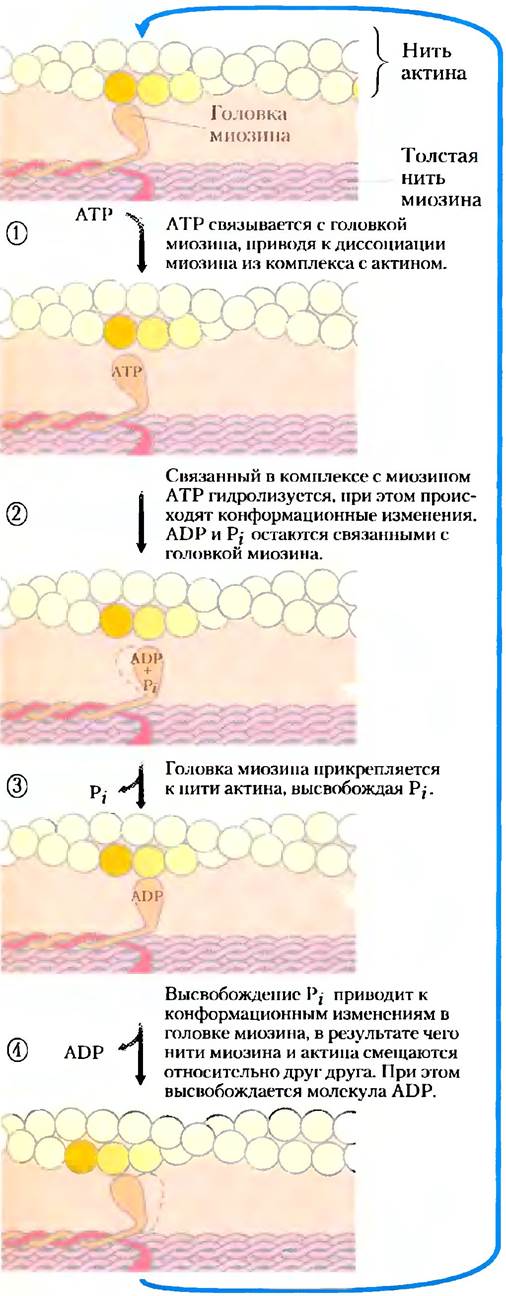
Этот цикл состоит из четырех основных стадий (рис. 5-31). На стадии 1 молекула АТР связывается с миозином, актомиозиновый комплекс распадается, и актин высвобождается. На стадии 2 молекула АТР гидролизуется, вызывая конформационные изменения в белке и его переход в состояние с более высоким уровнем энергии, в результате чего «головка» миозина поворачивается и меняет свою ориентацию относительно нити актина. Затем между «головкой» миозина и следующим мономерным звеном актина, расположенным ближе к Z-диску, возникает слабая связь. На стадии 3 от миозина отсоединяется фосфат, образовавшийся в процессе гидролиза АТР, что сопряжено с очередным конфирмационным изменением в молекуле миозина, приводящим к более прочному взаимодействию в актомиозиновом комплексе. Далее на стадии 4 «головка» миозина приходит в исходное состояние, так что в результате «хвост» миозина смещается относительно нити актина в сторону Z-диска. В завершение цикла молекула ADPвысвобождается. В результате каждого такого цикла совершается работа, эквивалентная 3-4 nН, и толстая нить смещается относительно тонкой нити на 5-10 нм.
На толстой нити находится множество «головок» миозина, и в каждый конкретный момент лишь немногие из них (вероятно, 1-3%) связаны с тонкими нитями. Это не позволяет толстой нити проскальзывать назад в тот момент, когда отдельная «головка» миозина высвобождает субъединицу актина, с которой была связана. Таким образом толстые нити активно сдвигаются относительно тонких нитей. Этот процесс, скоординированный во всех саркомерах мышечного волокна, приводит к сокращению мышцы.
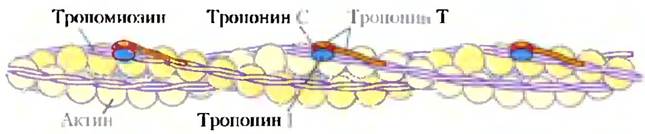
Взаимодействие между актином и миозином должно регулироваться таким образом, чтобы мышечное сокращение происходило только в ответ на соответствующий сигнал нервной системы. Эта регуляция осуществляется с помощью двух белков — тропомиозина и тропонина (рис. 5-32). Тропомиозин связывается с тонкими нитями и блокирует центры связывания «головок» миозина. Тропонин является Са2+-связывающим белком. Нервный импульс вызывает высвобождение Са2+ из саркоплазматического ретикулума. Ионы Са2+ связываются с трононином (еще один пример взаимодействия белка с лигандом), что приводит к конформационным изменениям в комплексе тропонина с тропомиозином, в результате которых освобождается участок связывания миозина на тонкой нити. Происходит мышечное сокращение.
Рис. 5-32. Регуляция мышечного сокращения тропомиозином и тропонином. Тропомиозин и тропонин связаны с F-актином в тонких мышечных волокнах. При расслаблении мышцы оба белка располагаются вокруг актинового волокна, блокируя участки связывания миозина. Тропомиозин представляет собой α-спиральный белок, состоящий из двух пептидов, образующих двойную спираль (тот же структурный мотив, что и в α-кератине; рис. 4-10). Он образует полимеры типа «голова-хвост», которые закручиваются вокруг двух цепей актина. Тропонин присоединяется к комплексу актин/тропомиозин через регулярные интервалы 38,5 нм. Тропонин состоит из трех различных субъединиц: I, С и Т. Тропонин I предотвращает связывание головки миозина с актином; тропонин С содержит центр связывания ионов кальция, а тропонин Т связывает весь тропониновый комплекс с тропомиозином. Когда мышца получает сигнал начать сокращение, из саркоплазматического ретикулума высвобождаются ионы кальция (рис. 5-29, а) и связываются с тропонином С. Это приводит к конформационным изменениям в тропонине С, который меняет положение тропонина I и тропомиозина таким образом, что ингибирование тропонином I снимается, и мышечное сокращение становится возможным.
При работе скелетных мышц белки выполняют две свои обычные функции — связывание и катализ. Взаимодействие актина с миозином и иммуноглобулинов с антигенами — это частные случаи взаимодействия белка с лигандом. Эти процессы обратимы, и после их завершения участники процессов остаются в неизменном виде. Однако связавшийся с миозином АТР подвергается гидролизу до ADP и неорганического фосфата. Таким образом, миозин — это не просто белок, связывающий актин, но еще и фермент (АТРаза). Каталитическая активность ферментов является предметом обсуждения в следующей главе.
Краткое содержание раздела 5.3 Энергозависимые взаимодействия белков: актин, миозин и молекулярные моторы
■ В моторных белках взаимодействие белка с лигандом достигает особенно высокой степени пространственной и временной организации. Мышечное сокращение является результатом тонкого взаимодействия между миозином и актином, сопряженного с гидролизом АТР под действием миозина.
■ Миозин состоит из двух тяжелых и четырех легких цепей, образующих длинный спиральный домен («хвост») и глобулярный домен («головку»). Молекулы миозина организованы в виде толстых нитей, способных скользить вдоль тонких нитей, основой которых является актин. Гидролиз АТР под действием миозина приводит к серии конформационных изменений в «головке» миозина, в результате чего миозин диссоциирует из комплекса с одной субъединицей актина и образует комплекс с другой, расположенной дальше вдоль тонкой нити. Таким образом, нити миозина скользят по тонким нитям актина.
■ Сокращение мышцы стимулируется высвобождением Са2+ из саркоплазматического ретикулума. Ионы Са2+ связываются с белком тропонином, приводя к конформационным изменениям в комплексе тропонина с тропомиозином и инициируя цикл взаимодействий актина с миозином.