ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
5. ФУНКЦИИ БЕЛКОВ
Вопросы и задачи
1. Связь между сродством и константой диссоциации.
Белок А связывает лиганд X в центре связывания с константой диссоциации Кd = 10- 6 М. Белок В связывает лиганд X в центре связывания с константой диссоциации Кd = 10-9 М. Какой белок обладает большим сродством к лиганду X? Объясните свой ответ. Выразите константу диссоциации Кd через константу ассоциации Кa и определите константы ассоциации для обоих балков А и В.
2. Отрицательная кооперативность.
В какой из описанных ниже ситуаций график Хилла покажет значение nH <1? Поясните свой ответ в каждом случае.
а) Белок состоит из нескольких субъединиц, каждая из которых имеет один центр связывания лиганда. Связывание лиганда с одним центром ослабляет сродство к лиганду других центров.
б) Белок состоит из единственного полипептида с двумя центрами связывания лиганда, имеющими разное сродство к лиганду.
в) Белок состоит из единственного полипептида с одним центром связывания лиганда. В результате очистки получают гетерогенный препарат белка: часть белка денатурирована и в результате имеет более низкое сродство к лиганду.
3. Сродство гемоглобина к кислороду.
Каким будет влияние следующих изменений на сродство гемоглобина к кислороду?
а) Снижение значения pH крови с 7,4 до 7,2.
б) Снижение парциального давления СO2 в легких с 6 кПа (при задержке дыхания) до 2 кПа (в норме).
в) Увеличение содержания БФГ с 5 мМ (на нормальных высотах) до 8 мМ (на больших высотах).
г) Увеличение содержания СО от 1,0 части на миллион (ppm) в нормальном воздухе в помещении до 30 ppm в помещении с плохой печной тягой.
4. Обратимое связывание лиганда.
Белок кальциневрин связывается с белком кальмодулином с константой скорости 8,9 • 103М-1с-1 и константой диссоциации Кd = 10 пМ. Рассчитайте константу скорости диссоциации rd.
5. Кооперативность действия гемоглобина.
При определенных условиях гемоглобин диссоциирует на четыре субъединицы. Отдельная α-субъединица связывает кислород, однако кривая связывания имеет гиперболический, а не S-образный вид. Кроме того, на связывание кислорода с отдельной α-субъединицей не влияет присутствие Н+, СO2 и БФГ. Что на основании данных наблюдений можно сказать о природе кооперативности гемоглобина?
6. Сравнение свойств гемоглобина матери и плода.
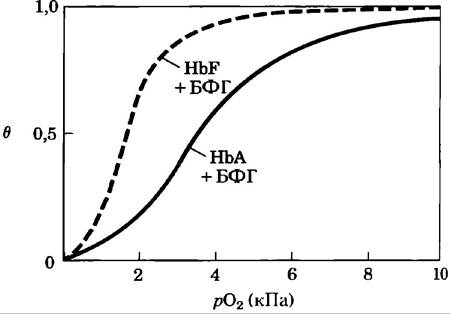
Изучение переноса кислорода в организме беременных женщин показало, что кривые связывания кислорода гемоглобином матери и плода, полученные при одних и тех же условиях, сильно различаются. Эритроциты плода содержат структурный вариант гемоглобина (HbF), состоящий из двух α- и двух y-субъединиц (α2y2), в то время как гемоглобин матери (НbА) состоит из двух α- и двух β-субъединиц (α2β2).
а) Какой гемоглобин (НbА или НbF) и почему имеет более высокое сродство к кислороду в физиологических условиях?
б) В чем физиологический смысл различного сродства к кислороду этих вариантов гемоглобина?
в) Если из препаратов НbА и НbF тщательно удалить БФГ, то экспериментальные кривые связывания кислорода сдвинутся влево (следовательно, изменится и сродство к кислороду). Но теперь НbА имеет более высокое сродство к кислороду, чем НbF. Если вновь добавить БФГ, то кривые связывания кислорода вернутся к исходным положениям, как показано на рисунке. Какое влияние оказывает БФГ на сродство гемоглобина к кислороду? Как с помощью данной информации объяснить различное сродство к кислороду гемоглобинов матери и плода?
■ 7. Различные формы гемоглобина.
В природе существует почти 500 форм гемоглобина. Большинство из них различаются всего одним аминокислотным остатком в полипептидной цепи. Наличие некоторых форм сопряжено с определенными заболеваниями, однако далеко не все варианты гемоглобина вызывают болезнь. Ниже перечислены некоторые формы гемоглобина.
HbS (серповидный гемоглобин): Val замещает Glu на поверхности молекулы;
Hb Cowtown: отсутствует ионная пара, стабилизирующая состояние Т;
Hb Memphis: одно полярное незаряженное основание на поверхности молекулы заменено на другое, близкое по размеру;
Hb Bibba: Pro замещает Leu в а-спиральном участке;
Hb Milwaukee: Glu замещает Val;
Hb Proviodence: Asn заменяет Lys, обычно находящийся в центральной полости тетрамера; Hb Philly: Phe замещает Туг, что приводит к нарушению водородных связей на поверхности α1β1.
Объясните, какой вариант (варианты) и почему:
а) с наименьшей вероятностью связан с проявлением патологических симптомов;
б) имеет другое значение pl, чем НbА;
в) с наибольшей вероятностью обладает пониженным сродством к БФГ и повышенным сродством к кислороду.
8. Связывание кислорода и структура гемоглобина.
Группа биохимиков с помощью генно- инженерных методов пытается модифицировать область контакта между отдельными субъединицами гемоглобина. Получившиеся варианты гемоглобина существуют в растворе главным образом в виде α2β2-Димеров и очень небольшого количества тетрамерных форм. Такой гемоглобин сильнее или слабее связывает кислород? Объясните свой ответ.
9. Обратимое связывание антител.
Антитело связывается с антигеном с константой Kd = 5 • 10-8 М. При какой концентрации антигена параметр θ будет равен:
а) 0,2; б) 0,5; в) 0,6; г) 0,8?
10. Использование антител при изучении связи структуры и функции белков.
Моноклональные антитела связываются с G-актином, но не связываются с F-актином. Что в связи с этим вы можете сказать об эпитопе, узнаваемом данными антителами?
11. Иммунная система и вакцины.
Организму хозяина требуется определенное время, иногда несколько дней, чтобы сформировать иммунный ответ на новый антиген. А с помощью клеток памяти иммунная реакция на ранее уже встречавшийся патоген развивается очень быстро. Вакцины, действие которых направлено против определенной вирусной инфекции, могут содержать в себе ослабленный или убитый вирус, а также отдельные белки из защитной оболочки вируса. При введении в организм человека вакцина обычно не вызывает инфекции или болезненного состояния, но лишь «обучает» иммунную систему распознавать данные вирусные частицы, стимулируя образование клеток памяти. Если через какое-то время человек столкнется с данной инфекцией, то эти клетки будут связывать вирусные частицы и способствовать формированию быстрого иммунного ответа. Некоторые патогены, в том числе и ВИЧ, выработали механизмы борьбы с иммунной системой, что делает сложным или практически невозможным создание против них эффективных вакцин. Какую стратегию может применять патоген, чтобы ускользать от уничтожения иммунной системой? Считайте, что антитела и (или) Т-клеточные рецепторы способны связываться с любой структурой, которая появляется на поверхности патогена, а также что связанный патоген обязательно уничтожается.
12. О трупном окоченении.
Когда высшее позвоночное животное умирает, его мышцы лишаются АТР и теряют эластичность — это состояние называется трупным окоченением. Объясните молекулярные основы данного явления.
13. Другой взгляд на саркомеры.
Толстые и тонкие нити в саркомере организованы таким образом, что шесть тонких нитей обычно окружают каждую толстую нить, образуя в поперечном срезе гексаэдр. Изобразите поперечный срез миофибриллы в следующих точках:
а) вдоль линии М;
б) в области полосы I;
в) в плотной области полосы А;
г) в менее плотной области полосы А, прилегающей к линии М (см. рис. 5-29, б, в).
Биохимия в Интернете
14. Лизоцим и антитела.
Чтобы лучше понять действие белков в клетке, полезно рассмотреть взаимодействие белков с другими компонентами клетки в трехмерном изображении. К счастью, теперь это можно сделать с помощью белковых баз данных в Интернете программ визуализации трехмерной структуры молекул. Некоторые программы требуют скачивания и отладки, другие плохо работают под определенными операционными системами и браузерами, некоторые требуют использования коммандной строки, интерфейс других более удобен. Мы советуем зайти на сайт www. umass.edu/microbio/rasmol и искать информацию о программах RasMol, Protein Explorer и Jmol First Glance. Выберите программу визуализации, наиболее подходящую для вашей операционной системы, браузера и уровня необходимой точности. Затем скачайте и установите те программы и плагины, которые могут вам понадобиться.
В данном примере вы будете изучать взаимодействия фермента лизоцима (гл. 4) и Fab- фрагмента антител против лизоцима. Используйте идентификационный номер PDB1FDL для изучения структуры комплекса Fab-фрагмента IgGl с лизоцимом (комплекс антиген/антитело). Ответьте на следующие вопросы, используя информацию из таблиц структур (structure summary page) в базе Protein Data Bank (www. rcsb.org) и посмотрите на изображение структуры, используя RasMol, Protein Explorer или Jmol First Glance.
а) Какие цепи в трехмерной модели принадлежат фрагменту антитела, а какие антигену (лизоциму)?
б) Какая вторичная структура преобладает в данном Fab-фрагменте?
в) Сколько аминокислотных остатков содержится в легких и тяжелых цепях Fab-фрагмента? В молекуле лизоцима? Какая доля молекулы лизоцима реагирует с антигенсвязывающим участком фрагмента антитела?
г) Идентифицируйте специфические аминокислотные остатки в молекуле лизоцима и в вариабельных областях легких и тяжелых цепей Fab-фрагмента, которые расположены в области взаимодействия антитела и антигена. Расположены ли эти области рядом в первичных последовательностях полипептидных цепей? 15
15. Изучение обратимых взаимодействий белков с лигандами с помощью динамических графиков.
Для решения этого задания воспользуйтесь графиками для уравнений 5-8, 5-11, 5-14 и 5-16.
а) Обратимое связывание лиганда с простым белком (без кооперативности). Для уравнения 5-8 постройте графики в координатах 6 от [L] (соответственно вертикальная и горизонтальная оси), соответствующие значениям Кd, равным 5, 10, 20 и 100 мкМ. Предположите, что эти четыре константы соответствуют связыванию четырех разных белков с лигандом L. Какой из данных белков обладает более высоким сродством к лиганду?
Рассмотрите график для Kd = 10 мкМ. Как сильно увеличивается θ при увеличении [L] от 0,2 до 0,4 мкМ? Как сильно увеличивается θ при увеличении [L] от 40 до 80 мкМ?
Вы можете сделать то же упражнение для уравнения 5-11. Переведите [L] в рО2, а Кd в Р50. Проанализируйте кривые для значений Р5(), равных 0,5, 1,0, 2,0 и 10 кПа. Для кривой, соответствующей Р50 = 1,0 кПа, определите, как сильно изменяется 0 при увеличении рO2 от 0,02 до 0,04 кПа и от 4 до 8 кПа.
б) Кооперативное связывание лиганда с мультисубъединичным белком. Используя уравнение 5-14, постройте кривую связывания белка с лигандом в случае Кd = 10 мкМ и n = 3. Обратите внимание на определение Kd в уравнении 5-16. На том же графике изобразите кривую для Kd = 20 мкМ и n = 3. Теперь измените n на 4 и посмотрите, как поведут себя обе кривые. Постройте график Хилла для каждого случая (уравнение 5-16). Определите значение θ при [L] = 40 мкМ в случае Кd = 10 мкМ и n = 3.
в) Проанализируйте данные уравнения, изменяя все использованные в них параметры.
Анализ экспериментальных данных
16. Функции белка.
В 1980-е гг. структуры актина и миозина были известны только в ограниченном разрешении, как изображено на рис. 5-28, а, б. Было известно, что фрагмент миозина S1 связывается с актином и гидролизует АТР, но постоянно велись дебаты по поводу участка в молекуле миозина, в котором возникает сокращение. Были предложены две конкурирующие модели, описывающие механизм возникновения сокращения в молекуле миозина.
В «шарнирной модели» фрагмент S1 связывался с актином, но тяговое усилие создавалось в результате сокращения «шарнирного участка» в хвосте молекулы миозина. Шарнирный участок расположен в области тяжелого меромиозина, примерно там, где трипсин отщепляет легкий меромиозин (см. рис. 5-27, б). На рис. 5-27, а этой области соответствует подпись «две суперскрученные α-спирали». В «модели S1» предполагалось, что тяговое усилие формируется в самой S1 -«головке», а «хвост» служит лишь для поддержания структуры молекулы.
Было проведено множество экспериментов, но окончательно механизм сокращения понят не был. В 1987 г. Джеймс Спудич и его сотрудники из Стэнфордского университета опубликовали работу, которая хотя и не дала окончательного ответа на вопрос, но указала путь его решения.
Техника рекомбинантных ДНК не была тогда развита настолько, чтобы изучать механизм сокращения в условиях in vivo, поэтому Спудич с сотрудниками предложили интересную модель для исследований in vitro. Водоросль Nitella имеет чрезвычайно длинные клетки — часто до нескольких сантиметров в длину и около 1 мм в диаметре. Волокна актина протянуты вдоль длинной оси этих клеток, так что клетки можно разрезать вдоль таким образом, чтобы увидеть волокна. Спудич обнаружил, что в присутствии АТР покрытые миозином пластиковые шарики перемещаются вдоль актиновых волокон, точно так, как миозин в сокращающейся мышце.
Было предложено усовершенствовать способ прикрепления миозина к шарикам. «Шариками» служили агрегаты убитых бактерий Staphylococcus aureus. На поверхности этих клеток находится белок, который связывается с Fc-фрагментом антител (рис. 5-21, а). Антитела, в свою очередь, связываются с несколькими (неизвестными) участками в «хвосте» молекулы миозина. Комплекс, состоящий из шариков, антител и интактных молекул миозина, в присутствии АТР перемещался вдоль актиновых волокон клеток Nitella.
а) Изобразите схематично, как на молекулярном уровне мог бы выглядеть комплекс шарики- антитела-миозин.
б) Почему для перемещения шариков вдоль актиновых волокон необходим АТР?
в) Спудич с сотрудниками использовали антитела, связывающиеся с «хвостом» молекулы миозина. Почему этот эксперимент не удался бы, если бы они использовали антитела, связывающиеся с «головкой» S1, которая обычно связана с актином? Почему эксперимент не удался бы, если бы они использовали антитела, связывающиеся с актином?
Чтобы понять, в какой части молекулы миозина возникает движущая сила сокращения, Спудич с сотрудниками использовали трипсин, расщепляющий миозин на две части (см. рис. 5-27):
1) тяжелый меромиозин (НММ), образующийся при краткосрочном воздействии трипсина, и
2) короткий тяжелый меромиозин (SHMM), образующийся при более длительной обработке НММ трипсином. НММ содержит в себе «головку» S1 и часть «хвоста», включая шарнирную область; SHMM содержит «головку» S1 и более короткий участок «хвоста» — без шарнирной области. При краткосрочном действии трипсина в результате расщепления единственной пептидной связи в молекуле миозина образуются НММ и легкий меромиозин (рис. 5-27).
г) Почему трипсин в первую очередь атакует именно эту пептидную связь в молекуле миозина?
Спудич с сотрудниками приготовили комплексы шариков, антител и миозина, варьируя количество миозина, НММ и SHMM, и измеряли скорость их перемещения вдоль актиновых волокон Nitella в присутствии АТР. Ниже на графике схематично представлены результаты этого эксперимента.
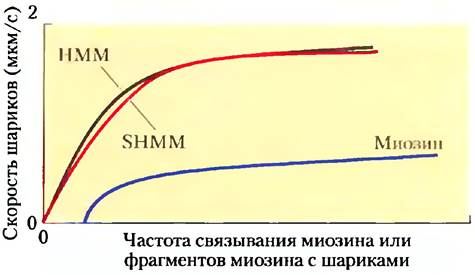
д) Какая из моделей («S1» или «шарнирная модель») согласуется с полученными результатами? Объясните свой ответ.
е) Объясните, почему скорость перемещения шариков возрастала с увеличением плотности миозина.
ж) Объясните, почему при высокой плотности миозина скорость перемещения шариков больше нс увеличивалась.
При наиболее полном расщеплении трипсином, необходимом для получения SНММ, происходило также расщепление полипептидной цепи миозина в области «головки» S1.
з) Учитывая эту информацию, объясните, каким образом SНММ все же был способен перемещать шарики вдоль актинового волокна.
и) Даже после расщепления цепи третичная структура «головки» S1 в SНММ оставалась неизменной. Объясните, каким образом белок может оставаться интактным и функционировать даже после того, как полипептидная цепь расщеплена и уже не является непрерывной.