ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
Я испытывал бы больше оптимизма по поводу блестящего будущего человечества, если бы оно меньше времени тратило на попытки обмануть Природу, а больше наслаждалось ее сладостью и уважало ее превосходство.
Е. Б. Уайт, Енотовое дерево, 1977
7. УГЛЕВОДЫ И ГЛИКОБИОЛОГИЯ
Углеводы составляют большую часть существующих на Земле биомолекул. Каждый год в результате фотосинтеза свыше 100 млрд т СО2 и Н2О превращаются в целлюлозу и другие растительные продукты. Почти повсеместно определенные углеводы (сахар и крахмал) являются основным пищевым сырьем; окисление углеводов главный путь получения энергии в большинстве нефотосинтезирующих клеток. Нерастворимые высокомолекулярные углеводы выполняют структурную и защитную функцию в клеточных стенках бактерий и растений, а также в соединительных тканях животных. Другие высокомолекулярные углеводы служат смазкой для суставов и участвуют в узнавании и адгезии клеток. Более сложные углеводы полимерной природы, соединенные ковалентными связями с белками или липидами, выполняют функцию сигнальных структур, определяющих внутриклеточную локализацию или метаболическую судьбу этих гибридных молекул, называемых гликоконъюгатами. Данная глава знакомит читателя с основными классами углеводов и гликоконъюгатов, а также с некоторыми примерами их многочисленных структурных и функциональных ролей.
Углеводы — это полигидроксиальдегиды или полигидроксикетоны, либо вещества, образующие эти соединения в результате гидролиза. Для многих, хотя и не для всех, углеводов верна эмпирическая формула (СН2О)n; некоторые содержат в своем составе также азот, фосфор или серу.
По размеру молекул углеводы делятся на три основных класса: моносахариды, олигосахариды и полисахариды (слово сахарид происходит от греч. sarcharon, что означает сахар). Моносахариды, или простые сахара, представляют собой мономерные молекулы полигидроксиальдегида или полигидроксикетона. Наиболее распространенным в природе моносахаридом является шестиуглеродный сахар D-глюкоза, которую иногда называют декстрозой. Моносахариды, в составе которых более четырех атомов углерода, обычно образуют циклические структуры.
Олигосахариды представляют собой короткие цепи, построенные из моносахаридных звеньев, или остатков, соединенных гликозидными связями. Наиболее распространены дисахариды, состоящие из двух моносахаридных звеньев. Типичным примером может служить сахароза (тростниковый сахар), состоящая из шестиуглtродных сахаров D-глюкозы и D-фруктозы. Названия всех моно- и дисахаридов оканчиваются на «оза». Большинство олигосахаридов, состоящих из трех и большего числа остатков, находятся в клетке не в свободном состоянии, а в виде соединений с другими молекулами (белками или липидами), образуя гликоконъюгаты.
Полисахаридами называют полимеры сахаров, состоящие из 20 и большего числа моносахаридных звеньев; некоторые полисахариды содержат сотни и даже тысячи таких единиц. Некоторые полисахариды, такие как целлюлоза, представляют собой линейные цепи, другие, например, гликоген, имеют разветвленное строение. Как гликоген, так и целлюлоза построены из повторяющихся звеньев D-глюкозы, но они различаются типом гликозидной связи и из-за этого характеризуются совершенно разными свойствами и выполняют разные биологические функции.
7.1. Моносахариды и дисахариды
Самые простые углеводы — моносахариды; по своей химической структуре это альдегиды или кетоны с двумя или большим числом гидроксильных групп; шестиуглеродные моносахариды глюкоза и фруктоза содержат по пять гидроксильных групп. Многие атомы углерода, несущие гидроксильные группы, представляют собой хиральные центры, поэтому в природе встречается большое количество различных стереоизомеров сахаров. Мы начнем с описания семейств моносахаридов, углеродный скелет которых содержит от трех до семи атомов углерода, и обсудим их структуру, стереоизомерные формы, а также способы графического изображения их трехмерных структур. Затем перейдем к рассмотрению некоторых химических реакций с участием карбонильных групп моносахаридов. Одна из таких реакций — присоединение гидроксильной группы из той же самой молекулы, что приводит к образованию циклических форм пяти- и шестиуглеродных сахаров (именно эти формы преобладают в водных растворах) и возникновению новых хиральных центров, что еще больше усложняет стереохимические свойства этого класса веществ. В связи с этим мы довольно подробно остановимся на номенклатуре, используемой для однозначного определения положения каждого атома углерода в циклической структуре, а также на способах графического изображения этих структур. Данная информация будет полезной при обсуждении метаболизма моносахаридов в части II. Кроме того, мы познакомим читателя с некоторыми важными производными моносахаридов, речь о которых пойдет далее.
Существует два семейства моносахаридов — альдозы и кетозы
Моносахариды — это бесцветные кристаллические вещества, которые легко растворяются в воде, но не растворяются в неполярных растворителях. Большинство моносахаридов имеет сладкий вкус. Углеродный остов типичных моносахаридов образует неразветвленную цепь, в которой все атомы углерода связаны между собой одинарными связями. В открытой форме молекулы один из атомов углерода связан двойной связью с атомом кислорода, т. е. образует карбонильную группу; все остальные атомы углерода несут гидроксильные группы. Если карбонильная группа расположена на конце углеродной цепочки (альдегидная группа), то такой моносахарид называется альдозой; если карбонильная группа занимает любое другое положение (кетонная группа), то моносахарид называется кетозой. Самые простые моносахариды содержат по три атома углерода; это два трехуглеродных сахара — альдотриоза глицеральдегид и кетотриоза дигидроксиацетон (рис. 7-1, а).
Рис. 7-1. Представители моносахаридов, а) Две триозы — альдоза и кетоза. Карбонильная группа каждого соединения выделена цветом. б) Две часто встречающиеся гексозы. в) Пентозы — компоненты нуклеиновых кислот. D-рибоза входит в состав рибонуклеиновых кислот (РНК), а 2-дезокси-D-рибоза является компонентом дезоксирибонуклеиновых кислот (ДНК).
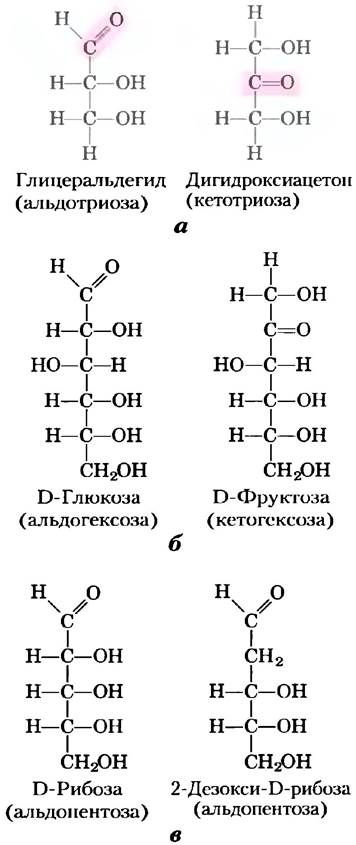
Моносахариды с четырьмя, пятью, шестью и семью атомами углерода называются соответственно тетрозами, пентозами, гексозами и гептозами. Каждый из таких моносахаридов может существовать как в форме альдегида, так и в форме кетона, образуя альдотетрозы и кетотетрозы, альдопентозы и кетопентозы, альдогексозы и кетогексозы и т. д. Гексозы, к которым относятся альдогексоза D-глюкоза и кетогексоза D-фруктоза (рис. 7-1, б), — наиболее распространенные в природе моносахариды. Альдопентозы D-рибоза и 2-дезокси-D-рибоза (рис. 7-1, о) входят в состав нуклеотидов и нуклеиновых кислот (гл. 8).
Моносахариды содержат асимметрические атомы
Все моносахариды, за исключением дигидроксиацетона, содержат один или несколько асимметрических (хиральных) атомов углерода и существуют в виде оптически активных изомерных форм (с. 36-38). Самая простая альдоза глицеральдегид имеет один хиральный центр (средний атом углерода) и, следовательно, может присутствовать в виде двух оптических изомеров, или энантиомеров (рис. 7-2).
Рис. 7-2. Три способа изображения двух стереоизомеров глицеральдегида. Стереоизомеры представляют собой зеркальные отражения друг друга. Шаростержневая модель отражает реальную конфигурацию молекул. По договоренности в проекционных формулах Фишера горизонтальными линиями изображают связи, выступающие над поверхностью листа по направлению к читателю; вертикальными линиями изображают связи, уходящие за поверхность листа в сторону от читателя. Вспомните (рис. 1-17), что в перспективном изображении формул связи, направленные в сторону к читателю, изображаются в виде закрашенных стрелок, а уходящие от него — в виде пунктирных стрелок.
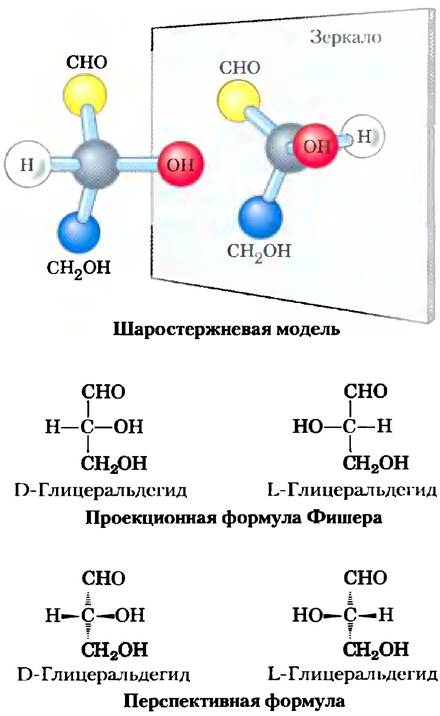
Ключевые договоренности. Правовращающая форма называется D-изомером, левовращающая - L-изомером. Как и в случае других биомолекул с хиральными центрами, абсолютная конфигурация сахаров определяется с помощью методов рентгеновской кристаллографии. Для изображения трехмерной структуры сахаров на плоскости чаще всего пользуются проекционными формулами Фишера (рис. 7-2). В проекционных формулах Фишера горизонтальные линии изображают связи, выходящие из плоскости листа по направлению к читателю; вертикальные линии изображают связи, уходящие за плоскость листа — в сторону от читателя.
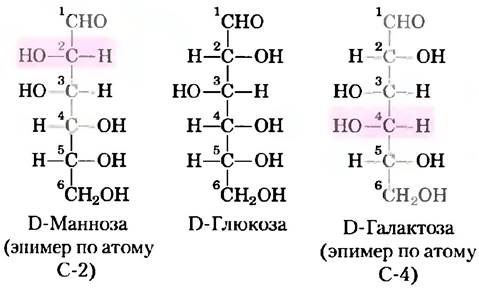
В общем случае, молекулы, содержащие n хиральных центров, могут иметь 2n стереоизомеров. Глицеральдегид имеет 21 = 2 изомера; у альдогексозы с четырьмя хиральными центрами 24 = 16 стереоизомеров. Стереоизомеры моносахаридов с разной длиной цепи можно разделить на две группы, отличающиеся конфигурацией при хиральном центре, наиболее удаленном от карбонильной группы. Те изомеры, конфигурация при хиральном углероде которых соответствует конфигурации D-глицеральдегида, называют D-изомерами, а те, что имеют конфигурацию, как у L-глицеральдегида, — L-изомерами. Если гидроксильная группа при углероде в проекционной формуле изображена справа, то данный сахар является D-изомером, если слева — то это L-изомер. Из 16 возможных альдогексоз восемь являются L-изомерами, а восемь — D-изомерами. Большинство гексоз, встречающихся в живых организмах — D-изомеры. На рис. 7-3 представлены структуры D-стереоизомеров всех альдоз и кетоз с тремя-шестью атомами углерода. Атомы углерода в молекулах сахаров нумеруются, начиная с того конца цепи, который расположен ближе к карбонильной группе. Каждая из восьми D-альдогексоз, различающихся стереохимией атомов С-2, С-3 и С-4, имеет свое собственное название: D-глюкоза, D-галактоза, D-манноза и т. д. (рис. 7-3, а). Названия четырех- и пятиуглеродных кетоз образуются добавлением суффикса «ул» к названиям соответствующих альдоз. Например, D-рибулоза — это кетопентоза, соответствующая альдопентозе D-рибозе. Названия кетогексоз образуются другим способом: например, фруктоза происходит от лат. fructus, что означает фрукт, поскольку фрукты богаты этим сахаром, а сорбоза — от лат. sorbus, что означает рябина, ягоды которой содержат родственный сахароспирт сорбитол. Два сахара, различающиеся между собой только конфигурацией одного атома углерода, называют эпимерами. Так, эпимерами являются D-глюкоза и D-манноза, отличающиеся только стереохимией атома углерода С-2, а также D-глюкоза и D-галактоза, различающиеся стереохимией углерода С-4 (рис. 7-4).
Рис. 7-3. Альдозы и кетозы. С помощью проекционных формул изображены структуры молекул D-альдоз (а) и D-кетоз (б), имеющих от трех до шести атомов углерода. Красным цветом выделены хиральные атомы углерода. Во всех D-изомерах хиральный атом углерода, наиболее удаленный от карбонильного атома углерода, имеет такую же конфигурацию, как хиральный атом углерода в молекуле D-глицеральдегида. Названия наиболее часто встречающихся в природе сахаров обведены рамкой.
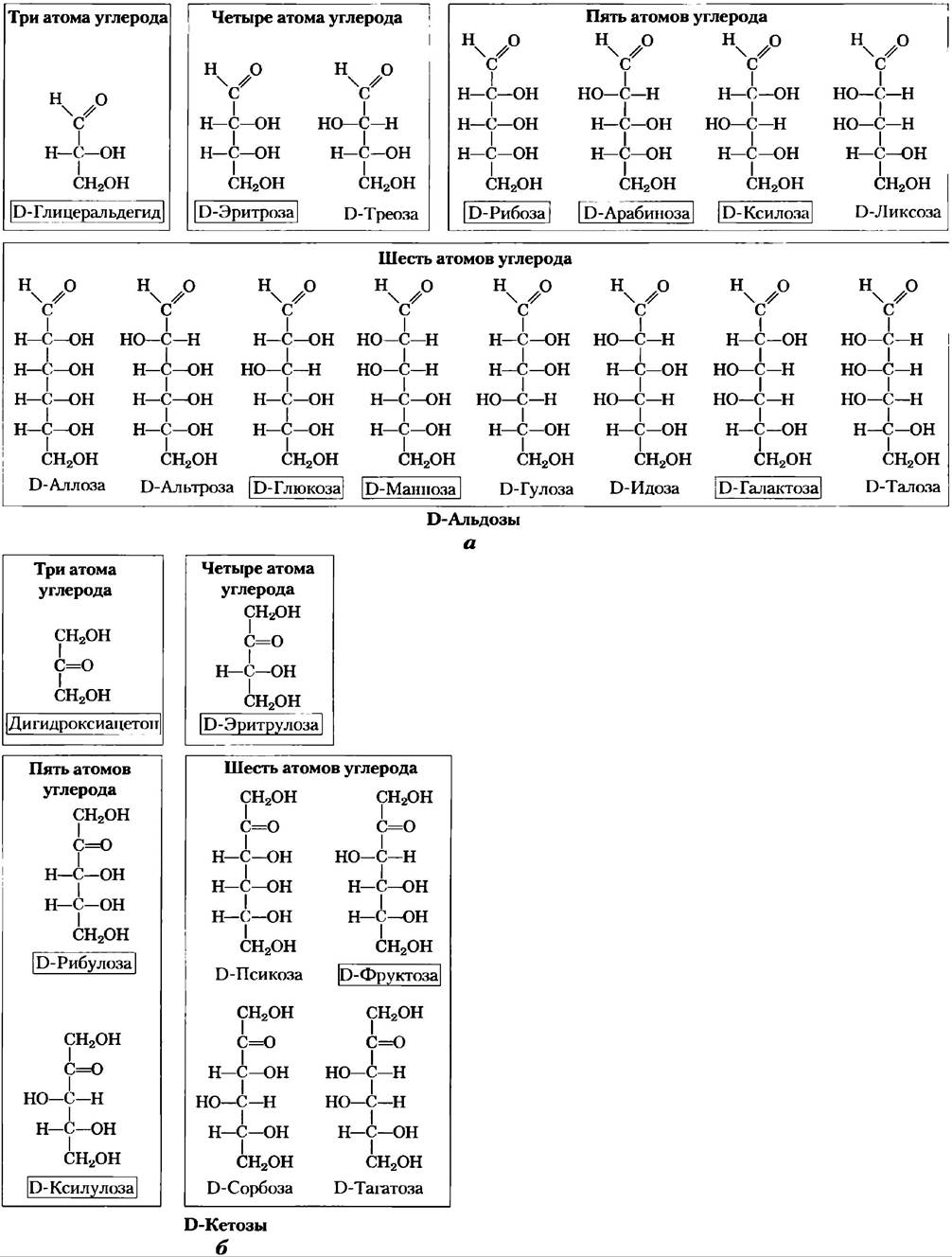
Рис. 7-4. Эпимеры. D-глюкоза и два ее эпимера изображены с помощью проекционных формул. Каждый эпимер отличается от D-глюкозы конфигурацией одного хирального центра (выделен цветом).
Некоторые сахара встречаются в природе в L-форме. Примером может служить L-арабиноза и L-изомеры некоторых производных сахаров, входящих в состав гликоконъюгатов (разд. 7-3).
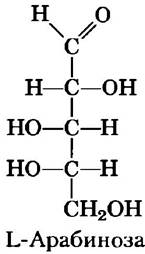
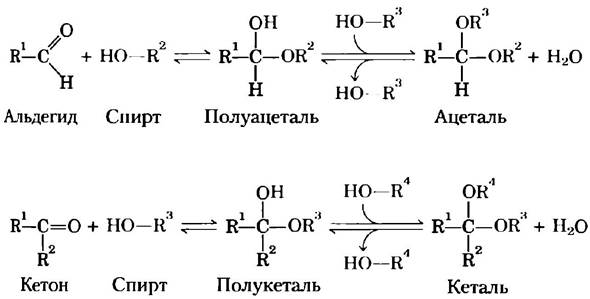
Обычные моносахариды имеют циклическую структуру
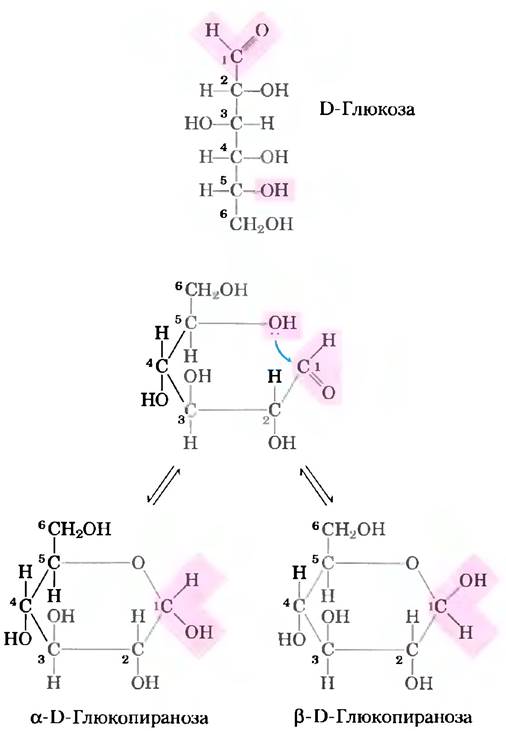
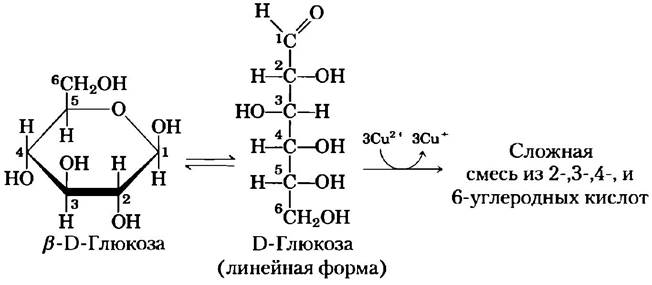
Для простоты мы до сих пор изображали все альдозы и кетозы как линейные молекулы (рис. 7-3, 7-4). На самом же деле в водном растворе альдотетрозы и все моносахариды с большим числом атомов углерода в цепи преимущественно существуют в виде циклических (кольцевых) молекул, в которых карбонильная группа образует ковалентную связь с кислородом гидроксильной группы той же молекулы. Образование таких кольцевых структур — это частный случай реакции между спиртами и альдегидами или кетонами, приводящей к образованию полуацеталей и полукеталей (рис. 7-5), которые содержат еще один асимметрический атом и, следовательно, могут находиться в двух стереоизомерных формах. Например, D-глюкоза существует в растворе в виде внутримолекулярного полуацеталя, в котором свободная гидроксильная группа у атома С-5 прореагировала с альдегидной группой у атома С-1, в результате чего атом углерода С-1 стал асимметрическим; два образующихся стереоизомера обозначают буквами α и β(рис. 7-6). Подобные шестичленные кольца называют пиранозами, поскольку они напоминают шестичленный цикл пирана (рис. 7-7). В соответствии с систематической номенклатурой две кольцевые структуры, образуемые D-глюкозой, называются α-D-глюко- пираноза и β-D-глюкопираноза.
Рис. 7-5. Образование полуацеталей и полукеталей. Альдегиды и кетоны могут взаимодействовать со спиртами в соотношении 1:1, образуя при этом полуацетали и полукетали соответственно, содержащие дополнительный хиральный центр. Присоединение второй молекулы спирта приводит к образованию ацеталей и кеталей. Если вторая спиртовая группа является частью молекулы другого сахара, то образующаяся связь называется гликозидной связью.
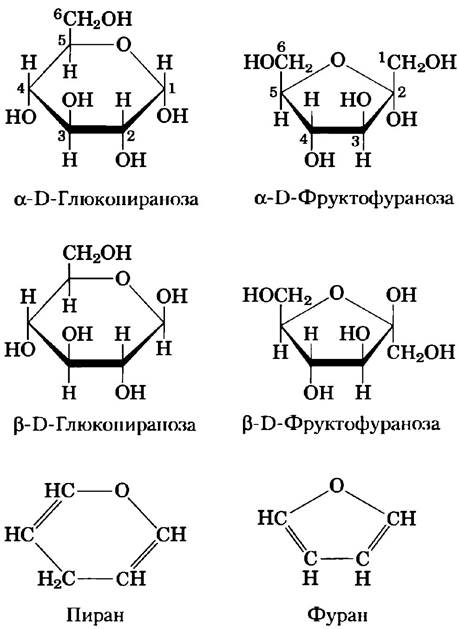
Альдогексозы могут существовать и в другой циклической форме (пятичленное кольцо). Такие структуры из-за сходства с пятичленным циклом фурана называют фуранозами.Однако шестичленные альдопиранозные циклы гораздо более устойчивы, чем альдофуранозные, и поэтому преобладают в растворах альдогексоз. Пиранозные циклы могут образовывать только те альдозы, в молекулах которых содержится более пяти атомов углерода.
Изомерные формы моносахаридов, различающиеся лишь конфигурацией полуацетального или полукетального атома углерода, называют аномерами, а полуацетальный (карбонильный) атом углерода называют аномерным. В растворе α- и β-аномсрные формы переходят друг в друга в процессе мутаротации (рис. 7-6). Таким образом, растворы α-D-глюкозы и β-D-глюкозы в конце концов образуют однородную равновесную смесь с одинаковыми оптическими свойствами. Эта смесь состоит приблизительно из одной трети α-D-глюкозы и двух третей β-D-глюкозы; кроме того, очень небольшое количество глюкозы присутствует в виде линейной формы и в виде пятичленного кольца (глюкофуранозы).
Рис. 7-6. Образование двух циклических форм D-глюкозы. Реакция между альдегидной группой у атома С-1 и гидроксильной группой у атома С-5 приводит к образованию полуацеталя, имеющего два стереоизомера (α- и β-аномеры), различающихся только стереохимическими свойствами углерода С-1. Взаимные превращения α- и β-аномеров называют мутаротацией.
Кетогексозы также существуют в виде α- и β-аномеров. В этих соединениях гидроксильная группа у атома С-5 (или С-6) реагирует с кето- группой у атома С-2, что приводит к образованию фуранозного (или пиранозного) кольца, содержащего иолукетальную связь (рис. 7-5). D-Фруктоза легко образует фуранозные циклы (рис. 7-7); наиболее распространенной аномерной формой этого сахара является β-D-фруктофураноза.
Рис. 7-7. Пираноэы и фуранозы. Пиранозные формы D-глюкозы и фуранозные формы D-фруктозы изображены с помощью проекционных формул Хеуорса. Та сторона цикла, которая расположена ближе к читателю, показана толстой линией. Гидроксильные группы, расположенные в данных формулах под плоскостью цикла, соответствуют тем, что расположены справа в проекционных формулах Фишера (ср. рис. 7-6). Внизу для сравнения представлены формулы пирана и фурана.
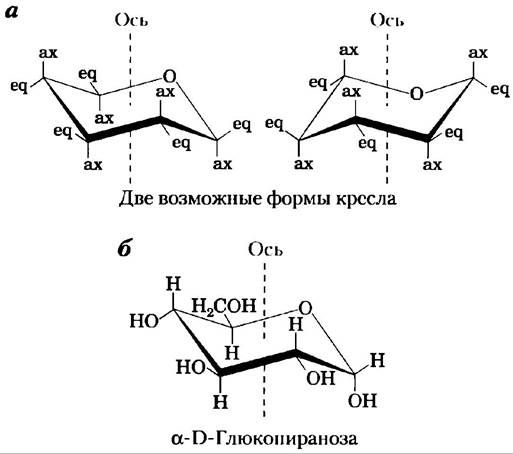
Для изображения циклических форм моносахаридов обычно используют проекционные формулы Хеуорса, подобные тем, что показаны па рис. 7-7. Следует иметь в виду, что шестичленное пиранозное кольцо не лежит в одной плоскости, как представляет проекция Хеуорса, а имеет форму кресла (рис. 7-8). Вспомните (из гл. 1), что конформациями называются различные формы молекулы, которые она может принимать без разрыва ковалентной связи, в то время как конфигурациями называют состояния молекулы, взаимные переходы между которыми возможны только в результате разрыва ковалентной связи. Так, взаимный переход между α- и β-конфигурациями осуществляется с разрывом связи у атома кислорода в составе кольца. Как мы увидим далее, биологические свойства и функции многих полисахаридов определяются в значительной мере особенностями конформаций составляющих их моносахаридных звеньев.
Рис. 7-8. Конформационные формулы пираноэы. а) Две возможные конформации кресла пиранозного кольца. Заместители у атомов углерода в кольце могут быть либо аксиальными (ах), расположенными параллельно вертикальной оси, проходящей через кольцо, либо экваториальными (еq), т. е. расположенными примерно перпендикулярно к направлению оси. Две конформации, изображенные на рисунке, не могут свободно переходить одна в другую без разрыва кольца. Однако при напряжении молекулы (по данным исследования методом атомно-силовой микроскопии, см. доп. 11-1) приток энергии примерно 46 кДж/моль сахара может обеспечить взаимопревращения двух форм. В целом заместители в экваториальной позиции меньше подвергаются стерическим воздействиям соседних групп, поэтому если в молекуле имеются объемные заместители, то предпочтение отдается конформеру, у которого они расположены в экваториальной позиции. Еще одна возможная конформация — ванна (здесь не показана) — наблюдается только в молекулах с очень громоздкими заместителями. б) α-D-Глюкопираноза, имеющая наиболее выгодную конформацию кресла.
Живые организмы содержат множество производных гексозы
Кроме простых гексоз, таких как глюкоза, галактоза и манноза, существует ряд производных, в которых либо гидроксильная группа исходного соединения заменена другой, либо атом углерода окислен до образования карбоксильной группы (рис. 7-9). В глюкозамине, галактозамине и маннозамине гидроксил у атома С-2 в исходной молекуле сахара заменен аминогруппой. Аминогруппа практически всегда конденсирована с уксусной кислотой, например, как в N-ацетилглюкозамине. Это соединение входит в состав многих структурных полимеров, в том числе и тех, что образуют клеточную стенку бактерий. Последняя содержит еще одно производное глюкозамина — N-ацетилмурамовую кислоту. В этом соединении кислород у атома С-3 N-ацетилглюкозамина связан эфирной связью с молочной кислотой (одной из трехуглеродных карбоновых кислот). Замена гидроксильной группы на водород у атома С-6 в молекуле L-галактозы или L-маннозы приводит к образованию соответственно L-фукозы или L-рамнозы. L-фукоза обнаружена в сложных олигосахаридных компонентах гликопротеинов и гликолипидов, а L-рамноза — в составе растительных полисахаридов.
Рис. 7-9. Производные гексоз, имеющие важное биологическое значение. В аминосахарах одна из -ОН-групп гексозы замещается на -NH3. При замене -ОН на -Н возникают дезокси- сахара; эти дезоксисахара встречаются в природе в виде L-изомеров. Кислые сахара содержат карбоксильную группу, благодаря чему при нейтральных pH имеют отрицательный заряд. D-Глюконо-δ-лактон образуется в результате возникновения эфирной связи между карбоксильной и гидроксильной группами у атома углерода С-5 (δ-углерода) в D-глюконате.
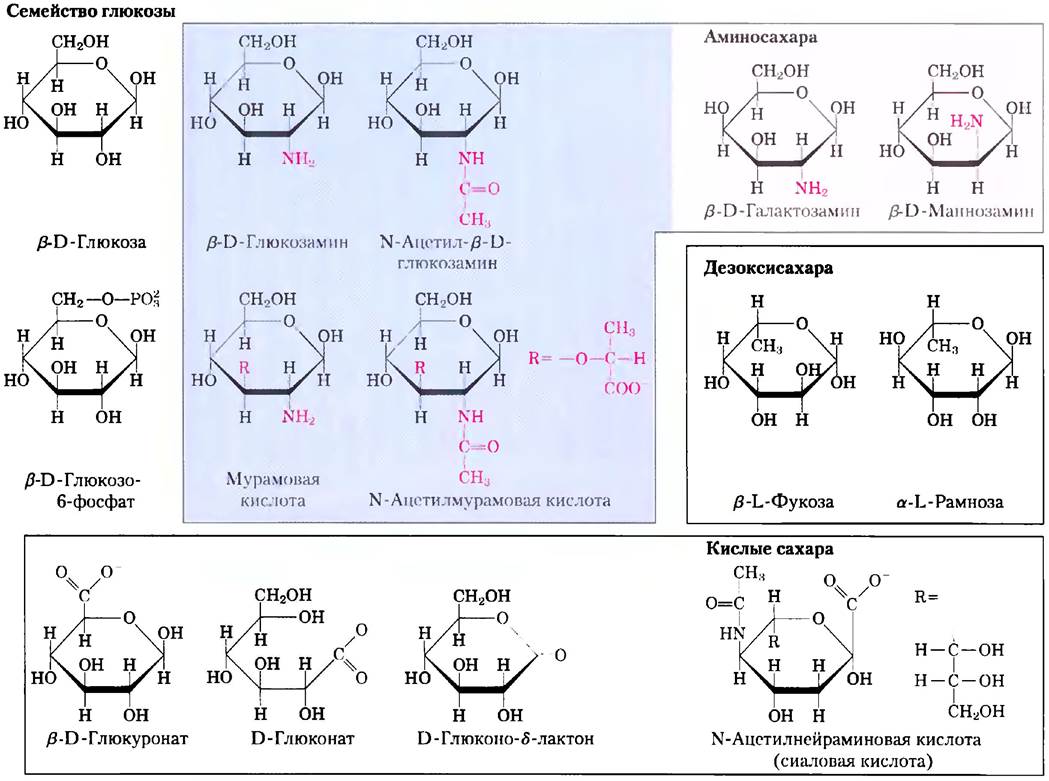
Окисление карбонильного (альдегидного) углерода глюкозы до карбоксильной группы приводит к образованию глюкоиовой кислоты; при окислении других альдоз образуются соответствующие альдоновые кислоты. Окисление углерода на противоположном конце молекулы (атома С-6 глюкозы, галактозы или маннозы) ведет к образованию соответствующих уроновых кислот — глюкуроновой, галакт- уроновой или маннуроновой. Как альдоновые, так и уроновые кислоты образуют устойчивые внутримолекулярные эфиры — лактоны (рис. 7-9, слева внизу). Кроме перечисленных кислых производных гексоз стоит упомянуть один девятиуглеродный сахар — N-ацетилнейраминовую кислоту (одна из сиаловых кислот, часто называемая просто сиаловой кислотой). N-ацетил- нейраминовая кислота представляет собой производное N-ацетилманнозамина и входит в состав многих гликопротеинов и гликолипидов в клетках животных. Карбоксильные группы кислых производных сахаров при pH 7,0 находятся в ионизованном состоянии, поэтому эти соединения следует называть по аналогии с карбоксилатами — глюкуронат, галактуронат и т. д.
Интермедиатами в синтезе и при метаболизме углеводов очень часто являются не сахара, а их фосфорилированные производные. Реакция конденсации фосфорной кислоты с одной из гидроксильных групп сахара приводит к образованию эфира фосфорной кислоты, например, глюкозо-6-фосфата (рис. 7-9). Фосфаты сахаров довольно устойчивы при нейтральных значениях pH и несут на себе отрицательный заряд. Одним из результатов фосфорилирования является удерживание сахаров в клетке; в большинстве клеток отсутствуют системы транспорта фосфорилированных сахаров через плазматическую мембрану. Кроме того, фосфорилирование активирует сахара для дальнейших химических превращений. Некоторые фосфорилированные производные сахаров являются важными компонентами нуклеотидов (они обсуждаются в следующей главе).
Моносахариды — это восстановители
■ Моносахариды окисляются довольно мягкими окислителями, например, ионами Fе3+ или Сu2+ (рис. 7-10). При этом карбонильная группа окисляется до карбоксильной. Глюкозу и другие сахара, способные восстановить ионы Fе3- или Сu2+, называют восстанавливающими сахарами. Они образуют ендиолы, которые превращаются в альдоновые кислоты, а затем в сложную смесь 2-, 3-, 4- и 6-углеродных кислот. Это свойство лежит в основе нескольких методов количественного определения восстанавливающих сахаров. Измеряя количество окислителя, восстановленного раствором сахара, можно определить концентрацию сахара. Многие годы подобные тесты использовались для обнаружения и количественного определения глюкозы в крови и моче при диагностике сахарного диабета (доп. 7-1). ■
Рис. 7-10. Сахара как восстанавливающие агенты. В основе реакции Фелинга лежит окисление аномерного атома углерода в молекуле глюкозы или других сахаров. В щелочных условиях ионы меди Сu+ образуют осадок оксида меди красного цвета. В форме полуацеталя (в циклической форме) атом С-1 глюкозы не окисляется ионами Сu2+. Однако между линейной и циклической формами существует равновесие, поэтому в конечном итоге реакция проходит до конца. Взаимодействие с ионами Сu2+ сложное, приводит к образованию смеси продуктов и требует 3 моль Сu2+ на 1 моль глюкозы.
Дисахариды содержат гликозидную связь
Дисахариды (мальтоза, лактоза, сахароза) состоят из двух моносахаридов, связанных между собой ковалентной О-гликозидной связью, образующейся при взаимодействии гидроксильной группы одной молекулы сахара с аномерным атомом углерода другой молекулы (рис. 7-11). При этом из полуацеталя (например, глюкопиранозы) и спирта (гидроксильной группы второй молекулы сахара) образуется ацеталь (рис. 7-5). Гликозидные связи легко гидролизуются в кислой среде, но устойчивы к действию оснований. При кипячении в разбавленной кислоте дисахариды гидролизуются, высвобождая составляющие их моносахаридные компоненты. N-гликозидная связь соединяет аномерный атом углерода сахара с атомом азота в гликопротеинах (рис. 7-29) и нуклеотидах (рис. 8-1).
Дополнение 7-1. МЕДИЦИНА. Определение уровня глюкозы в крови при диагностике и лечении диабета
Глюкоза является основным источником энергии для головного мозга. Нарушение снабжения мозга глюкозой может иметь угрожающие последствия: летаргическое состояние, кома, необратимое повреждение мозга и смерть (рис. 23-25). У животных существует сложный гормональный механизм, обеспечивающий достаточно высокое содержание глюкозы в крови (около 5 мМ), чтобы удовлетворять потребностям головного мозга, но не слишком высокое, поскольку избыток глюкозы в крови может также приводить к серьезным физиологическим последствиям.
В организме людей, страдающих инсулинозависимым сахарным диабетом, производится недостаточное количество гормона инсулина, который в норме служит для снижения концентрации глюкозы в крови. Если диабет не лечить, концентрация глюкозы в крови больных может в несколько раз превысить норму. Высокое содержание глюкозы в крови является одной из причин таких серьезных последствий прогрессирующего диабета, как почечная недостаточность, сердечно-сосудистые заболевания, слепота, а также приводит к нарушению процесса заживления ран. Поэтому одной из задач при лечении диабета является обеспечение достаточного содержания инсулина в организме (путем инъекций), поддерживающего нормальный уровень глюкозы в крови. Для определения оптимального рациона питания, физической нагрузки и режима введения препарата необходимо несколько раз в день измерять концентрацию глюкозы в крови и соответствующим образом корректировать вводимую дозу инсулина.
Концентрацию глюкозы в крови можно найти с помощью простого метода для определения концентрации восстанавливающих сахаров, например, с помощью метода Фелинга, который на протяжении многих лет применялся в качестве диагностического теста при подозрении на диабет (рис. 7-10). Для современного анализа требуется лишь капелька крови, которую помещают на тест-полоску с глюкозооксидазой (рис. 1); простой фотометр регистрирует развитие окраски, которая возникает в результате реакции красителя с Н2O2, выделяющейся в результате ферментативной реакции, и определяет концентрацию глюкозы в крови.
Рис. 1. Реакция, катализируемая глюкозооксидазой, используется для определения концентрации глюкозы в крови. Второй фермент — пероксидаза — катализирует реакцию Н2O2 с бесцветным субстратом, приводящую к образованию окрашенного продукта, концентрацию которого измеряют с помощью спектрофотометра.
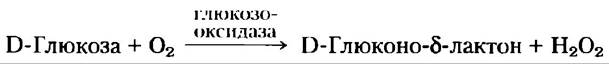
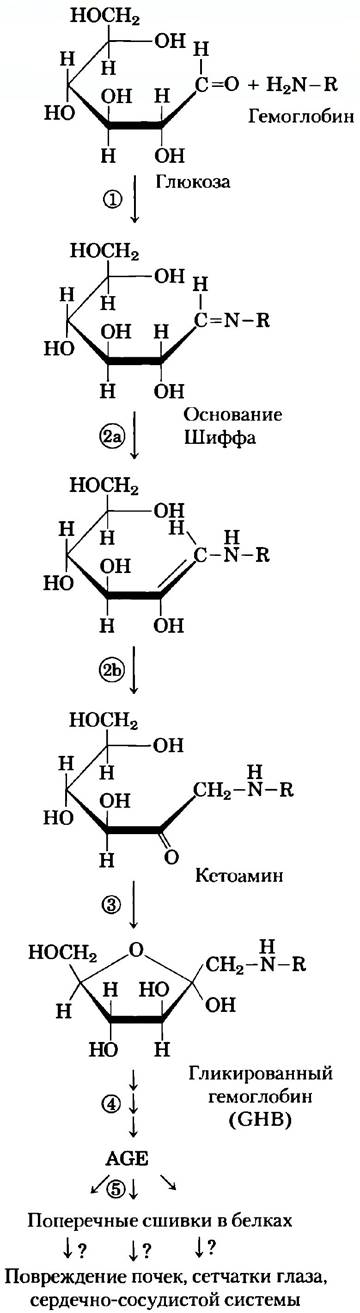
Уровень глюкозы в крови меняется после еды и интенсивной физической нагрузки, так что единственное измерение не обязательно отражает среднее значение концентрации глюкозы за сутки или за несколько дней, и опасное превышение нормы может оказаться незамеченным. Среднее значение концентрации глюкозы можно установить путем изучения состояния гемоглобина — переносящего кислород белка, содержащегося в эритроцитах (с. 233). Функция этого белка-переносчика в мембране эритроцита состоит в выравнивании концентрации глюкозы внутри клеток и в плазме крови, так что гемоглобин постоянно доступен для связывания с глюкозой, вне зависимости от ее концентрации в крови. Между глюкозой и первичной аминогруппой гемоглобина (аминогруппа N-концевого остатка валина или ε-аминогруппа остатка лизина; см. рис. 2) происходит неферментативная реакция. Скорость этой реакции пропорциональна концентрации глюкозы, так что эту реакцию можно использовать для оценки средней концентрации глюкозы в крови за несколько недель. Содержание гликированного гемоглобина (GHb) в каждый момент времени отражает среднюю концентрацию глюкозы в крови для периода, соответствующего продолжительности жизни эритроцита (около 120 дней), хотя при установлении уровня GHb наиболее важен показатель для двух последних недель.
Степень гликирования гемоглобина (гликированием, в отличие от гликозилирования, называют неферментативный перенос глюкозы на молекулу белка) в клинической практике измеряют путем экстрагирования гемоглобина из небольшого образца крови и электрофоретического разделения GHb и немодифицированного гемоглобина (разделение основано на различии зарядов, которое возникает в результате модификации аминогрупп). В норме GHb составляет около 5% общего содержания гемоглобина (что соответствует концентрации глюкозы в крови 120 мг / 100 мл). У больных диабетом в отсутствие лечения, это значение может достигать 13%, что отражает повышение концентрации глюкозы в крови до опасного уровня 300 мг / 100 мл. Один из критериев правильного выбора индивидуальной программы введения инсулина (время инъекции, частота введения и доза) — это поддержание GHb на уровне 7%.
В процессе гликирования гемоглобина за первой стадией реакции (образование основания Шиффа) следует ряд перегруппировок с окислением и отщеплением молекул воды, что приводит к образованию гетерогенной смеси продуктов AGE (advanced glycation end products). Эти продукты могут выходить из эритроцитов и образовывать перекрестные сшивки с белками, мешая нормальному функционированию белков (рис. 2). Накопление сравнительно большого количества AGE у больных диабетом может приводить к нарушению работы почек, сетчатки глаза и сердечно-сосудистой системы. Ведется поиск лекарственных препаратов, способных воздействовать на этот разрушительный процесс в организме.
Рис. 2. Неферментативная реакция глюкозы с первичной аминогруппой в гемоглобине: 1) образование основания Шиффа; 2) перегруппировка Амадори с образованием устойчивого продукта; 3) циклизация кетоамина с образованием GHb; 4) в последующих реакциях возникают конечные продукты гликирования (AGE), такие как E-N-карбоксиметиллизин и метилглиоксаль; 5) эти вещества могут мешать функционированию других белков, образуя с ними перекрестные сшивки, что вызывает серьезные патологические изменения в организме.
Аномерный атом углерода окисляется ионами Fе3+ или Сu2+ (реакция для определения восстанавливающих сахаров) только в линейной молекуле, находящейся в равновесии с циклической формой. Если аномерный атом участвует в образовании гликозидной связи, то остаток сахара не может перейти в линейную форму и становится невосстанавливающим. В дисахаридах и в целом в полисахаридах конец углеводной цепи, на котором расположен свободный аномерный атом углерода (не связанный гликозидной связью), называют восстанавливающим концом.
Дисахарид мальтоза (рис. 7-11) состоит из двух остатков D-глюкозы, соединенных гликозидной связью между атомом С-1 (аномерным атомом) одного остатка глюкозы и атомом С-4 другого остатка. Поскольку в этом дисахариде сохраняется свободный аномерный атом (С-1 в правом остатке глюкозы на рис. 7-11), мальтоза является восстанавливающим сахаром. Аномерный атом углерода в гликозидной связи имеет α-конфигурацию. Второй остаток глюкозы со свободным аномерным атомом углерода может существовать как в α-, так и в β-форме.
Рис. 7-11. Образование мальтозы. Дисахарид образуется из двух моносахаридов (в данном случае двух молекул D-глюкозы), причем -ОН-группа (спиртовая) одной молекулы глюкозы (справа) реагирует с внутримолекулярным полуацеталем другой молекулы (слева) с высвобождением молекулы Н2O и образованием O-гликозидной связи. Обратная реакция (гидролиз) представляет собой атаку гликозид- ной связи молекулой воды. Молекула мальтозы сохраняет восстанавливающие свойства поскольку один аномерный атом С-1 не участвует в формировании гликозидной связи. Мутаротация приводит к взаимопревращениям α- и β-форм полуацеталя (что иногда как здесь, изображают с помощью волнистой линии), таким образом, этот остаток мальтозы может находиться и в α-, и в β-форме.
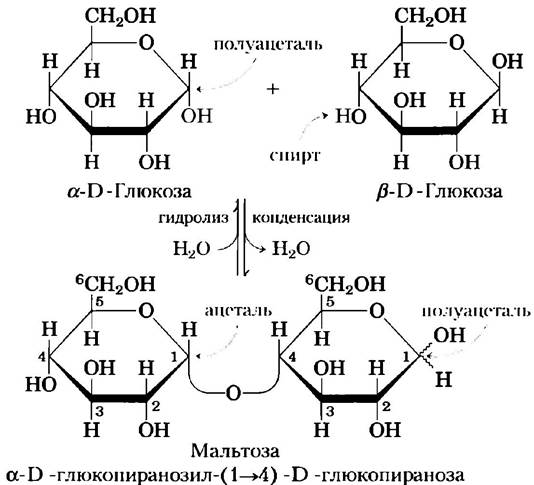
Ключевые договоренности. Существуют определенные правила, в соответствии с которыми следует называть восстанавливающие дисахариды, такие как мальтоза, и в особенности более сложные олигосахариды. По договоренности название относится к соединению, в котором невосстанавливающий конец молекулы расположен слева; название соединения образуется следующим образом. 1) Определяют конфигурацию (α или β) аномерного углерода, связывающего первый моносахаридный остаток (слева) со вторым. 2) Называют невосстанавливающий остаток; для пяти- и шестичленных кольцевых структур используют соответственно корень «фурано» или «пирано». 3) В скобках указывают два атома углерода, соединенные гликозидной связью, и соединяют эти цифры стрелкой; например, запись (1-»4) означает, что С-1 в первом остатке сахара соединен с С-4 во втором. 4) Называют второй остаток. Если существует и третий остаток, то вторую гликозидную связь описывают по тем же правилам. Для сокращения названий сложных полисахаридов используют трехбуквенные обозначения моносахаридных звеньев, как показано в табл. 7-1. В соответствии с правилами обозначения олигосахаридов, мальтозу будет правильно назвать α-D-глюкопиранозил-(1 —> 4)-D- глюкопираноза. Поскольку большинство сахаров, о которых пойдет речь в данной книге, являются D-сахарами, а преобладающей формой гексоз является пиранозная, то мы обычно сокращаем формальное название таких соединений, указывая только конфигурацию аномерного углерода и номера соединенных гликозидной связью атомов. При таком способе обозначений мальтоза будет выглядеть как Сlс (α1 —> 4)Glс. ■
Таблица 7-1.

Внимание: обычно гексозы изображают кружочком, N-ацетилгексозамины квадратиком, а гексозамины кружком, разделенным по диагонали. Все сахара с «глюко» конфигурацией - синие, с «галакто» конфигурацией — желтые, с «манно» — зеленые. Другие заместители добавляют к названию по мере необходимости: сульфат (S), фосфат (Р), О-ацетил (ОАс) или О-метил (Ome).
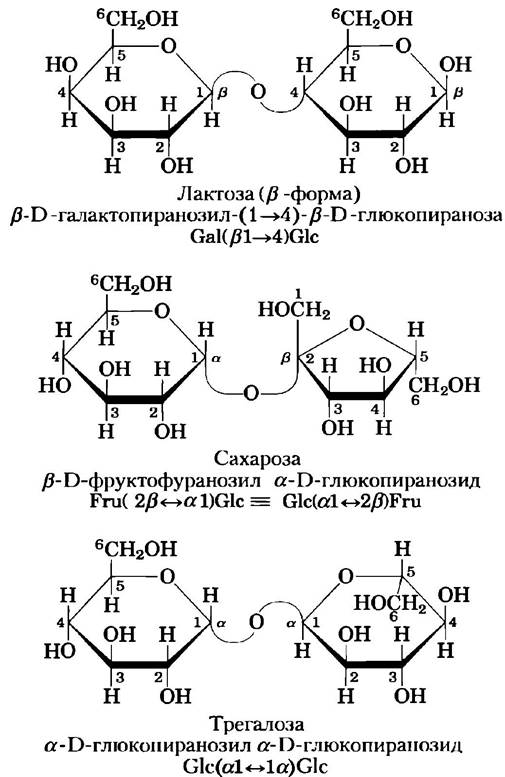
Дисахарид лактоза (рис. 7-12), который при гидролизе распадается на D-галактозу и D-глюкозу, в природе встречается только в молоке. Аномерный атом глюкозного остатка доступен для окисления, поэтому лактоза представляет собой восстанавливающий дисахарид. Сокращенно это соединение можно назвать Саl (β1—> 4) Glс. Сахароза (столовый сахар) — это дисахарид, состоящий из глюкозы и фруктозы. Сахароза образуется в клетках растений, но не в клетках животных. В отличие от мальтозы и лактозы сахароза не содержит свободного аномерного атома; аномерные атомы углерода обоих моносахаридных остатков участвуют в образовании гликозидной связи (рис. 7-12). Следовательно, сахароза не является восстанавливающим сахаром. Невосстанавливающие сахара обозначаются как гликозиды, причем в данном случае гликозидной связью соединены аномерные атомы углерода. В сокращенном названии номера и конфигурации аномерных атомов соединены двунаправленной стрелкой. Например, сокращенно сахарозу можно назвать либо Glс (α1 ⇄ 2β) Fru, либо Fru (β2 ⇄ 1α) Glс. Сахароза — основной промежуточный продукт фотосинтеза; во многих растениях доставка сахара от листьев к другим тканям осуществляется именно в форме сахарозы. Трегалоза Glс (α1 ⇄ 1α) Glс (рис. 7-12) — это дисахарид, построенный из остатков D-глюкозы и, подобно сахарозе, не имеющий восстанавливающей активности. Трегалоза является основным компонентом жидкости, циркулирующей в организме насекомых (гемолимфы), где она служит в качестве запасного источника энергии. Грибы тоже содержат трегалозу, из них этот сахар получают промышленным способом.
Рис. 7-12. Некоторые часто встречающиеся дисахариды. Здесь, как и на рис. 7-11, молекулы изображены с помощью проекционных формул Хеуорса. Для каждого дисахарида приведены тривиальное, полное систематическое и сокращенное названия. По формальной номенклатуре для сахарозы глюкоза является исходным гликозидом, обычно ее изображают, как здесь, с остатком глюкозы слева.
Краткое содержание раздела 7.1 Моносахариды и дисахариды
■ Сахара (или сахариды) — соединения, содержащие альдегидную или кетонную группу и две или большее число гидроксильных групп.
■ Моносахариды обычно содержат несколько хиральных атомов углерода и поэтому существуют в нескольких стереоформах, которые на плоскости можно изобразить с помощью проекционных формул Фишера. Эпимерами называют сахара, различающиеся лишь конфигурацией при одном атоме углерода.
■ Моносахариды часто образуют внутримолекулярные полуацетали или полукетали, в которых альдегидная или кетонная группа связана с гидроксильной группой той же молекулы, в результате чего возникает циклическая структура. Такие структуры изображают с помощью проекционных формул Хеуорса. Атом углерода, исходно принадлежавший альдегидной или кетонной группе (аномерный атом углерода), может находиться в одной из двух конфигураций (α или β), которые переходят друг в друга в процессе мутаротации. В линейной форме моносахарида, находящейся в равновесии с циклической формой, аномерный атом углерода легко окисляется.
■ Гидроксильная группа одного моносахарида может взаимодействовать с аномерным атомом углерода второго моносахарида с образованием ацеталя. В подобном дисахариде гликозидная связь защищает аномерный атом от окисления.
■ Олигосахариды — олигомеры, состоящие из небольшого числа моносахаридных звеньев, соединенных гликозидными связями. На одном конце цепи (восстанавливающем конце) сохраняется аномерный углерод, не участвующий в образовании гликозидной связи.
■ Номенклатура, принятая для обозначений ди- и олигосахаридов, определяет порядок моносахаридных звеньев, конфигурацию каждого аномерного атома и номера атомов углерода, участвующих в образовании гликозидных связей.