ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
6. ФЕРМЕНТЫ
Вопросы и задачи
1. Сохранение сладкого вкуса кукурузы.
Сладкий вкус зерен в свежесобранных початках кукурузы обусловлен высоким содержанием в них сахара. Через несколько дней после сбора кукуруза уже не такая сладкая, поскольку за один день хранения около 50% свободного сахара в зернах превращается в крахмал. Чтобы лучше сохранить сладкий вкус свежесобранной кукурузы, очищенные початки на несколько минут помещают в кипящую воду («бланшируют»), а затем охлаждают в холодной воде. Кукуруза, обработанная таким образом и хранящаяся в замороженном виде, сохраняет свой сладкий вкус. В чем биологический смысл подобной процедуры?
2. Внутриклеточная концентрация ферментов.
Чтобы оценить концентрацию ферментов в бактериальной клетке, предположим, что в цитозоле содержатся равные концентрации 1000 разных ферментов и что молекулярная масса каждого белка составляет 100 000. Кроме того, предположим, что бактериальная клетка представляет по форме цилиндр диаметром 1 мкм и высотой 2 мкм, что цитозоль (плотность 1,20) содержит 20% по массе растворимого белка, и что весь этот белок полностью состоит из ферментов. Рассчитайте среднюю молярную концентрацию каждого фермента в данной гипотетической клетке.
3. Ускорение реакции под действием уреазы.
Фермент уреаза при pH 8,0 и 20 °С ускоряет гидролиз мочевины в 1014 раз. Если заданное количество мочевины может полностью прогидролизовать заданное количество уреазы при pH 8,0 и 20 °С за 5 мин, сколько времени потребовалось бы для гидролиза того же количества мочевины в тех же условиях, но без фермента? Предполагается, что обе реакции происходят в стерильных условиях без доступа бактерий.
4. Защита фермента от тепловой денатурации.
При нагревании раствора фермента происходит постепенная потеря его каталитической активности, что связано с денатурацией фермента. При инкубации раствора гексокиназы в течение 12 мин при 45 °С фермент теряет 50% активности, но если инкубацию проводить в присутствии очень высокой концентрации одного из субстратов, то потеря активности за 12 мин составляет лишь 3%. Объясните, почему тепловая денатурация гексокиназы замедляется в присутствии субстрата.
5. Требования к активным центрам ферментов.
Карбоксипептидаза, последовательно отщепляющая С-концевые аминокислотные остатки своих пептидных субстратов, представляет собой полипептид, состоящий из 307 остатков. Две основные каталитические группы в активном центре фермента — это Arg145и Glu270.
а) Если бы цепь карбоксипептидазы была свернута в идеальную α-спираль, то на каком расстоянии друг от друга (в Â) находились бы остатки Arg145и Glu270. Подсказка: см. рис. 4-4, а.
б) Объясните, каким образом эти две аминокислоты могут катализировать реакцию, происходящую на расстоянии в несколько ангстрем.
6. Количественное определение лактатдегидрогеназы.
Фермент мышц лактатдегидрогеназа катализирует реакцию
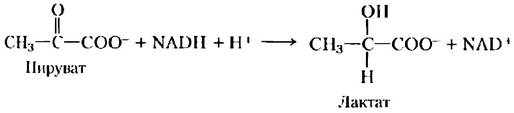
NADH и NAD+ — это соответственно восстановленная и окисленная формы кофермента NAD. Раствор NADH, но не NAD+, поглощает свет с длиной волны 340 нм. Это свойство используется для определения концентрации NADH в растворе с помощью спектрофотометрического измерения поглощения света при 340 нм. Объясните, как данное свойство NADH может быть использовано для количественного определения лактат- дегидрогеназы.
7. Роль фермента в химической реакции.
Какие из перечисленных ниже изменений в ходе простой химической реакции могут быть вызваны присутствием катализатора?
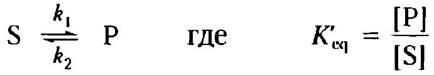
а) Снижение К'eq', б) повышение r1; в) повышение K'eq; г) повышение ∆G*; д) понижение ∆G"; е) более отрицательное значение ∆G'°; ж) повышение r2.
8. Связь между скоростью реакции и концентрацией субстрата: уравнение Михаэлиса- Ментен.
а) При какой концентрации субстрата фермент с rcat = 30 с-1 и Км = 0,005 М будет катали
зировать реакцию со скоростью, равной 1/4 его максимальной скорости?
б) Определите, какая доля Vmах будет достигнута при концентрациях субстрата [S] = 1/2 Км, 2Км и 10 Км.
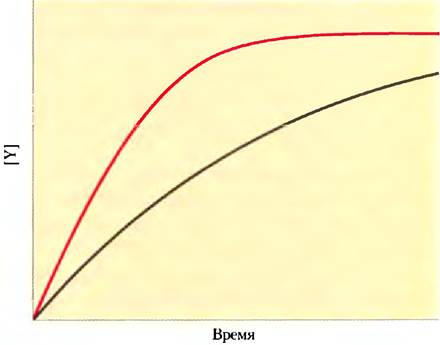
в) Из двух видов бактерий выделили фермент, катализирующий реакцию X ⇄ Y. Ферменты имеют одинаковые значения Vmах, но разные значения Км по отношению к субстрату X. Константа Михаэлиса для фермента А составляет 2,0 мкМ, а для фермента В — 0,5 мкМ. Представленный ниже график иллюстрирует ход реакции под действием ферментов, взятых в одинаковых концентрациях, при [X] = 1 мкМ. Какая кривая какому ферменту соответствует?
9. Применение уравнения Михаэлиса-Ментен (I).
В лаборатории открыта новая версия фермента веселазы, которую назвали веселаза*; фермент катализирует следующую реакцию:
грусть ⇄ веселье
Начато изучение свойств фермента.
а) В первом эксперименте при [Еt] = 4 нМ найдено значение максимальной скорости Vmах = 1,6 мкМ с Зная это, определите константу rat для веселазы* (в соответствующих единицах измерения).
б) Во втором эксперименте при [Еt] = 1 нМ и [веселье] = 30 мкМ было найдено значение начальной скорости реакции v0 = 300 нМ с-1. Каково измеряемое значение Км для веселазы* для субстрата веселье (в соответствующих единицах измерения)?
в) Дальнейшие исследования показали, что очищенная веселаза*, использовавшаяся в двух первых экспериментах, на самом деле содержала примесь обратимого ингибитора, называемого злость. Примесь злости была тщательно удалена из образца фермента, а два эксперимента провели вновь; измеренное в условиях эксперимента (а) значение Vmах составило 4,8 мкМ с-1, а измеренное в условиях эксперимента (б) значение Км оказалось равным 15 мкМ. Рассчитайте параметры а и а' для ингибитора ЗЛОСТЬ.
г) Исходя из представленной выше информации, определите, к какому типу ингибиторов относится злость.
10. Применение уравнения Михаэлиса-Ментен (II).
Найден фермент, катализирующий реакцию
А ⇄ В
Для этого фермента значение константы Михаэлиса Км для субстрата А было равно 4 мкМ, а rcat составила 20 мин-1.
а) В одном эксперименте при концентрации [А] = 6 мМ начальная скорость реакции v0 составила 480 нМ мин-1. Какой была концентрация фермента [Et] в этом эксперименте?
б) В следующем эксперименте при концентрации [Еt] = 0,5 М значение начальной скорости составило 5 мкМ мин-1. Какой была концентрация субстрата [А] в этом эксперименте?
в) Обнаружено, что вещество Z является очень сильным конкурентным ингибитором данного фермента с α = 10. В эксперименте с той же концентрацией фермента [Еt], как в вопросе (а), но при другой концентрации [А] был добавлен ингибитор Z, что привело к снижению скорости v0 до 240 нМ мин-1. Какова концентрация [А] в этом эксперименте?
г) Основываясь на кинетических параметрах, приведенных выше, скажите, достигает ли этот фермент «каталитического совершенства»? Кратко объясните свой ответ, используя кинетический(е) параметр(ы), чтобы определить «каталитическое совершенство».
11. Оценка Vmах и Км по экспериментальным данным.
Хотя существуют методы точного определения Vmах и Км (доп. 6-1), иногда эти параметры можно быстро оценить, просто наблюдая за значением начальных скоростей реакции при разных концентрациях субстрата. Оцените Vmах и Км ферментативной реакции на основании приведенных в таблице данных.
[S] (M) |
v0 (мкМ/мин) |
2,5 • 10-6 |
28 |
4,0 • 10-6 |
40 |
1 • 10-5 |
70 |
2 • 10-5 |
95 |
4 • 10-3 |
112 |
1 • 10-4 |
128 |
2 • 10-3 |
139 |
1 • 10-2 |
140 |
12. Свойства фермента, участвующего в синтезе простагландинов.
Простагландины — это класс эйкозаноидов, т. е. производных жирных кислот, оказывающих чрезвычайно сильное влияние на ткани позвоночных животных. Простагландины (ПГ) связаны с возникновением лихорадки и воспаления, а также с сопутствующими им болевыми ощущениями. Простагландины образуются из 20-углеродной жирной кислоты, называемой арахидоновой кислотой, в результате реакции, которую катализирует фермент простагландин-эндопероксид-синтаза. Этот фермент из класса циклооксигеназ использует кислород для превращения арахидоновой кислоты в ПГ являющийся непосредственным предшественником многих различных простагландинов (синтез простагландинов обсуждается в гл. 21).
а) Ниже представлены кинетические данные для реакции, катализируемой простагландин- эндопероксид-синтазой. Обращая внимание на первые две колонки, определите Vmахи Км для данного фермента.
Концентрация арахидоновой кислоты (мМ) |
Скорость образования ПГ G2 (мМ/мин) |
Скорость образования ПГ G2 в присутствии 10 мг/мл ибупрофена (мМ/мин) |
0,5 |
23,5 |
16,67 |
1,0 |
32,2 |
25,25 |
1,5 |
36,9 |
30,49 |
2,5 |
41,8 |
37,04 |
3,5 |
44,0 |
38,91 |
б) Ибупрофен является ингибитором простагландин-эндопероксид-синтазы. Путем ингибирования синтеза ПГ ибупрофен снижает воспаление и боль. Используя данные первой и третьей колонок, определите тип ингибирования ибупрофеном реакции, катализируемой простагландин-эндопероксид-синтазой.
13. Графический анализ Vmах и Км.
Представленные ниже экспериментальные данные получены при изучении ферментативной активности кишечной пептидазы с глицилглицином в качестве субстрата.
Глицилглицин + Н2O —> 2 глицин
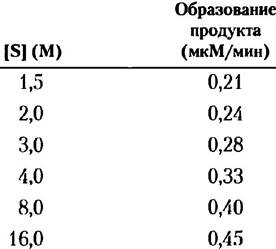
С помощью графического анализа (доп. 6-1 и динамические графики) определите Vmах и Км для данных фермента и субстрата.
14. Уравнение Иди-Хофсти.
Одним из возможных преобразований уравнения Михаэ- лиса-Ментен является уравнение Лайнуи- вера-Берка. Умножая обе части уравнения Лайнуивера-Берка на Vmах и осуществляя перестановку, получаем уравнение Иди- Хофсти:
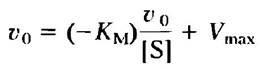
Ниже представлен график зависимости v0, от v0 / [S] для ферментативной реакции. Синяя кривая была получена без ингибитора. Какая кривая (А, В или С) получена в присутствии конкурентного ингибитора? Подсказка: см. уравнение 6-30.
15. Число оборотов карбоангидразы.
Карбоангидраза эритроцитов (Мr = 30 000) — один из наиболее активных из известных на сегодняшний день ферментов. Она катализирует обратимую гидратацию СO2.
Н2O + СO2 ⇄ Н2СO3
Данная реакция играет важную роль в транспорте СO2 от тканей к легким. Каково число оборотов карбоангидразы (в едипицах/мин), если за 1 мин при 37 °С 10 мкг чистого фермента катализируют гидратацию 0,3 г СO2?
16. Уравнение скорости реакции при конкурентном ингибировании.
Уравнение скорости реакции при конкурентном ингибировании выглядит следующим образом:
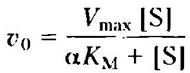
Выведите это уравнение, пользуясь уравнением для общей концентрации фермента [Е]общ = [Е] + [ЕI] + [ЕS], а также определениями α и К1, данными в тексте. Действуйте по аналогии с выводом уравнения Михаэлиса-Ментен.
17. Необратимое ингибирование фермента.
Многие ферменты подвергаются необратимому ингибированию ионами тяжелых металлов, такими как Hg2+, Сu2+ или Ag+, вступающими в реакцию с важными сульфгидрильными группами с образованием меркаптидов:
Е-SН + Ag+ —> Е-S-Ag + Н+
Сродство ионов Ag+ к сульфгидрильной группе настолько велико, что эти ионы можно использовать для количественного титрования SН-групп. К 10 мл раствора, содержащего 1 мг/мл чистого фермента, добавили ровно столько АgNO3, сколько нужно для полной инактивации фермента. Для этого понадобилось 0,432 мкмоль AgNO3. Рассчитайте минимальную молекулярную массу фермента. Почему полученное таким путем значение молекулярной массы будет минимальным?
18. Клиническое применение избирательного ингибирования ферментов.
В сыворотке крови человека содержатся ферменты, называемые кислыми фосфатазами, которые гидролизуют эфиры фосфорной кислоты в слабо кислой среде (pH 5,0):
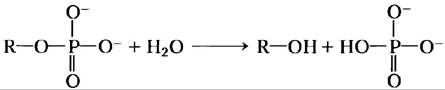
Кислые фосфатазы синтезируются в эритроцитах, печени, селезенке и предстательной железе. Фермент из предстательной железы имеет важное клиническое значение, поскольку повышение его активности в крови может быть признаком возникновения рака простаты. Фосфатаза из предстательной железы сильно ингибируется тартрат-ионами, тогда как кислые фосфатазы из других тканей ими не ингибируются. Как можно использовать эти данные дня разработки метода специфического определения активности кислой фосфатазы из предстательной железы в сыворотке крови человека?
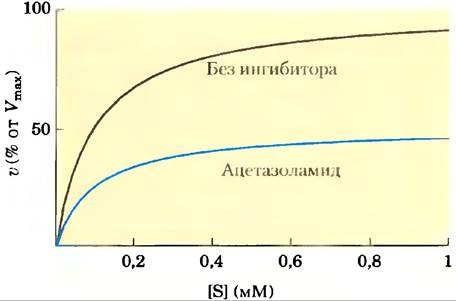
19. Ингибирование карбоангидразы ацетазоламидом.
Карбоангидраза сильно ингибируется лекарственным препаратом ацетазоламидом, которое применяют в качестве мочегонного средства и при глаукоме для снижения глазного давления (повышение которого связано с избыточным накоплением внутриглазной жидкости). Карбоангидраза играет важную роль в этих и других секреторных процессах, поскольку она участвует в регуляции уровня pH и содержания бикорбоната во многих жидкостях организма. Верхняя кривая на рисунке отражает зависимость начальной скорости реакции (в процентах от Vmах), катализируемой карбоангидразой, от концентрации субстрата. Нижняя кривая была построена при проведении эксперимента в присутствии ацетазоламида. Исходя из анализа кривых и ваших знаний о кинетических свойствах конкурентных и смешанных ингибиторов, определите природу ингибирования ацетазоламидом. Объясните ход своих рассуждений.
20. Действие обратимых ингибиторов.
Выведите уравнение, описывающее влияние обратимого ингибитора на кажущееся значение Км (Км. каж = αКм/α′). Исходите из уравнения 6-30 и того факта, что /См, каж равно концентрации субстрата, при которой v0 = Vmax/2a'.
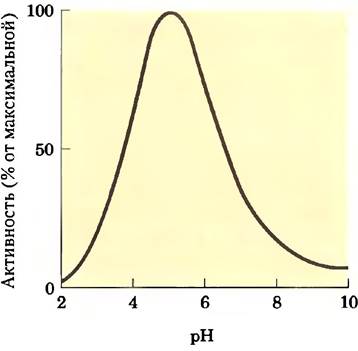
21. Оптимум pH для действия лизоцима.
В активном центре лизоцима расположены два аминокислотных остатка, играющих основную роль в катализе: Glu35и Asp52. Значения рКa карбоксильных групп боковых цепей этих остатков равны соответственно 5,9 и 4,5. В каком состоянии ионизации (протонированном или депротонированном) находится каждый из этих остатков при оптимальном значении pH для лизоцима (5,2)? Как состояние ионизации этих остатков может объяснить приведенная на рисунке рН- зависимость активности лизоцима?
22. Учимся решать кинетические задачи (обратитесь к динамическим графикам для гл. 6).
а) Используя динамический график для уравнения 6-9, изобразите зависимость скорости реакции от [S]. Используйте значения Vmах = 100 мкМ • с-1 и Км = 10 мкМ. Как сильно возрастает v0 при удвоении значения [S] от 0,2 до 0,4 мкМ? Чему равно v0 при [S] = 10 мкМ? Как увеличится v0 при увеличении [S] от 100 до 200 мкМ? Обратите внимание на изменение вида графика при двукратном увеличении или уменьшении значений Vmax или Км.
б) Используя динамический график для уравнения 6-9 и кинетические параметры из задания а), постройте зависимость для случая α = α' = 1. Посмотрите, что произойдет с графиком при α = 2; α' = 3; α = 2 и α' = 3.
в) Используя динамический график для уравнения 6-9 и уравнение Лайнуивера-Берка в доп. 6-1, постройте зависимость в координатах Лайнуивера-Берка для всех случаев, перечисленных в заданиях (а) и (б). Влево или вправо смещается отрезок, отсекаемый графиком на оси х, при α = 2? Влево или вправо смещается отрезок, отсекаемый графиком на оси х, при α = 2 и α' = 3?
Анализ экспериментальных данных
23. Изучение и изменение свойств лактатдегидрогеназы.
Изучение структуры белков привело к возникновению гипотезы о связи аминокислотного состава ферментов и их функции. Один из путей проверки этой гипотезы состоит в использовании технологии рекомбинантных ДНК для создания мутантных версий фермента и изучении структуры и функций измененных форм. Технология, использующаяся для реализации такого подхода, обсуждается в гл. 9.
Одним из примеров такого рода исследований может служить работа Кларка с сотрудниками по изучению фермента лактатдегидрогеназы, опубликованная в 1989 г. Лактатдегидрогеназа (ЛДГ) катализирует восстановление пирувата до лактата при участии NADН (см. разд. 14.3). На рисунке схематично изображен активный центр фермента с молекулой пирувата посредине:
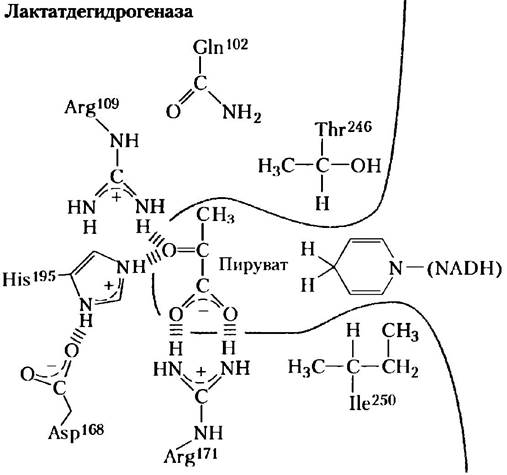
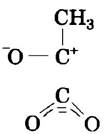
Механизм реакции аналогичен механизмам многих реакций, протекающих с участием NADН (рис. 13-24); происходит реакция, практически обратная той, что изображена на стадиях 2 и 3 на рис. 14-7. В переходном состоянии карбонильная группа молекулы пирувата сильно поляризована:
а) Мутантная форма ЛДГ, в которой остаток Argios заменен на Gln, обладает лишь 5% связывающей способности фермента дикого типа по отношению к пирувату и 0,07% его активности. Как бы вы объяснили это наблюдение?
б) Мутантная форма ЛДГ, в которой остаток Arg171 заменен на Lys, обладает 0,05% способности фермента дикого типа связывать субстрат. Почему это изменение оказалось неожиданным?
в) В кристаллической структуре ЛДГ гуанидиновая группа Arg171и карбоксильная группа пирувата расположены таким образом, как показано в копланарной конфигура-
ции типа «вилки». Зная это, дайте объяснение того колоссального изменения свойств фермента, которое происходит при замене Arg171 на Lys.
г) Мутантная форма ЛДГ, в которой остаток Ilе250 заменен на Gln, слабее связывает NADH. Объясните этот результат.
Кларк с коллегами также предприняли попытку создать мутантную версию фермента, которая бы связывала и восстанавливала не пируват, а оксалоацетат. Они сделали единственную замену: заменили Gln102 на Arg; получившийся фермент должен восстанавливать оксалоацетат до малата, но не должен больше восстанавливать пируват до лактата. Таким образом, они превратили ЛДГ в малатдегидрогеназу.
д) Изобразите схематично структуру активного центра мутантной ЛДГ со связанным оксалоацетатом.
е) Объясните, почему мутантный фермент «предпочитает» оксалоацетат пирувату.
ж) Таким образом, замена более крупной аминокислоты в активном центре фермента позволила связываться более крупному субстрату. Объясните этот результат.