ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
6. ФЕРМЕНТЫ
6.5. Регуляторные ферменты
В клетке группы ферментов действуют сообща, осуществляя последовательные реакции определенного метаболического процесса, например, многостадийного расщепления глюкозы до лактата или многостадийного синтеза аминокислот из простых молекул. В подобных ферментативных системах продукт одной каталитической реакции становится субстратом для другой.
Большинство ферментов метаболических путей (циклов) подчиняются тем кинетическим закономерностям, которые мы обсуждали выще. Однако в каждом метаболическом цикле действует один или несколько ферментов, которые оказывают наибольшее влияние на скорость всего процесса. Эти регуляторные ферменты способны повышать и снижать свою каталитическую активность в ответ на определенные сигналы. Изменение скорости реакции, катализируемой регуляторным ферментом, а, следовательно, скорости всего метаболического пути позволяет клетке адаптироваться к изменяющимся потребностям в энергии и биомолекулах, необходимых для роста и репарации.
В большинстве полиферментных систем регуляторным является первый фермент в цепочке. Это положение очень удобно для регуляции всего метаболического пути, поскольку катализ даже нескольких первых стадий, приводящих к образованию ненужного в данный момент продукта, отнимает энергию и метаболиты от более важных процессов. Другие ферменты метаболического пути могут играть почти незаметные на первый взгляд роли в регуляции потока через метаболический путь, как описано в гл. 15.
Активность регуляторных ферментов модулируется самыми разнообразными способами. Аллостерические ферменты действуют через обратимое нековалентное связывание регуляторных молекул, называемых аллостерическими модуляторами, или аллостерическими эффекторами, которые обычно представляют собой небольшие метаболиты или кофакторы. Другие ферменты регулируются путем обратимой ковалентной модификации. В обоих случаях регуляторные белки обычно являются субъединичными белками, причем иногда регуляторные участки и активные центры расположены на разных субъединицах. Метаболические системы имеют, по крайней мерс, еще два механизма регуляции действия ферментов. Активность некоторых ферментов стимулируется или ингибируется при связывании с другими регуляторными белками. Ферменты еще одного типа активируются при протеолитическом отщеплении пептидного фрагмента; в отличие от регуляции эффекторами протеолитическое расщепление является необратимым. Оба механизма реализуются в таких физиологических процессах, как пищеварение, свертывание крови, гормональная активность и зрение.
Рост и выживание клетки зависят от эффективности использования энергии и питательных веществ, а эта эффективность определяется действием регуляторных ферментов. Не существует общего правила, определяющего, какой тин регуляции выполняется в той или иной системе. До некоторой степени аллостерические (нековалентные) механизмы позволяют тонко регулировать метаболические пути, осуществление которых необходимо постоянно, но с разным уровнем активности в зависимости от клеточных условий. Регуляция с помощью ковалентной модификации может осуществляться как по принципу «все или ничего» (в случае протеолитического расщепления), так и приводить к топким изменениям активности. Один регуляторный фермент может использовать несколько типов регуляции. Заключительный раздел данной главы посвящен этим методам ферментативной регуляции.
Аллостерические ферменты претерпевают конформационные изменения в ответ на связывание модулятора
Как обсуждалось в гл. 5, аллостерическими белками называют те, у которых есть «другая форма» или конформация, в которую они переходят при связывании модулятора. То же относится и к некоторым регуляторным ферментам: конформационные изменения, вызванные одним или несколькими модуляторами, соответствую] взаимным превращениям менее и более активной формы фермента. Модуляторы аллостерических ферментов могут оказывать ингибирующее или стимулирующее действие. Часто в качестве модулятора выступает сам субстрат; регуляторные ферменты, чьи субстраты одновременно являются регуляторами, называют гомотропными ферментами. Здесь наблюдается эффект, сходный со связыванием кислорода с гемоглобином (гл. 5): связывание лиганда (в случае фермента лигандом является субстрат) приводит к конформационным изменениям, которые, в свою очередь, влияют на активность в остальных участках белка. Если функцию субстрата и модулятора фермента выполняют разные молекулы, такой фермент называют гетеротропным. Заметьте, что аллостерические модуляторы не следует путать с ингибиторами, действующими по бесконкурентному или смешанному механизму. Хотя последние связываются вне активного центра фермента, они не обязательно приводят к конформационным изменениям, сопровождающимся переходами между активной и неактивной формами фермента; кроме того, кинетические проявления этих эффектов также различны.
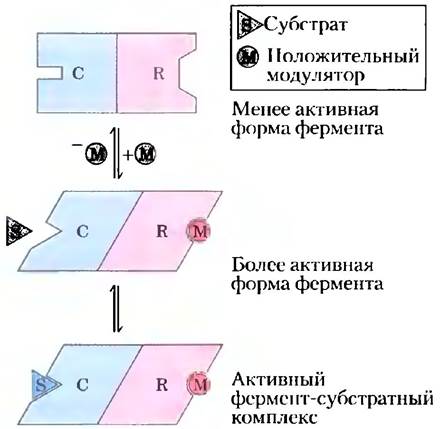
Свойства аллостерических ферментов сильно отличаются от свойств простых нерегуляторных ферментов. Некоторые различия наблюдаются на уровне структуры белков. Кроме активного центра аллостерические ферменты обычно имеют один или несколько регуляторных (аллостерических) центров для связывания модулятора (рис. 6-31). Так же как активный центр фермента специфичен для определенного субстрата, каждый регуляторный центр специфичен для определенного модулятора. Ферменты с несколькими модуляторами обычно имеют отдельный участок для связывания каждого из них. У гомотропных ферментов активный центр и регуляторный центр совпадают.
Рис. 6-31. Модель взаимодействия между субъединицами аллостерического белка, а также с ингибитором и активатором. Во многих аллостерических ферментах центры связывания субстрата и модулятора (модуляторов) находятся на разных субъединицах — каталитической (С) и регуляторной (R) соответственно. Связывание положительного (активирующего) модулятора (М) в специфическом центре связывания на регуляторной субъединице приводит к конформационным изменениям в каталитической субъединице. В результате этих изменений каталитическая субъединица становится активной и способна связывать субстрат (S) с более высоким сродством. При диссоциации модулятора из регуляторного центра фермент возвращается в менее активное состояние.
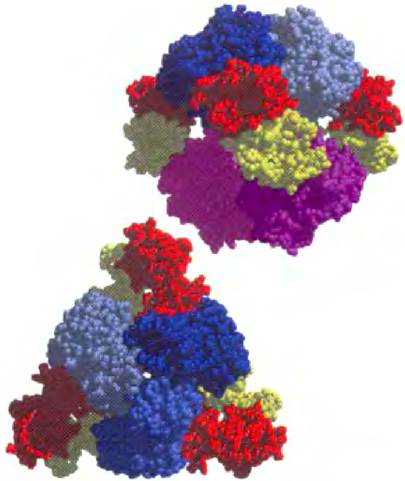
Аллостерические ферменты, как правило, имеют более крупные размеры и сложнее устроены, чем обычные. Большинство аллостерических ферментов состоит из двух или более единиц. Аспартаттранскарбамоилаза, катализирующая реакцию на ранних этапах биосинтеза пиримидиновых оснований (рис. 22-36), состоит из 12 полипептидных цепей, образующих каталитические и регуляторные субъединицы. На рис. 6-32 представлена четвертичная структура данного белка, полученная с помощью рентгеноструктурного анализа.
Рис. 6-32. Модель регуляторного фермента аспартат- транскарбамоилазы; вид с разных сторон (РDВ ID 2АТ2). Данный аллостерический фермент имеет два каталитических кластера, каждый из которых состоит из трех каталитических полипептидных цепей (разные оттенки синего и розового), и три регуляторных кластера каждый из которых состоит из двух регуляторных полипептидных цепей (красные и желтые). Регуляторные кластеры образуют углы треугольника, окружающего каталитические субъединицы. Центры связывания аллостерических модуляторов расположены на регуляторных субъединицах. Связывание модулятора приводит к сильным изменениям структуры и активности фермента. Роль данного белка в синтезе нуклеотидов и детали его регуляции обсуждаются в гл. 22.
Во многих метаболических путях регуляторная стадия катализируется аллостерическим ферментом
В некоторых полиферментных системах происходит специфическое ингибирование регуляторных ферментов конечным продуктом метаболического пути всякий раз, когда содержание этого продукта превышает необходимый клетке уровень. При замедлении реакции, катализируемой регуляторным ферментом, все последующие ферментативные стадии также замедляются по мере исчерпания их субстратов. В результате скорость образования конечного продукта данного метаболического пути приходит в соответствие с клеточными нуждами. Данный тип регуляции называется ингибированием по принципу обратной связи. Накопление конечного продукта метаболического пути замедляет все реакции на этом пути.
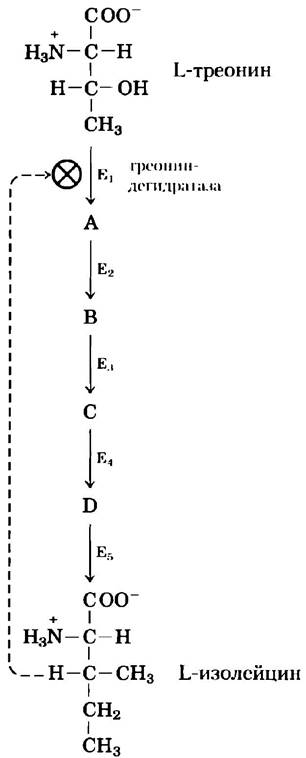
Одной из первых систем, в которых был обнаружен данный механизм, является бактериальная ферментативная система, катализирующая пятиступенчатое превращение L-треонина в L-изолейцин (рис. 6-33). Первый фермент, действующий в данной системе, а именно треониндегидратаза, ингибируется изолейцином — продуктом последней реакции в цепочке. Это пример гетеротропного аллостерического ингибирования. Изолейцин — довольно специфический ингибитор. Ни один из промежуточных продуктов данной цепочки не ингибирует треониндегидратазу, и никакой другой фермент в цепочке не ингибируется изолейцином. Изолейцин связывается не в активном центре, а в другом участке молекулы фермента — в регуляторном центре. Это связывание является нековалентным и обратимым; если концентрация изолейцина снижается, скорость дегидратации треонина увеличивается. Так активность треониндегидратазы быстро и обратимо реагирует на флуктуации концентрации изолейцина в клетке. Как мы увидим в части II данной книги, механизмы регуляции многих других метаболических путей гораздо сложнее.
Рис. 6-33. Ингибирование по принципу обратной связи. Превращение L-треонина в L-изолейцин происходит в результате последовательного действия пяти ферментов (от Е1 до Е5). Первый фермент треониндегидратаза подвергается аллостерическому ингибированию продуктом последней реакции в данной серии (изолейцином), но не ингибируется никаким другим промежуточным продуктом (от А до D). Ингибирование по принципу обратной связи изображено пунктирной линией и символом![]() у стрелки, соответствующей реакции, катализируемой треониндегидратазой. Такой способ изображения обратной связи используется в книге и далее.
у стрелки, соответствующей реакции, катализируемой треониндегидратазой. Такой способ изображения обратной связи используется в книге и далее.
Поведение аллостерических ферментов отклоняется от кинетики Михаэлиса-Ментен
Зависимость между v0 и [S] для аллостерических ферментов нс подчиняется кинетике Михаэлиса-Ментен. Для этих ферментов также наблюдается насыщение субстратом при достаточно высоких значениях [S], однако график зависимости v0 от [S] (рис. 6-34) имеет S-образный, а не гиперболический вид, характерный для нерегуляторных ферментов. На S-образной кривой мы можем найти значение [S], соответствующее 1/2 Vmах, но оно не обозначается как Км, поскольку фермент не подчиняется кинетике Михаэлиса-Ментен. При описании кинетического поведения аллостерических ферментов используют обозначения [S]0,5 или К0,5, соответствующие концентрации субстрата, при которой достигается половина максимальной скорости реакции (рис. 6-34).
Рис. 6-34. Зависимость активности различных типов аллостерических ферментов от концентрации субстрата. Здесь представлены примеры сложной реакции аллостерических ферментов на действие их модуляторов, а) Сигмовидная зависимость для гомотропного фермента, для которого субстрат является одновременно и положительным (активирующим) модулятором. Обратите внимание на сходство с кривой насыщения гемоглобина кислородом (рис. 5-12). б) Влияние положительного (+) и отрицательного (-) модулятора на поведение аллостерических ферментов: К0,5 изменяется, остается на прежнем уровне. Центральная кривая получена без модулятора, в) Менее распространенный тип действия модулятора, при котором изменяется Vmах, а К0,5 практически постоянна.

S-образная кривая зависимости v0 от [S] обычно говорит о кооперативном взаимодействии между субъединицами белка. Другими словами, изменение структуры одной субъединицы путем нековалентных взаимодействий в месте контакта субъединиц приводит к структурным изменениям в соседней субъединице. Этот принцип особенно наглядно проявляется, если белок не является ферментом, например, при связывании гемоглобина с кислородом. S-образный характер зависимости объясняется с помощью двух моделей (симметричной и последовательной), описывающих взаимодействие между субъединицами (рис. 5-15).
Гомотропные аллостерические ферменты обычно являются субъединичными белками. Как уже упоминалось ранее, центр связывания на каждой субъединице такого белка выполняет одновременно функции активного и регуляторного центров. Наиболее часто субстрат действует как положительный модулятор (активатор), поскольку субъединицы действуют кооперативно: связывание одной молекулы субстрата в одном центре влечет за собой изменение конформации белка, что способствует связыванию следующих молекул субстрата. Такой тип взаимодействия как раз и приводит к S-образному росту кривой зависимости v0 от [S]. Одной из особенностей S-образной зависимости является то, что небольшие изменения концентрации модулятора могут сильно повлиять на активность фермента. Как видно из рис. 6-34, а, сравнительно небольшое повышение [S] на крутом участке кривой вызывает значительное повышение v0.
В случае гетеротропных аллостерических ферментов, модуляторами которых являются другие метаболиты, а не их нормальный субстрат, вид кривых зависимости v0 от [S] может быть различным. Действие активатора может приводить к тому, что кривая принимает почти гиперболический вид с пониженным значением K0,5, но прежним значением Vmaх, что выражается вроете скорости реакции при фиксированной концентрации субстрата (для всех [S] значения v0 располагаются выше; рис. 6-34, б, верхняя кривая). Другие гетеротропные аллостерические ферменты реагируют на действие активатора повышением Vmах без значительных изменений К0,5 (рис. 6-34, в). Действие отрицательного модулятора (ингибитора) может приводить к формированию более выраженной сигмовидной кривой, характеризующейся повышением К0,5 (рис. 6-34, б, нижняя кривая). Таким образом, зависимость активности гетеротропных аллостерических ферментов от концентрации субстрата может различным образом изменяться под действием модулятора, поскольку некоторые из этих ферментов регулируются ингибирующими модуляторами, другие — активирующими, а третьи — теми и другими.
Некоторые ферменты регулируются с помощью обратимой ковалентной модификации
В другом важном классе регуляторных ферментов активность регулируется путем ковалентной модификации одного или нескольких аминокислотных остатков в молекуле фермента. В белках описано свыше 500 различных типов ковалентной модификации. В роли модифицирующих групп часто выступают фосфорильная, ацетильная, аденильная, уридильная, метильная, амидная, карбоксильная, миристоильная, пальмитоильная, пренильная, гидроксильная, сульфатная и ADP-рибозильная группы (рис. 6-35). Существуют даже целые белки, которые используются как специальные модифицирующие группы, например, убиквитин и белки SUMO (small ubiquitin-like modifiers). Соответствующие группы обычно присоединяются к молекуле регуляторного белка и снимаются с нее под действием разных ферментов.
Рис. 6-35. Примеры реакций модификации ферментов (Е обозначает фермент).
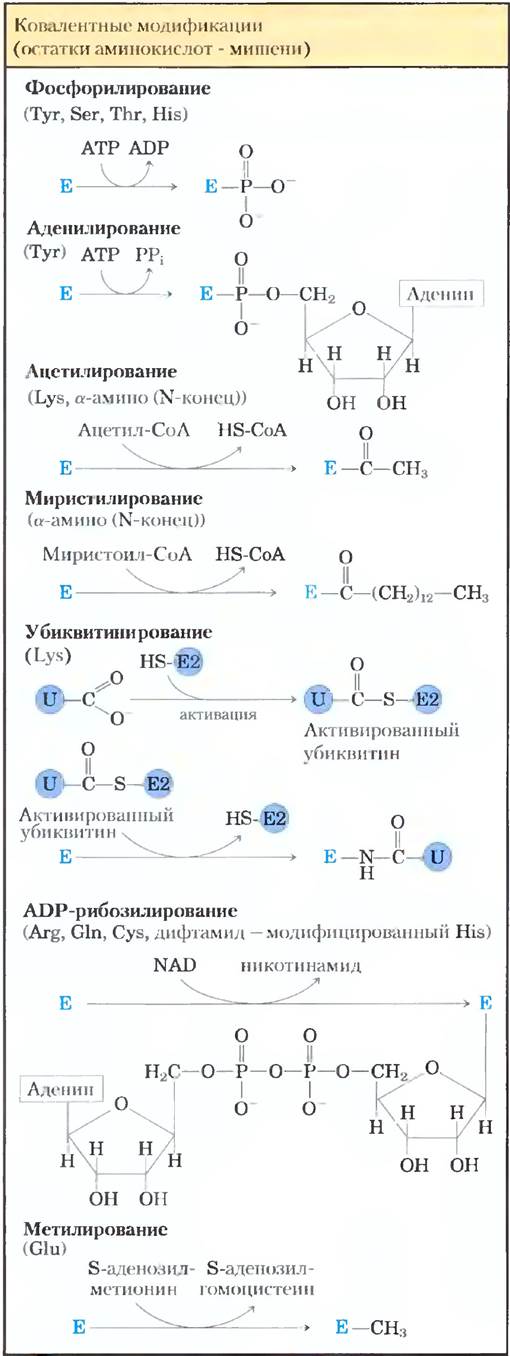
При модификации аминокислотных остатков на место одной аминокислоты встраивают другую — с другими свойствами. Введение заряженной группы может локальным образом менять свойства фермента и вызывать изменение его конформации. Введение гидрофобной группы может привести к связыванию белка с мембраной. Изменения часто бывают весьма существенными и могут оказаться критическими для функционирования измененного фермента.
Число возможных модификаций ферментов слишком велико, чтобы обсуждать их все подробно, рассмотрим лишь несколько примеров.
Примером фермента, активность которого регулируется метилированием, может служить метил-акцептирующий белок хемотаксиса бактерий. Этот белок является частью системы, позволяющей бактерии в растворе приближаться к аттрактантам (например, сахару) и удаляться от репеллентов. Как метилирующий агент выступает S-аденозилметионин (adoMet) (рис. 18-18, б). Ацетилирование — довольно частая модификация, которой подвергаются около 80% всех растворимых белков эукариот, включая многие ферменты, которые ацетилируются по N-концу. Убиквитин присоединяется к белкам в качестве «ярлыка», указывая на то, что эти белки направляются на протеолитическое расщепление (см. рис. 27-47). Убиквитинирование может также выполнять регуляторную функцию. Белки SUMO присоединяются ко многим ядерным белкам эукариот и участвуют в регуляции транскрипции, организации хроматина и репарации ДНК.
ADP-рибозилирование — это чрезвычайно интересная реакция, которой подвергаются лишь немногие белки. ADP-рибоза является производным никотинамидадениннуклеотида (NAD) (рис. 8-39). Данному типу модификации подвергается бактериальная редуктаза нитрогеназы, играющая важную роль в фиксации азота. Токсины дифтерии и холеры представляют собой ферменты, катализирующие ADP-рибозилирование и приводящие к инактивации ключевых клеточных ферментов и белков.
Возможно, наиболее важным типом регуляторной модификации является фосфорилирование. По оценкам, треть всех белков в клетках эукариот фосфорилированы, а одна или (часто) несколько стадий фосфорилирования осуществляются практически в каждом регуляторном процессе. В некоторых белках фосфорилирован лишь один остаток, в других — несколько, но есть белки, в которых имеются десятки центров фосфорилирования. Данный способ ковалентной модификации играет важнейшую роль в большом количестве регуляторных путей, поэтому мы остановимся на нем подробнее и снова вернемся в гл. 12.
Все эти способы модификации будут обсуждаться в нижеследующих главах книги.
Фосфорилирование влияет на структуру и каталитическую активность белков
Присоединение фосфорильной группы к аминокислотным остаткам белка катализируется протеинкиназами; удаление фосфорильной группы катализируется фосфатазами.Присоединение фосфорильной группы к остаткам Ser, Thr и Туг приводит к внедрению громоздких заряженных групп в слабополярные области белка. Атомы кислорода фосфорила могут участвовать в образовании водородной связи с группами белка, чаще всего с амидными группами пептидной цепи в начале α-спирального участка или с заряженной гуанидиновой группой остатка Arg. Два отрицательных заряда на фосфорилированной боковой цепи могут приводить к отталкиванию расположенных поблизости отрицательно заряженных остатков (Asp и Glu). Если модифицированная боковая цепь локализована в участке белка, который важен для образования его трехмерной структуры, фосфорилирование может оказывать серьезное влияние на конформацию белка и, следовательно, на связывание субстрата и катализ.
Важным примером регуляции через фосфорилирование является катализ гликогенфосфорилазой (Мr = 94 500) следующей реакции в мышцах и печени (гл. 15):

Образующийся глюкозо-1-фосфат может использоваться для синтеза АТР в мышцах или превращаться в свободную глюкозу в печени. Гликогенфосфорилаза существует в двух формах — в виде более активной фосфорилазы а и менее активной фосфорилазы b (рис. 6-36). Фосфорилаза а состоит из двух субъединиц, каждая из которых имеет специфический остаток Ser, подвергающийся фосфорилированию но гидроксильной группе. Фосфорилирование остатка серина является необходимым условием для проявления максимальной активности фермента. Фосфорильные группы могут быть удалены действием другого фермента — фосфатазы фосфорилазы:
![]()
Рис. 6-36. Регуляция активности гликогенфосфорилазы мышц путем ковалентной модификации. Регуляция активности гликогенфосфорилазы мышц осуществляется несколькими путями, включая ковалентную модификацию (фосфорилирование), аллостерическую регуляцию и гормонзависимый регуляторный каскад, который действует на ферменты фосфорилирования и дефосфорилирования. В более активной фосфорилазе а специфические остатки Ser на обеих субъединицах фосфорилированы. Она превращается в менее активную фосфорилазу b при удалении фосфорильных групп, осуществляемом фосфатазой фосфорилазы 1 (РР1). Обратная реакция происходит под действием киназы фосфорилазы. Активность обеих форм фермента подвержена аллостерической регуляции активатором (АМР) и ингибиторами (глюкозо-6-фосфат и АТР), которые связываются с разными центрами на молекуле фермента. Активности киназы фосфорилазы и РР1 также регулируются коротким каскадом, зависимым от гормонов глюкагона и адреналина. При низком содержании сахара в крови поджелудочная железа и надпочечники начинают вырабатывать глюкагон и адреналин. Адреналин связывается со своим рецептором в мышцах и некоторых других тканях и активирует аденилатциклазу. Глюкагон играет похожую роль, связываясь с рецептором в печени и вызывая синтез большого количества модифицированного нуклеотида — циклического АМР (сАМР; см. с. 427), активирующего фермент сАМР-зависимую протеинкиназу (РКА). РКА фосфорилирует некоторые белки-мишени, среди которых киназа фосфорилазы и ингибитор фосфопротеинфосфатазы 1 (PPI-1). Фосфорилированная киназа фосфорилазы активируется и, в свою очередь, фосфорилирует и активирует гликогенфосфорилазу. В то же время фосфорилированная PPI-1 взаимодействует с PPI и ингибирует ее действие. Кроме того, PPI-1 поддерживает себя в активной (фосфорилированной) форме путем ингибирования фосфопротеинфосфатазы 2В (РР2В), которая дефосфорилирует и тем самым инактивирует PPI-1. При этом равновесие между а и b формами гликогенфосфорилазы сильно сдвинуто в сторону более активной гликогенфосфорилазы а. Обе формы киназы фосфорилазы до некоторой степени активируются ионами Са2+ (не показано). Подробнее см. в гл. 14,15 и 23.
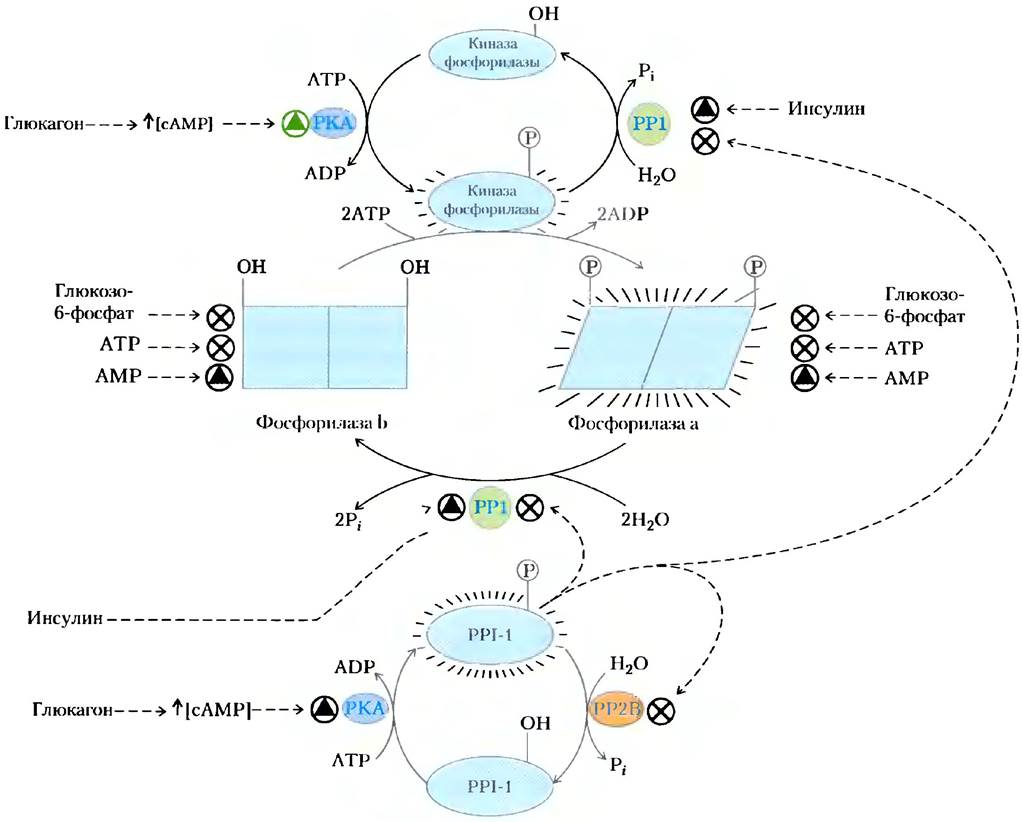
В соответствии с данной реакцией фосфорилаза а превращается в фосфорилазу b путем расщепления ковалентных связей между остатками фосфорной кислоты и двумя специфическими остатками серина на двух субъединицах гликогенфосфорилазы.
Фосфорилаза b в свою очередь также может быть снова превращена в активную фосфорилазу а под действием другого фермента — киназы фосфорилазы, катализирующей перенос фосфорильной группы от АТР на гидроксильную группу специфических остатков серина в фосфорилазе b:
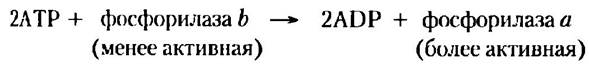
Распад гликогена в скелетных мышцах и печени регулируется путем изменения соотношения двух форм гликогенфосфорилазы. Формы а и b различаются по вторичной, третичной и четвертичной структурам; их взаимопревращения сопровождаются изменениями структуры активного центра и, следовательно, каталитической активности.
Регулирование гликогенфосфорилазы фосфорилированием иллюстрирует влияние модификации как на структуру, так и на каталитическую активность фермента. Каждая субъединица нефосфорилированного белка упакована таким образом, что 20 аминокислотных остатков на N-конце (в их числе несколько основных остатков) располагаются в области, содержащей кислые аминокислотные остатки. Возникающее электростатическое притяжение стабилизирует молекулу. Фосфорилирование Ser14 нарушает это взаимодействие и выталкивает N-концевой домен из кислой области белка, что приводит к возникновению конформации, способствующей взаимодействию между![]() и боковыми цепями нескольких остатков Arg. В данной конформации белок гораздо более активен.
и боковыми цепями нескольких остатков Arg. В данной конформации белок гораздо более активен.
Фосфорилирование фермента может влиять на катализ и другим путем, а именно изменяя сродство фермента к субстрату. Например, при фосфорилировании изоцитратдегидрогеназы (фермент цикла лимонной кислоты, гл. 16) электростатическое отталкивание фосфатных групп ингибирует связывание цитрата (трикарбоновой кислоты) в активном центре фермента.
Множественное фосфорилирование позволяет осуществлять тонкую регуляцию
Остатки Ser, Thr и Туг, подвергающиеся фосфорилированию в регуляторных белках, встречаются в распространенных структурных мотивах, которые называются консенсусными последовательностями и узнаются специфическими протеинкиназа- ми (табл. 6-10). Некоторые киназы предпочитают фосфорилировать остатки, находящиеся по соседству от основных аминокислот; другие фосфорилируют те остатки, что расположены, например, рядом с остатком Pro. Однако аминокислотная последовательность — это не единственный фактор, определяющий, будет ли данный остаток фосфорилирован. В результате фолдинга белка остатки, расположенные далеко друг от друга в первичной структуре, могут оказаться рядом; именно трехмерная структура белка определяет, доступен ли остаток для протеинкиназы, и воспринимает ли она его в качестве субстрата. Еще одним фактором, влияющим на субстратную специфичность некоторых протеинкиназ, является близость других фосфорилированных остатков.
Таблица 6-10. Консенсусные последовательности в протеинкиназах
Протеинкиназа |
Консенсусная последовательность и фосфорилированный остаток* |
Протеинкиназа А |
-x-R-[RK]-x-[ST]-B- |
Иротеинкиназа G |
-x-R-[RK]-x-[ST|-x- |
Протеинкиназа С |
-[RK](2)-x-[ST] B-[RK](2) |
Протеинкиназа В |
-x-R-x-[ST]-x-K- |
Са2+/кальмодулин-киназа I |
-B-x-R-x(2)-[ST]-x(3)-B- |
Са2+/кальмодулин-киназа II |
-B-x-[RK]-x(2)-[ST]-x(2) |
Киназа легкой цепи миозина (гладких мышц) |
-K(2)-R-x(2)-S-x-B(2)- |
Киназа фосфорилазы b |
-K- R-K- Q-I-S- V-R- |
Регулируемая внеклеточным сигналом киназа ERK |
-P-x-[ST]-P(2)- |
Циклин зависимая протеинкиназа (cdc2) |
-x-[ST]-P-x-[KR]- |
Казеинкиназа 1 |
-[SpTp]-x(2)-[ST]-B-** |
Казеин киназа II |
-x-[ST ]-x(2)-[ED]-x- |
Киназа β-адренергического рецептора |
-[DE](n)-[ST ]-x(3)- |
Родопсинкиназа |
-x(2)-[ST]-(E)(n)- |
Киназа инсулинового рецептора |
-x-E(3)-Y-M(4)-K(2)-S-R-G-D-Y-M-T-M-Q-I- G-K(3)-L-P-A-T-G-D-Y-M-N-M-S-P- V-G-D- |
Киназа рецептора эпидермального фактора роста (ЕGF) |
-E(4)-Y-F-E-L-V- |
* Латинскими буквами обозначены остатки, выведенные из нуклеотидной последовательности, а курсивом — реальные аминокислотные остатки в последовательностях известных субстратов. Остатки Ser (S), Thr (Т) и Туг (Y), подвергающиеся фосфорилированию, выделены красным цветом (однобуквенную номенклатуру аминокислот см. в табл. 3-1). х означает любую аминокислоту, В любую гидрофобную аминокислоту, Sp, Тр и Yp — уже фосфорилированные остатки Ser, Thr и Туr соответственно.
** Наилучшая мишень содержит два аминокислотных остатка, разделяющие фосфорилированный остаток и ключевой остаток Ser/Thr. Участки с одним или тремя инвертированными остатками узнаются хуже.
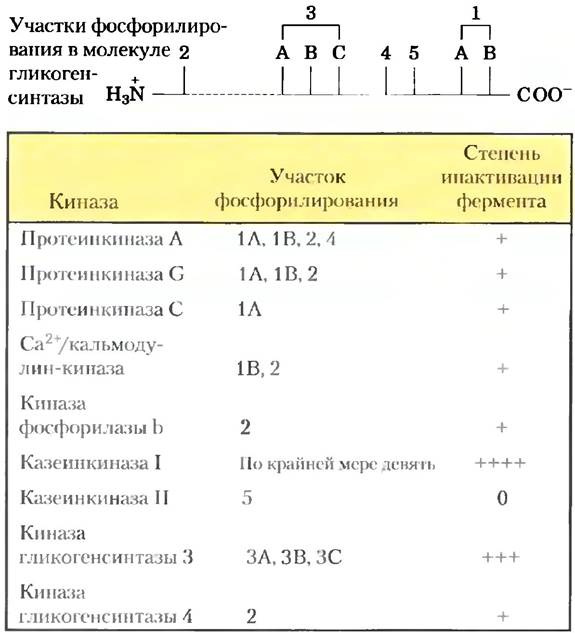
Регуляция фосфорилированием часто довольно сложна. Некоторые белки имеют консенсусные последовательности, узнаваемые несколькими разными протеинкиназами, каждая из которых может фосфорилировать белок и менять его ферментативную активность. В других случаях фосфорилирование представляет собой иерархический процесс: определенный остаток может фосфорилироваться только в том случае, если соседний остаток уже фосфорилирован. Например, гликогенсинтаза, катализирующая конденсацию мономерных глюкозных звеньев с образованием гликогена (гл. 15), инактивируется при фосфорилировании специфических остатков Ser, а также ее активность модулируется действием по крайней мере четырех других протеинкиназ, фосфорилирующих четыре других участка фермента (рис. 6-37). Данный фермент не является субстратом для киназы гликогенсинтазы 3, пока один участок не будет фосфорилирован казеин- киназой II. Присоединение фосфатных групп в разных участках в разной степени ингибирует гликогенсинтазу, причем в некоторых случаях фосфорилирование оказывает кумулятивное действие. Подобное множественное фосфорилирование служит для чрезвычайно тонкой регуляции ферментативной активности.
Рис. 6-37. Множественное фосфорилирование. Фермент гликогенсинтаза имеет по меньшей мере девять отдельных участков фосфорилирования клеточными протеинкиназами в пяти обозначенных на схеме областях молекулы. Таким образом, регуляция данного фермента происходит не по принципу включения/выключения активности, а путем гораздо более тонкой модуляции в ответ на различные сигналы.
Для эффективности данного механизма регулирования фосфорилирование должно быть обратимым. Обычно фосфатные группы присоединяются и удаляются разными ферментами, следовательно, эти процессы могут регулироваться раздельно. В клетках содержится семейство фосфопротеинфосфатаз. гидролизующих эфиры ![]() с высвобождением неорганического фосфата. Известные на настоящий момент фосфопротеинфосфатазы действуют не на все фосфопротеины, однако они обладают меньшей субстратной специфичностью, чем протеинкиназы.
с высвобождением неорганического фосфата. Известные на настоящий момент фосфопротеинфосфатазы действуют не на все фосфопротеины, однако они обладают меньшей субстратной специфичностью, чем протеинкиназы.
Некоторые ферменты и другие белки регулируются путем протеолитического расщепления предшественника
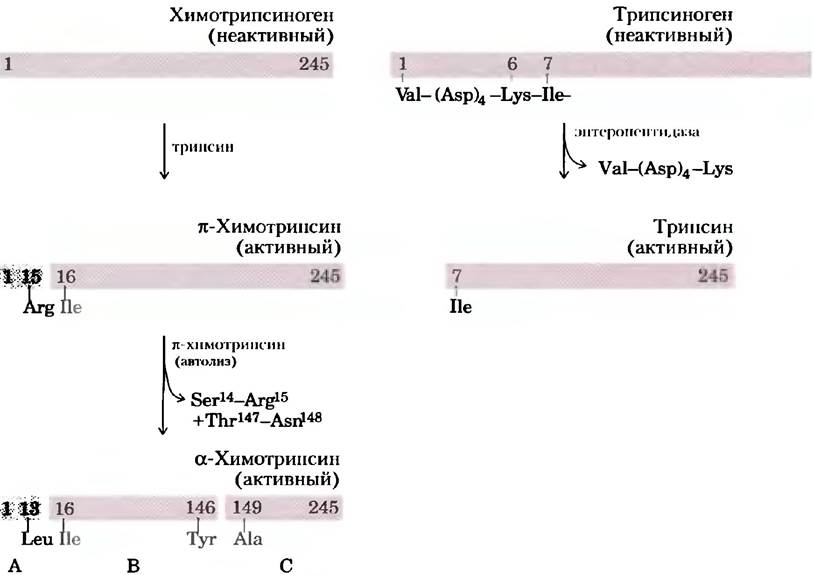
Некоторые ферменты переходят в активную форму после расщепления неактивного предшественника, называемого зимогеном. В частности, таким образом регулируются многие протеолитические ферменты (протеазы) желудка и поджелудочной железы. Химотрипсин и трипсин исходно синтезируются в виде химотрипсиногена и трипсиногена (рис. 6-38). Специфическое расщепление вызывает конформационные изменения, в результате которых активный центр этих ферментов становится доступен. Поскольку данный тип активации является необратимым, то для инактивации подобных ферментов должны существовать другие механизмы. Инактивация протеаз происходит под действием ингибирующих белков, которые очень прочно связываются в активном центре. Например, панкреатический ингибитор трипсина (Мr = 6000) связывается с трипсином и ингибирует его; а- антипротеиназа (Мr = 53 000) в первую очередь ингибирует эластазу нейтрофилов (нейтрофилы - это один из типов лейкоцитов или белых клеток крови; эластаза расщепляет эластин, входящий в состав некоторых соединительных тканей). Недостаточность α1-антипротеиназы, которая встречается у курильщиков, может приводить к повреждениям легких, в том числе эмфиземе.
Рис. 6-38. Активация зимогенов путем протеолитического расщепления. Представлен механизм образования химотрипсина и трипсина из зимогенов. Полосы изображают последовательность аминокислот в полипептидных цепях, номера означают относительное местонахождение аминокислотных остатков (N-концевой остаток имеет номер 1). Под полоской указаны остатки на концах полипептидного фрагмента, образованных в результате расщепления. Обратите внимание, что в окончательной активной форме некоторые остатки отсутствуют. Три полипептидные цепи химотрипсина (А, В и С) связаны дисульфидными мостиками.
Протеазы — это не единственные белки, активирующиеся в результате протеолиза. Однако в других случаях белки-предшественники называют не зимогенами, а проферментами, или пробелками. Например, коллаген, входящий в состав соединительной ткани, исходно синтезируется как растворимый предшественник — проколлаген. Система свертывания крови предлагает множество примеров протеолитической активации. Белок кровяных сгустков фибрин образуется в результате протеолиза неактивного пробелка фибриногена. За это превращение отвечает протеаза тромбин (во многих отношениях напоминающая химотрипсин), а сама она возникает в результате протеолиза протромбина (в данном случае зимогена).
Некоторые регуляторные ферменты используют несколько механизмов регуляции
Гликогенфосфорилаза катализирует первую реакцию метаболического пути, в результате которого запасная глюкоза конвертируется в необходимую клетку энергию (гл. 14 и 15). Это важный метаболический путь, и его регулирование происходит довольно сложным образом. Хотя активность гликогенфосфорилазы в первую очередь регулируется посредством ковалентной модификации, как показано на рис. 6-36, она, кроме того, подвержена аллостерической регуляции под действием АМР — активатора фосфорилазы b,а также глюкозо-6-фосфата и АТР (оба ингибиторы). Кроме того, ферменты, которые добавляют и удаляют фосфорильные группы, в свою очередь подвержены регуляции гормонами, контролирующими уровень сахара в крови (рис. 6-36; см. также гл. 15 и 23).
Другие сложные регуляторные ферменты обнаружены в точках пересечения метаболических путей. Бактериальная глутаминсинтетаза, катализирующая реакцию, с помощью которой восстановленный азот включается в метаболизм клетки (гл. 22), относится к наиболее сложным из известных ферментов. Она подчиняется аллостерической регуляции по механизму обратимой ковалентной модификации (с участием не менее восьми модуляторов); кроме того, действие фермента регулируется связыванием с другими регуляторными белками (на этом механизме мы остановимся подробно при обсуждении регуляции отдельных метаболических путей).
В чем преимущество столь сложной регуляции ферментативной активности? Начиная данную главу, мы подчеркивали центральную роль катализа для самого существования жизни. Контроль этого катализа также имеет жизненно важное значение. Если бы все возможные реакции в клетке протекали одновременно, то макромолекулы и метаболиты быстро бы распались на гораздо более простые химические компоненты. Но этого не происходит, поскольку клетки катализируют только те реакции, в которых нуждаются в текущий момент. При обилии химических ресурсов клетки синтезируют и накапливают глюкозу и другие метаболиты. При истощении ресурсов клетки начинают использовать свои запасы в качестве топлива, необходимого для метаболизма. Химическая энергия расходуется экономно, распределяясь по различным метаболическим путям в соответствии с текущими нуждами. Наличие мощных катализаторов, специфичных для каждой отдельной реакции, позволяет осуществлять эту регуляцию. Все это вместе создает сложный, тонко регулируемый комплекс, который мы называем жизнью.
Краткое содержание раздела 6.5 Регуляторные ферменты
■ Активность метаболических путей в клетке регулируется путем контроля активности определенных ферментов.
■ При ингибировании по принципу обратной связи конечный продукт метаболического пути ингибирует первый фермент, действующий на данном пути.
■ Активность аллостерических ферментов контролируется путем обратимого связывания специфических модуляторов в регуляторном центре. Модулятором может выступать сам субстрат или какой-либо другой метаболит; действие модулятора может быть ингибирующим или активирующим. Кинетическое поведение аллостерических ферментов отражает кооперативный характер взаимодействия между субъединицами.
■ Действие других регуляторных ферментов регулируется путем ковалентной модификации специфических функциональных групп, необходимых для катализа. Одним из наиболее распространенных способов регуляции ферментативной активности является фосфорилирование аминокислотных остатков.
■ Многие протеолитические ферменты исходно синтезируются как неактивные предшественники (зимогены), активируемые отщеплением небольшого пептидного фрагмента.
■ Ферменты, действующие на пересечениях важных метаболических путей, могут регулироваться путем сложной комбинации воздействий, что позволяет координировать активность этих метаболических путей.