ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
7. УГЛЕВОДЫ И ГЛИКОБИОЛОГИЯ
7.3. Гликоконъюгаты: протеогликаны, гликопротеины и гликолипиды
Олиго- и полисахариды не только играют важную роль в сохранении энергии в клетке (крахмал, гликоген) и служат в качестве структурных материалов (целлюлоза, хитин, пептидогликаны), но и участвуют в переносе информации. Некоторые сахара являются медиаторами специфических взаимодействий клеток между собой и с внеклеточным матриксом; другие играют роль меток, указывающих направление транспорта и место локализации определенных органелл или необходимость разрушения, если белок неправильно упакован или находится в избытке. Кроме того, они могут служить сайтами узнавания для внеклеточных сигнальных молекул (например, ростовых факторов) или внеклеточных паразитов (бактерий или вирусов). На поверхности почти каждой эукариотической клетки находятся специфические цепочки олигосахаридов, прикрепленные снаружи к плазматической мембране; они образуют углеводный слой (гликокаликс) толщиной в несколько нанометров. Этот слой несет множество информации о клетке для ее окружения. Такие олигосахариды играют главную роль в процессах клеточного узнавания, адгезии и перемещения клеток в период их созревания, в свертывании крови, иммунном ответе, заживлении ран и многих-многих других процессах. В большинстве случаев информационные углеводы связаны ковалентной связью с белками или липидами, образуя биологически активные гликоконъюгаты.
Протеогликаны — это макромолекулы, находящиеся на поверхности клеток или во внеклеточном матриксе, в которых одна или несколько цепей гликозаминогликанов связаны ковалентной связью с мембранным или секретируемым белком. Цепь гликозаминогликана может прикрепляться к внеклеточным белкам за счет электростатических взаимодействий с отрицательно заряженными группами полисахарида. Протеогликаны — основной компонент внеклеточного вещества.
Гликопротеины представляют собой белки, связанные ковалентной связью с одним или несколькими олигосахаридами разной сложности. Эти вещества обычно обнаруживаются на внешней поверхности плазматической мембраны, во внеклеточном матриксе и в крови. Внутри клеток они встречаются в таких органеллах, как аппарат Гольджи, секреторные гранулы и лизосомы. Олигосахариды в составе молекул гликопротеинов более разнообразны, чем гликозаминогликаны в составе протеогликанов. Олигосахариды гликопротеинов несут в себе много информации, образуют высокоспецифичные сайты узнавания и высокоаффинные центры связывания в белках, связанных с углеводами, которые называют лектинами. Некоторые белки ядра и цитоплазмы тоже могут быть гликозилированы.
Гликолипиды — мембранные сфинголипиды, гидрофильная «головка» которых образована олигосахаридами, служащими, как и в случае гликопротеинов, в качестве специфических участков узнавания лектинов. Гликолипидов много в мозге и нервной ткани, где они участвуют в проведении нервного импульса и образовании миелиновой оболочки. Кроме того, гликолипиды задействованы в передаче клеточных сигналов.
Протеогликаны — макромолекулы клеточной поверхности и внеклеточного матрикса, содержащие гликозаминогликаны
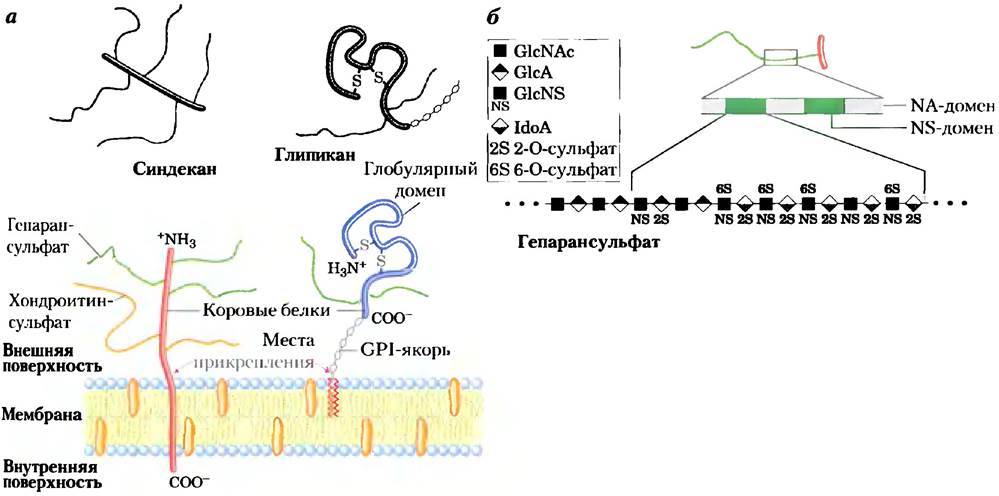
Клетки млекопитающих синтезируют около 40 типов протеогликанов. Эти молекулы влияют на многие процессы в клетке, такие как активация факторов роста и адгезия. Типичный протеогликан — коровый белок (от англ. core — ядро, центр), к которому ковалентной связью прикреплен(ы) гликозаминогликан(ы). Прикрепление к белку обычно происходит у остатка серина и осуществляется с помощью трисахаридного мостика (рис. 7-24). Наиболее часто остаток Ser, через который осуществляется связывание, встречается в последовательности -Ser-Gly-X-Gly- (где X — любой аминокислотный остаток), однако не каждый белок с такой последовательностью связан с гликозаминогликаном. Многие протеогликаны секретируются во внеклеточный матрикс, но некоторые представляют собой интегральные мембранные белки (рис. 11-6). Например, внеклеточный матрикс, разделяющий организованные группы клеток, содержит семейство коровых белков с молекулярными массами от 20 000 до 40 000, каждый из которых связан ковалентными связями с несколькими цепями геиаран- сульфата. Существуют два семейства мембранных протеогликанов гепарансульфата. У синдекана один трансмембранный домен, а также внеклеточный домен, связанный с тремя цепями гепарансульфата и двумя цепями хондроитинсульфата (рис. 7-25, а). Глипиканыприкреплены к мембране с помощью якоря, образованного производным мембранного липида фосфатидилинозита (гл. 11). И синдеканы, и глипиканы могут высвобождаться в межклеточное пространство. Протеаза внеклеточного матрикса отрезает цепь близко к поверхности мембраны, высвобождая эктодомены синдекана (домены, направленные наружу от плазматической мембраны), а фосфорилаза разрушает связь с мембранными липидами, высвобождая глипиканы. Существуют также многочисленные протеогликаны хондроитинсульфата и дерматансульфата, некоторые из них связаны с мембраной, другие секретируются в межклеточное пространство.
Рис. 7-24. Структура протеогликана. Типичный трисахарид (выделен голубым цветом) соединяет гликозаминогликан (в данном случае хондроитинсульфат, выделен оранжевым цветом) с остатком серина (розовый) в коровом белке. Остаток ксилозы на восстанавливающем конце этой линкерной последовательности своим аномерным атомом присоединен к гидроксильной группе остатка Ser.

Цепи гликозаминогликана могут связываться с различными внеклеточными лигандами и тем самым модулировать взаимодействие лиганда со специфическим рецептором на поверхности клетки. Детальное изучение гепарансульфата выявило определенную неслучайную гетерогенность его структуры; некоторые участки (обычно длиной 3-8 дисахаридных звеньев) отличаются от соседних участков по своей последовательности и по способности связывать определенные белки. Сильно сульфатированные домены (NS-домены) чередуются с участками немодифицированных остатков N-ацетил- глюкозамина G сNАс и глюкуроновой кислоты GlсА (N-ацетилированные, или NА-домены) (рис. 7-25, б). Характер сульфатирования NS-домена зависит от самого протеогликана; если учесть возможное число модификаций димера GlcNAc- IdоА, то получается, что могут существовать по меньшей мере 32 варианта дисахаридного звена. Более того, некоторые коровые белки, синтезирующиеся в различных типах клеток, могут иметь разную структуру гепарансульфата.
Рис. 7-25. Структура протеогликанов интегрального мембранного белка, а) Схематичное изображение синдекана и глипикана в плазматической мембране. Синдекан удерживается в мембране благодаря гидрофобным взаимодействиям между последовательностью неполярных остатков аминокислот и липидами плазматической мембраны; они могут высвобождаться при протеолитическом расщеплении около поверхности мембраны. В типичном синдекане аминоконцевой участок белка на внеклеточной поверхности мембраны с помощью трисахаридных линкеров ковалентно (рис. 7-24) связан с тремя цепями гепарансульфата и двумя цепями хондроитинсульфата. Глипиканы удерживаются в мембране благодаря ковалентным связям с мембранными липидами (GPI-якорь, см. гл. 11) и отрываются, если связь белок-липид разрушается фосфорилазой. Все глипиканы содержат 14 остатков Суя, которые образуют дисульфидные мостики для стабилизации белковой части и две или три цепи гликозаминогликана, прикрепленные около С-конца близко к поверхности мембраны, б) В цепи гепарансульфата участки с высоким содержанием сульфатированных остатков (S-домены, изображены зеленым цветом) чередуются с участками немодифицированных остатков GlсNАс и GlсА (NA-домены, изображены серым цветом). Отдельно показана структура одного S-домена, характеризующегося высокой плотностью модифицированных остатков: GlсА сульфатирован у атома С-6, а IdоА — у атома С-2. Точное расположение сульфатированных групп в S-домене зависит от типа протеогликана.
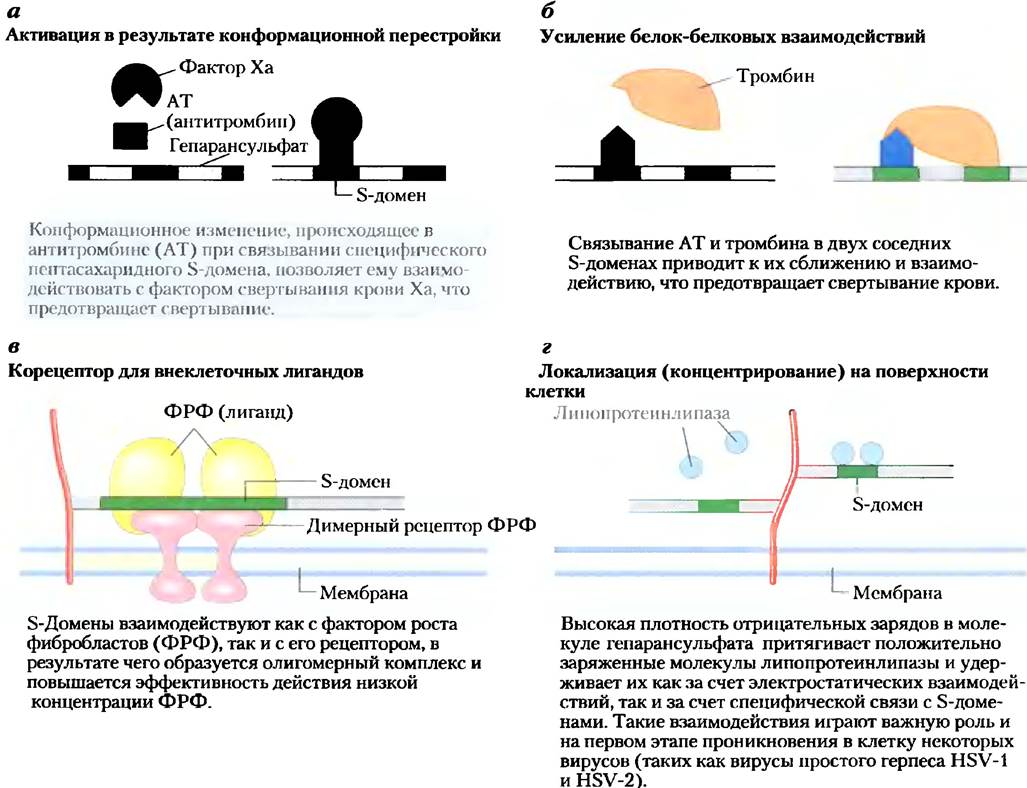
NS-домены специфическим образом связывают внеклеточные белки и сигнальные молекулы, изменяя их активность. Активность может меняться из-за конформационных изменений в молекуле белка, вызванных связыванием (рис. 7-26, а), либо вследствие способности соседних гепарансульфатных доменов связываться с другими белками, что приводит к их сближению и усилению белок-белковых взаимодействий (рис. 7-26, б). Третьим общим механизмом является связывание внеклеточных сигнальных молекул (например, факторов роста) с гепарансульфатом, что повышает их локальную концентрацию и усиливает взаимодействие с
соответствующими рецепторами на клеточной поверхности. В таком случае гепарансульфат выступает в роли корецепитора (рис. 7-26, в). Например, фактор роста фибробластов (ФРФ) — внеклеточный сигнальный белок, стимулирующий деление клетки, сначала связывается с гепарансульфатом в молекуле синдекана, находящейся в плазматической мембране клетки. Синдекан передает ФРФ его рецептору на плазматической мембране, и лишь после этого ФРФ может продуктивно взаимодействовать со своим рецептором и стимулировать деление клетки. И наконец, по механизму другого типа NS-домен с помощью электростатических или других сил взаимодействует с различными растворимыми молекулами, находящимися вне клетки, и таким образом поддерживает их высокую локальную концентрацию вблизи клеточной поверхности (рис. 7-26, г). Большое значение правильной структуры сульфатированных доменов гепарансульфата было продемонстрировано в эксперименте с так называемыми «нокаутными» мышами, которые лишены фермента, сульфатирующего гидроксильную группу у атома углерода С-2 в остатке IdоА. У таких животных отсутствуют почки и наблюдаются очень серьезные врожденные аномалии развития скелета и глаз. Другие исследования показывают, что протеогликаны мембраны играют важную роль в клиренсе липопротеинов в печени. Получены доказательства, что траектория роста аксона и, следовательно, нервная проводимость до некоторой степени определяются протеогликанами (гепарансульфатом и хондроитинсульфатом), которые подают направляющие сигналы для разрастания аксонов.
Рис. 7-26. Четыре типа взаимодействий NS-домена гепарансульфата с белками.
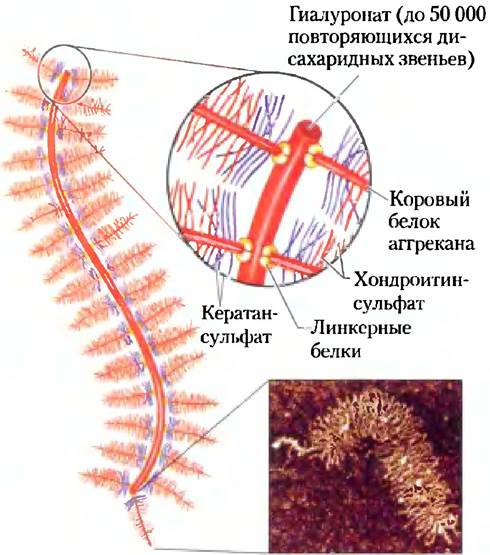
Некоторые протеогликаны способны образовывать агрегаты — огромные надмолекулярные комплексы, состоящие из множества коровых белков, связанных с одной-единствснной молекулой гиалуроната. Остаток Ser в коровом белке аггрекан (Мr ≈ 250 000) соединен через трисахаридные мостики с несколькими цепями хондроитинсульфата и кератансульфата, в результате чего мономер аггрекана имеет молекулярную массу около 2 • 106. Когда сотни подобным образом «украшенных» коровых белков связываются с одной протяженной молекулой гиалуроната (рис. 7-27), образующийся протеогликановый агрегат с молекулярной массой более 2 • 108 Да и связанная с ним гидратная оболочка занимают объем, приблизительно равный объему целой бактериальной клетки! Аггрекан прочно связывается с коллагеном во внеклеточном матриксе хряща, что важно для развития и обеспечения прочности этой соединительной ткани.
Рис. 7-27. Агрегаты протеогликанов во внеклеточном матриксе. Схематичный рисунок протеогликана с множеством молекул аггрекана. Одна очень длинная молекула гиалуроната связана нековалентными связями примерно с сотней молекул корового белка аггрекан. Каждая молекула аггрекана содержит несколько ковалентно связанных цепей хондроитинсульфата и кератансульфата. Взаимодействие этого корового белка с гиалуронатом осуществляется через линкерные белки, расположенные в каждой точке соединения цепи гиалуроната и корового белка. На фотографии представлена молекула аггрекана в атомносиловом микроскопе (см. доп. 11-1).
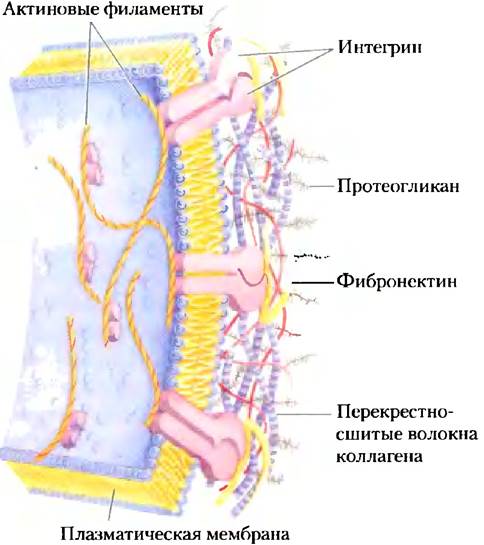
Огромные внеклеточные протеогликаны перевиты фибриллярными белками матрикса, такими как коллаген, эластин и фибронектин, что в результате приводит к образованию обширной сети, обеспечивающей прочность и эластичность внеклеточного матрикса. У некоторых из этих белков есть центры связывания для нескольких молекул матрикса. Например, фибронектин содержит отдельные участки для связывания фибрина, гепарансульфата, коллагена и семейства белков плазматической мембраны, называемых интегринами, роль которых заключается в проведении сигнала от клетки к внеклеточному матриксу (см. рис. 12-28). Общая картина взаимодействий между клеткой и матриксом (рис. 7-28) характеризуется целым комплексом связей между клеточными и внеклеточными молекулами. Эти взаимодействия важны не только для удерживания клетки в матриксе, но и для обеспечения путей передвижения клеток в развивающихся тканях и переноса информации (посредством интегринов) в клетку и из нее через плазматическую мембрану.
Рис. 7-28. Взаимодействие клетки с внеклеточным матриксом. Связь клеток с протеогликанами внеклеточного матрикса происходит с помощью мембранного белка интегрина и внеклеточного белка (например, фибронектина), который содержит центры связывания как для интегрина, так и для протеогликана. Обратите внимание на тесный контакт нитей коллагена с фибронектином и протеогликаном.
Гликопротеины содержат ковалентно связанные олигосахариды
Гликопротеины — конъюгаты белков и углеводов, в которых углеводные цепи короче и разнообразнее, чем цепи гликозаминогликанов в составе протеогликанов. Углевод присоединен через свой аномерный атом углерода к ОН-группе Ser или Thr (О-гликозидная связь) или с амидным азотом остатка Asn (N-гликозидная связь) (рис. 7-29). Некоторые гликопротеины содержат лишь одну олигосахаридную цепь, но многие имеют несколько. Углеводная часть может составлять от 1 до 70% массы гликопротеина. Муцины — это секретируемые или мембранные гликопротеины, которые могут содержать большое количество олигосахаридных цепей, связанных О-гликозидными связями. Муцины присутствуют в большинстве секретов; именно они придают слизи характерную скользкость. Около половины всех белков млекопитающих гликозилированы, а около 1% генов млекопитающих кодируют ферменты, участвующие в синтезе и прикреплении этих олигосахаридных цепей. Последовательности, присоединяемые О-гликозидными связями, обычно содержат много остатков Gly, Val и Pro. Напротив, прикрепление N-гликозидных связей зависит от наличия консенсусной последовательности N-{P}-[ST](способы изображения консенсусных последовательностей обсуждались в доп. 3-3). Как и в случае протеогликанов, занятыми оказываются не все возможные участки связывания.
Рис. 7-29. Типы связывания олигосахаридов в гликопротеинах, а) Присоединение олигосахарида с помощью O-гликозидной связи происходит путем связывания с гидроксильной группой Ser или Thr (выделены розовым цветом); в данном случае на восстанавливающем конце олигосахаридной цепи расположен GalNAc. Показаны примеры одной простой и одной сложной олигосахаридной цепи. 6) В олигосахаридах, присоединенных через N-гликозидную связь, связывание осуществляется с амидным азотом остатка Asn; здесь концевым остатком является GlcNAc. Приведены примеры трех распространенных типов олигосахаридных цепей, присоединяющихся с помощью N-гликозидной связи. Полное описание структуры олигосахарида требует определения положения и стереохимии (α/β) каждой гликозидной связи.
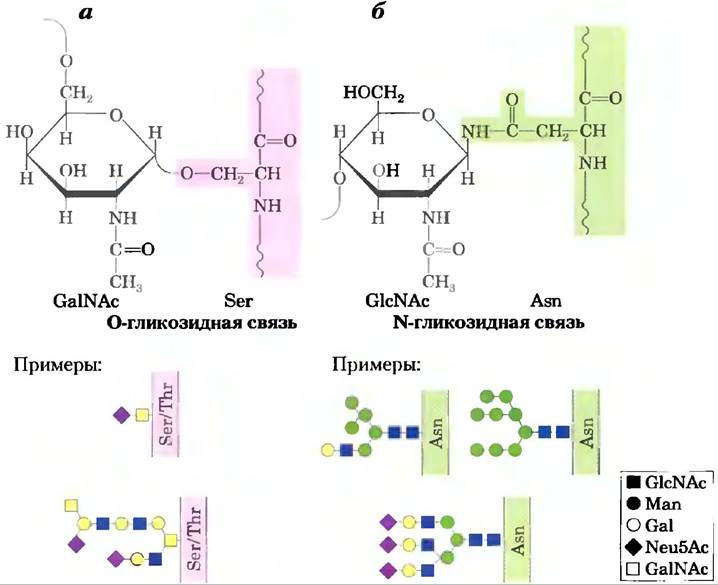
Один класс гликопротеинов, обнаруженных в цитоплазме и ядре, уникален в том смысле, что гликозилированные участки белка содержат только единичные остатки N-ацетилглюкозамина, связанные О-гликозидной связью с гидроксильной группой боковой цепи серина. Эта модификация обратима и часто затрагивает те же остатки серина, что подвергаются фосфорилированию на некоторых этапах функционирования белка. Две названные модификации являются взаимоисключающими, а данный тин гликозилирования, возможно, играет важную роль в регуляции активности белка. Мы поговорим об этом в гл. 12 при обсуждении вопросов, связанных с фосфорилированием белка.
Как мы увидим в гл. 11, на внешней поверхности плазматической мембраны сосредоточено множество мембранных гликопротеинов, к которым ковалентной связью прикреплены олигосахариды разной степени сложности. Одним из наиболее полно охарактеризованных мембранных гликопротеинов является гликофорин А мембраны эритроцита (рис. 11-7). Его массу на 60% составляют углеводы, образующие 16 олигосахаридных цепей, из 60-70 моносахаридных остатков, которые ковалентными связями соединены с аминокислотными остатками вблизи N-конца полипептидной цепи. Пятнадцать олигосахаридных цепей прикреплены О-гликозидными связями к остаткам Ser или Thr, а одна — N-гликозидной связью к остатку Asn.
Гликомика — область биохимии, занимающаяся систематической характеристикой всех углеводных компонентов определенной клетки или ткани, в том числе тех, что связаны с белками и липидами. Гликомика также изучает, с какими белками связываются те или иные гликопротеины и к какой аминокислоте в последовательности присоединяется каждый олигосахарид. Это сложное, но полезное исследование позволяет изучить характер гликозилирования в норме и его изменения при генетических заболеваниях и раке. Современные методы характеристики полного углеводного состава клетки в значительной степени определяются возможностями масс- спектрометрии (см. рис. 7-37). На сегодняшний день известны структуры множества О- и N-связанных олигосахаридов из различных гликопротеинов; на рис. 7-29 представлено несколько типичных примеров. В гл. 27 мы рассмотрим механизмы, позволяющие специфическим белкам связываться с соответствующими олигосахаридными последовательностями.
Многие белки, секретируемые эукариотическими клетками, в том числе большинство белков крови, представляют собой гликопротеины. Например, иммуноглобулины (антитела) и некоторые гормоны, такие как фолликулостимулирующий, лютеинизирующий и тиреостимулирующий, являются гликопротеинами. Гликозилированы многие белки молока, например, лактальбумин, а также некоторые белки, выделяемые поджелудочной железой (рибонуклеаза); это же относится и к большинству белков лизосом.
До сих пор не до конца понятно, какие «биологические преимущества» достигаются при гликозилировании белков. Гидрофильные углеводные кластеры изменяют полярность и растворимость белков, к которым они прикрепляются. Олигосахаридные цепи, присоединенные ко вновь синтезированным белкам в эндоплазматическом ретикулуме и окончательно сформированные в аппарате Гольджи, указывают место назначения, а также участвуют в контроле качества белков, указывая на подлежащие уничтожению неправильно свернутые белки (рис. 27-39). Когда многочисленные отрицательно заряженные олигосахаридные цепи образуют кластер в определенном участке белка, возникающее между ними отталкивание способствует возникновению на данном участке вытянутой, палочковидной структуры. Большой объем и отрицательный заряд олигосахаридных цепей защищают некоторые белки от атаки протеолитическими ферментами. Кроме подобного глобального влияния на структуру белка олигосахаридные цепи оказывают и более специфическое воздействие (разд. 7.4). Важная роль нормального гликозилирования белка становится очевидна, если учесть, что, по крайней мере, 18 различных наследственных нарушений гликозилирования у человека связаны с тяжелыми патологиями физического и умственного развития, а некоторые из этих нарушений фатальны.
Гликолипиды и липополисахариды — компоненты мембран
В клетке не только гликопротеины содержат сложные олигосахаридные цепи. Некоторые липиды также ковалентно связаны с олигосахаридами. Ганглиозиды — мембранные липиды эукариотических клеток; полярная головка липида, участвующая в образовании внешней поверхности мембраны, представляет собой сложный олигосахарид, содержащий сиаловую кислоту (рис. 7-9) и другие моносахаридные остатки. Некоторые олигосахаридные цепи ганглиозидов, например, те, что определяют группу крови человека (рис. 10-15), идентичны олигосахаридам, обнаруженным в составе некоторых гликопротеинов, которые, следовательно, также вносят вклад в определение группы крови. Подобно олигосахаридным цепям гликопротеинов, олигосахариды мембранных липидов обычно (возможно, всегда) располагаются на внешней поверхности плазматической мембраны.
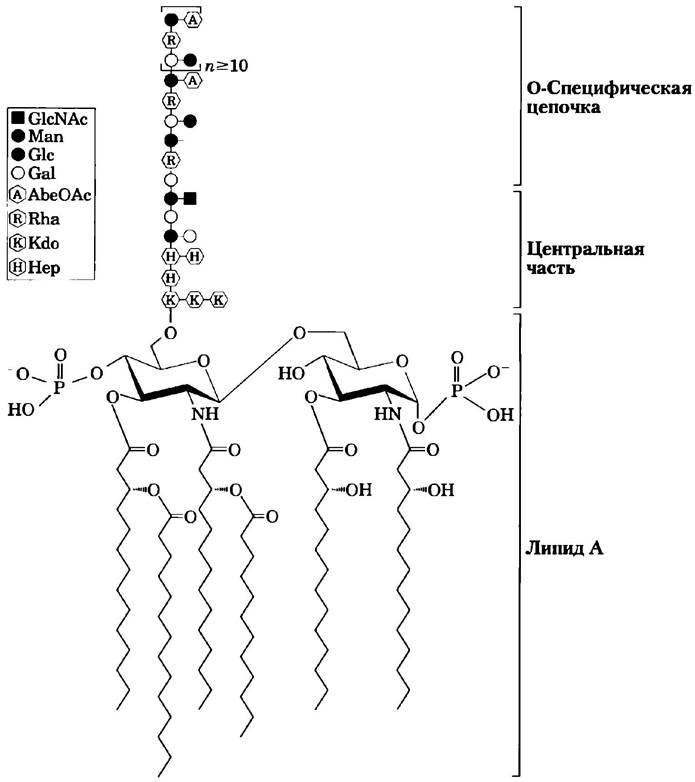
Липополисахариды являются характерной особенностью мембраны грамотрицательных бактерий, таких как Escherichia coli и Salmonella typhimurium. Эти молекулы в первую очередь узнаются антителами, вырабатываемыми иммунной системой в ответ на бактериальную инфекцию, и, следовательно, являются важными отличительными признаками серотипов бактериальных штаммов (серотипы — это штаммы, различающиеся антигенными свойствами). Липополисахариды S. typhimurium содержат шесть жирных кислот, связанных с двумя остатками глюкозамина, к одному из которых прикрепляется сложный олигосахарид (рис. 7-30). Мембрана Е. coli имеет похожие по структуре, но другие липополисахариды. Липополисахариды некоторых бактерий токсичны для человека и животных; например, они отвечают за резкое снижение кровяного давления при инфекционно-токсическом шоке, вызванном грамотрицательными бактериями. ■
Рис. 7-30. Липополисахариды бактерий. Схематическое представление структуры липополисахарида внешней мембраны Salmonella typhimurium: Kdo — это 3-дезокси-D-монно-октулозоновая кислота, Нер — это L-глицеро-D-монно-гептоза, АbеОАс — это абеквоза (3,6-дидезоксигалактоза), ацетилированная по одной из гидроксильных групп. Липидная часть молекулы (липид А) содержит шесть жирных кислот. Разные бактерии несколько различаются структурой липополисахаридов, но все они содержат липидный участок (липид А), центральный олигосахарид и О-специфическую цепочку, определяющую серотип бактерии (ее иммуногенность). Внешние мембраны грамотрицательных бактерий S. typhimurium и Е. coli содержат так много молекул липополисаха- ридов, что практически вся поверхность клеток покрыта О-специфическими цепочками.
Краткое содержание раздела 7.3 Гликоконъюгаты: протеогликаны, гликопротеины и гликолипиды
■ Протеогликаны представляют собой гликоконъюгаты, в которых коровый белок ковалентно связан с одним или несколькими большими молекулами гликанов, таких как гепарансульфат, хондроитинсульфат или кератансульфат. На долю гликана приходится основная часть массы молекулы. Протеогликаны связываются с внешней поверхностью плазматической мембраны посредством трансмембранного пептида или ковалентно связанного липида и обеспечивают участки прикрепления, узнавания и передачи информации между клетками или клетками и внеклеточным матриксом.
■ Гликопротеины содержат ковалентно связанные олигосахариды, которые меньше по размеру, но более сложно организованы (и, следовательно, несут большее количество информации), чем гликозаминогликаны. Многие белки клеточной поверхности, внеклеточные белки и большинство секретируемых белков на самом деле являются гликопротеинами. Ковалентно связанные с белком олигосахариды влияют на фолдинг и устойчивость белков, а также сообщают необходимую информацию относительно пути следования вновь синтезированных белков и обеспечивают специфическое узнавание другими белками.
■ Гликомика занимается определением полного состава сахаросодержащих молекул клетки или ткани, а также изучением функций всех этих молекул.
■ Гликолипиды растений и животных и липополисахариды бактерий — это компоненты покровов клетки, содержащие ковалентно связанные олигосахаридные цепи, располагающиеся на внешней поверхности клеток.