ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
9. ТЕХНОЛОГИЯ НА ОСНОВЕ ИНФОРМАЦИИ ИЗ ДНК
9.3. От геномов к протеомам
Ген — не просто последовательность ДНК; это информация, которая преобразуется в полезный продукт белок или функциональную молекулу РНК, когда это нужно клетке и если это нужно клетке. Первым и наиболее очевидным шагом в исследовании последовательностей генома является составление каталога продуктов генов в таком геноме. Гены, кодирующие РНК в качестве окончательного продукта, несколько труднее идентифицировать, чем белок-кодирующие гены, и даже последние бывает очень трудно определить в геноме позвоночных. Изучение информации, которую таит в себе последовательность ДНК, привело к неожиданному заключению. Несмотря на многие годы успехов биохимии, в каждой эукариотической клетке остались тысячи белков (и довольно много у бактерий), о которых нам ничего не известно. Эти белки могут участвовать в еще нс открытых процессах или содействовать неизвестным образом процессам, о которых, как нам кажется, все известно. Вдобавок к этому геномные последовательности ничего нам не говорят о трехмерной структуре белков или о том, как белки модифицируются после синтеза. Белки со своими бесчисленными и незаменимыми функциями в клетке становятся центром новых стратегий развития всей биохимии клетки.
Множество белков, экспрессируемых геномом, называется его протеомом; этот термин впервые появился в научной литературе в 1995 г. Затем быстро развилась новая область знаний под называнием протеомика. Задача, которую должна решать протеомика, очевидна, хотя решения еще нет. В каждом геноме есть тысячи генов, кодирующих белки, и в идеале мы хотим знать структуру и свойства всех этих белков. Принимая во внимание, что многие белки преподносят сюрпризы даже после многолетнего изучения, исследование целого протеома становится пугающим предприятием. Простое определение функций новых белков требует интенсивной работы. По теперь биохимики могут использовать рациональные методы, располагая множеством новых и усовершенствованных технологий.
Функции белков можно описать на трех уровнях. Фенотипическая функция характеризует эффекты белков на целый организм. Например, нехватка белка может привести к замедлению роста организма, к измененному его развитию или даже к смерти. Клеточная функция характеризует сеть взаимодействий с участием белков на клеточном уровне. Взаимодействия с другими белками в клетке помогают определять разновидности метаболических процессов, в которых белок принимает участие. Наконец, молекулярная функция относится к определенной биохимической активности белка со всеми тонкостями, например, к реакциям ферментативного катализа или к лиганд-рецепторным взаимодействиям.
Для некоторых геномов, таких как у дрожжей Saccharomyces cerevisiae и у растения р. Аrаbidopsis, распространенным подходом является инактивация каждого гена методами генной инженерии и исследование этого действия на организм. Если характер роста или другие свойства организма меняются (или если рост вообще не наблюдается), это позволяет судить о фенотипической функции белкового продукта гена.
Есть также три других основных способа изучить функционирование белков: 1) последовательное и структурное сравнение с генами и белками, функции которых уже известны, 2) выяснение, когда и где экспрессируется ген, и 3) исследование белок-белковых взаимодействий. Рассмотрим каждый из этих подходов по очереди.
Многие из подходов, разработанных для изучения функций отдельных белков, можно применить к анализу одновременно большого количества белков. Развивающаяся область науки системная биология рассматривает множество биохимических процессов в клетке, включая изменение белкового состава клетки, при изменениях условий окружающей среды или при генетическом стрессе. В данной книге при описании тех или иных биохимических или генетических методов мы указываем на возможность их применения для решения задач системной биологии.
Взаимосвязи структуры и последовательности белка дают информацию о его функциях
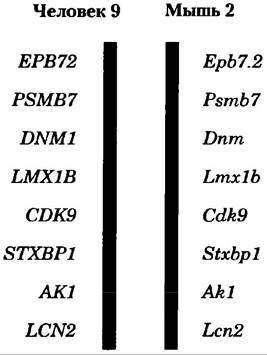
Быстрое накопление информации о последовательностях геномов в значительной степени расширило наше понимание процессов эволюции (см. разд. 3.4, с. 156). Другой важной причиной секвенирования многих геномов является создание базы данных, которую можно использовать для установления функций генов сравнением геномов, и такое направление называется сравнительной геномикой. Иногда у только что открытого гена есть гомологическое сходство последовательности с ранее изученным геном у того же или другого вида, и поэтому его функцию можно полностью или частично определить на основе такой связи. Гены, обнаруженные у разных видов, но обладающие явным сходством последовательности и функций, называются ортологами. Гены, связанные друг с другом подобным образом в пределах одного вида, называются паралогами (с. 61). Если функция гена уже была установлена у одного вида, то эту информацию можно использовать для определения функции гена у ортолога, найденного в другом виде. Сходство легче всего обнаружить, сравнивая геномы относительно близкородственных видов, например, мыши и человека, хотя много явно ортологичных генов было обнаружено у таких дальних видов, как бактерия и человек. Иногда сохраняется даже расположение генов на хромосоме в больших сегментах геномов близкородственных видов (рис. 9-20). Сохраняющееся расположение генов, называемое синтенией, еще раз свидетельствует об ортологической связи между генами на одинаковых участках родственных сегментов.
Рис. 9-20. Синтения в геномах мыши и человека. Большие сегменты геномов мыши и человека имеют близкородственные гены/ расположенные на хромосоме в одном и том же порядке, и такая связь называется синтенией. Изображены сегменты 9-й хромосомы человека и 2-й хромосомы мыши. Гены в этих сегментах обладают высокой степенью гомологичности и одинаковым порядком следования. Различные надписи названий генов отражают разные правила обозначения одних и тех же генов в обоих организмах.
С другой стороны, последовательности, связанные с определенными структурными мотивами белка (гл. 4), можно выявить в нем самом. Присутствие структурного мотива может означать, что белок, скажем, катализирует гидролиз АТР, связывается с ДНК или образует комплекс с ионами цинка, что помогает определить молекулярную функцию. Такие связи определяются с помощью постоянно совершенствующихся компьютерных программ, и лимитирует этот процесс только имеющаяся информация о гене и структуре белка, и наша способность связать последовательности с определенными структурными мотивами.
Для установления функций на основе структурных взаимосвязей был начат широкомасштабный проект по структурной протеомике. Цель его заключается в кристаллизации и определении структуры как можно большего числа белков и белковых доменов, зачастую обладая минимальной или вообще не имея никакой информации об их функции. Проекту способствовала автоматизация некоторых утомительных этапов кристаллизации белка (см. доп. 4-5). Как только выясняется структура, она становится доступной в базах данных структур, о которых говорилось в гл. 4. Такой подход должен помочь определить степень вариации структурных особенностей. Если выясняется, что у только что открытого белка в структуре имеются элементы, которые однозначно напоминают структурные мотивы с известной функцией из базы данных, то на основе этой информации можно предположить молекулярную функцию такого белка.
Паттерны клеточной экспрессии могут прояснить функцию гена в клетке
В каждом вновь расшифрованном геноме исследователи находят кодирующие белки гены, не имеющие однозначных структурных взаимосвязей с уже известными генами или белками. В этих случаях для получения информации о функции гена можно использовать другие подходы. Выяснение того, в каких тканях экспрессируется ген или при каких условиях происходит образование генного продукта, может снабдить нас драгоценными ключами к разгадке. Для изучения таких паттернов было разработано много разных методик.
Двумерный гель-электрофорез. Как показано на рис. 3-21, с помощью двумерного гель- электрофореза можно обнаружить и разделить до 1000 различных белков в одном геле. Затем можно использовать масс-спектрометрию (см. доп. 3-2), чтобы частично определить области отдельных белков и сопоставить каждый белок с соответствующим ему геном. Помочь определить функцию гена в клетке может появление и не появление (или исчезновение) областей определенных белков в пробах из различных тканей, из одинаковых тканей на разных этапах развития или из тканей, обработанных способами, имитирующими множество биологических условий.
На таких гелях одновременно можно увидеть большое количество различных белков, поэтому данный метод используется в системной биологии. Например, патогенная бактерия может измениться таким образом, что станет устойчивой к действию одного или нескольких антибиотиков. Существует высокая вероятность того, что белковый состав такой бактериальной клетки изменится.
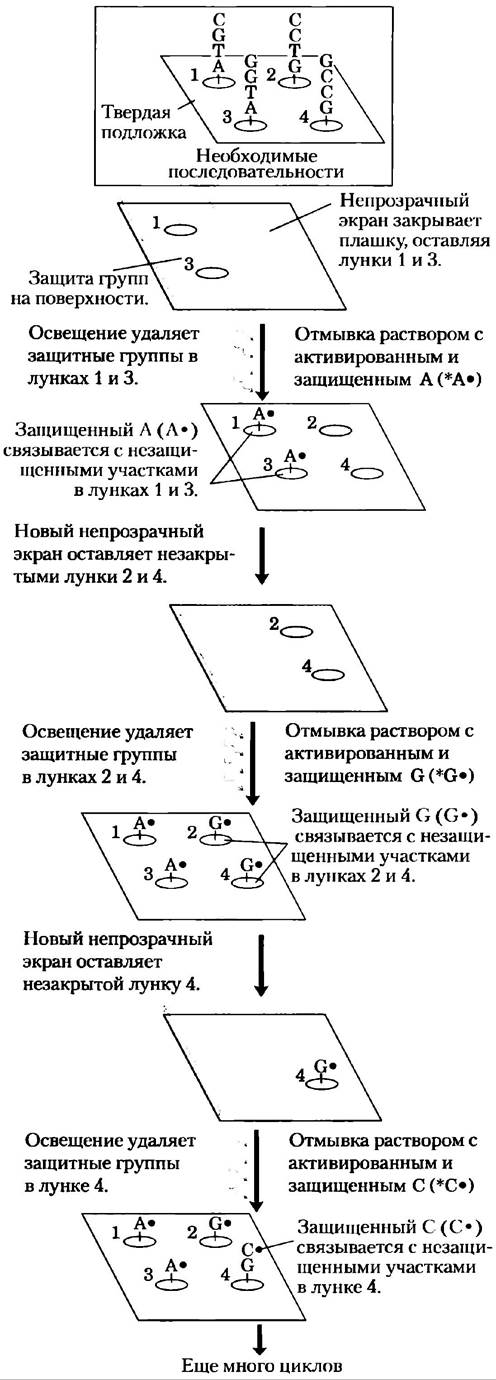
ДНК-микрочипы. Основные усовершенствования технологии, лежащей в основе библиотек ДНК, ПЦР и гибридизации, объединились при создании ДНК-микрочипов(называемых иногда просто ДНК-чипами), которые позволяют осуществлять быстрый и одновременный скрининг нескольких тысяч генов. При использовании автоматизированных устройств, которые очень точно наносят нанолитровые количества раствора ДНК, сегменты ДНК известных генов длиной от нескольких десятков до сотен нуклеотидов амплифицируют с помощью ПЦР и помещают на твердую подложку. В специально разработанном чипе на площади поверхности всего в несколько квадратных сантиметров размещается до миллиона таких капель. При альтернативном подходе ДНК синтезируется непосредственно на твердой подложке с использованием фотолитографии (рис. 9-21). После приготовления чипа его можно зондировать с помощью мРНК или кДНК из определенного типа клеток или клеточной культуры для идентификации генов, которые в них экспрессируются.
Рис. 9-21. Фотолитография. В этом методе приготовления ДНК-микрочипов используются предшественники нуклеотидов, которые активируются светом, присоединяя один нуклеотид к другому в ходе фотореакции (в противоположность химическому процессу, изображенному на рис. 8-35). В компьютер заносится информация об олигонуклеотидных последовательностях, которые надо синтезировать в каждой ячейке на твердой подложке. Сначала активные группы на поверхности заблокированы с помощью защитных фотоактивных групп (•). Покрывающий поверхность экран открывается в тех областях, которые должны принять определенный нуклеотид. Вспышка света удаляет защитную группу в этой незакрытой области. Затем поверхность промывают раствором соответствующего активированного нуклеотида (например, *А•), способного реагировать по своей 3'-гидроксильной группе (*). Защитная группа, связанная с 5'-гидроксильной группой нуклеотида, предотвращает протекание нежелательных реакций; в результате нуклеотид оказывается связанным с поверхностью освещенной зоны через свою 3'-гидроксильную группу. Затем экран меняют на другой, предназначенный для избирательного освещения участков, которые должны принять нуклеотид б. Вспышка света удаляет защитные 5'-группы на ранее связанных нуклеотидах. Далее добавляют раствор *G•, и нуклеотид связывается в соответствующих местах. Затем поверхность последовательно обрабатывают растворами двух других активированных нуклеотидов (*G• и *Т•), используя селективные экраны, обеспечивающие встраивание правильных нуклеотидов в правильной последовательности. Этот процесс продолжается до тех пор, пока искомые последовательности не будут построены в каждой ячейке подложки. В каждой точке создается множество полимеров с одинаковой последовательностью, а не только один, как изображено здесь. К тому же на подложках располагаются тысячи ячеек с различными последовательностями (рис. 9-22), а для иллюстрации процесса на данном чипе показано всего четыре ячейки.
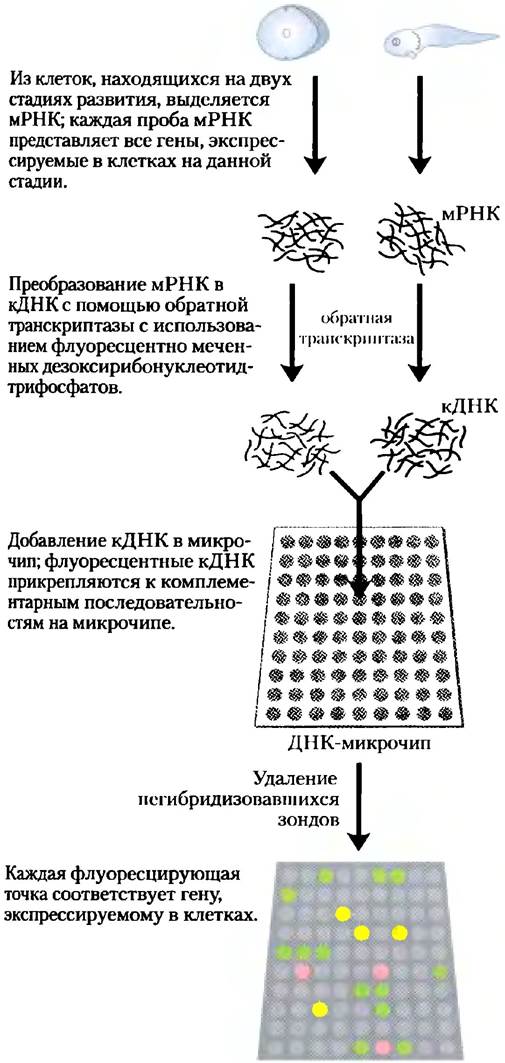
Использование микрочипов позволяет ответить на вопросы о том, какие гены экспрессируются на каждой стадии развития организма. Из клеток на двух разных стадиях развития извлекают полный набор мРНК и преобразуют в кДНК с помощью обратной транскриптазы и флуоресцентно меченных дезоксирибонуклеотидов. Флуоресцентные кДНК смешивают и используют в качестве зондов, каждый из которых гибридизуют с комплементарными последовательностями на микрочипе. Например, на рис. 9-22 меченые нуклеотиды используют, чтобы кДНК для каждой пробы флуоресцировала двумя разными цветами. Затем кДНК из двух проб смешивают и используют для зондирования микрочипа. Точки, флуоресцирующие зеленым цветом, соответствуют мРНК, которых больше всего на одноклеточной стадии; те же, которые флуоресцируют красным, соответствуют последовательностям, преобладающим на более поздних стадиях развития. мРНК, которые присутствуют на обеих стадиях развития в одинаковых количествах, флуоресцируют желтым цветом. Используя смесь двух проб для измерения относительного, а не абсолютного избытка последовательностей, метод вносит поправки на разброс в количествах ДНК, первоначально размещенных в каждой ячейке на подложке, и на другие возможные погрешности в ячейках на микрочипе. Флуоресцирующие ячейки дают снимок всех генов, экспрессируемых в клетках на момент отбора образца — экспрессии генов в масштабах генома. Что касается генов с неизвестной функцией, то время и условия их экспрессии могут дать важные сведения об их роли в клетке.
Рис. 9-22. ДНК-микрочип. Микрочип можно приготовить из любой известной последовательности ДНК, из любого источника, созданного химическим синтезом или с помощью ПЦР. ДНК размещается на твердой подложке (как правило, это специально обработанные стеклянные пластинки) с помощью автоматизированных устройств, способных нанести очень малые (нанолитровые) капли в точные местоположения. Под действием УФ-света происходит связывание ДНК с пластинками. Как только ДНК прикрепилась к поверхности, микрочип можно зондировать другими флуоресцентно меченными нуклеиновыми кислотами. На рисунке пробы мРНК берут из клеток лягушки на двух стадиях ее развития. На основе нуклеотидов, флуоресцирующих разным цветом, для каждой пробы создают кДНК- зонды; для зондирования микрочипа используется смесь кДНК. Зеленые точки соответствуют мРНК, преобладающим на одноклеточной стадии; красные точки — последовательностям, чаще встречающимся на более поздних стадиях развития организма. Желтые точки указывают на примерно одинаковое количество мРНК на обеих стадиях. Синтез олигонуклеотидных чипов
Пример микрочипа (рис. 9-23) демонстрирует впечатляющие результаты, которых можно достичь. Сегменты каждого из более чем 6000 генов полностью расшифрованного генома дрожжей были по отдельности амплифицированны с помощью ПЦР, и каждый сегмент размещался на подложке в определенном месте, образуя показанный микрочип. Этот чип представляет собой, в некотором роде, снимок целого генома дрожжей.
Рис. 9-23. Увеличенное изображение ДНК-микрочипа. Каждая светящаяся точка на микрочипе содержит ДНК одного из 6200 генов генома дрожжей (S. cerevisiae), причем каждый ген представлен в чипе. Микрочип зондировали флуоресцентно меченной нуклеиновой кислотой, полученной из мРНК, выделенной, (1) когда клетки росли в культуре нормально, и (2) после 6 часов после того, как клетки начали образовывать споры. Зеленые точки соответствуют генам, которые экспрессируются лучше всего во время нормального роста; красные точки — генам, которые экспрессируются преимущественно во время спорообразования. Желтые точки соответствуют генам, которые не меняют уровня своей экспрессии во время спорообразования. Изображение приведено с увеличением, на самом деле размеры микрочипа всего 1,8 х 1,8 см. Скрининг олигонуклеотидного чипа для получения паттерна генной экспрессии

Микрочипы — незаменимый инструмент в системной биологии; они позволяют исследователю анализировать изменения экспрессии генов на клеточном уровне. Объектом анализа может быть, как один ген, так и целый геном. Тот же подход применим и для анализа изменений ДНК, таких как генетические изменения, возникающие в результате естественного отбора, или простые вариации в популяции. Если в популяции бактерий возникает новый фенотип, что говорит о наличии одной или нескольких мутаций, микрочипы позволяют быстро идентифицировать эти мутации. Для этого чип с ДНК бактерии дикого типа гибридизуют с ДНК из мутантных клеток. Там, где ДНК из клеток дикого типа и из мутантов различаются, гибридизации не происходит, что выражается в виде определенного сигнала. Установление полной нуклеотидной последовательности позволяет точно определить изменения, произошедшие в этом участке ДНК. Данный подход может использоваться в медицине, например, для изучения новых штаммов вирусов или патогенных бактерий, устойчивых к действию антибиотиков.
■ Применение микрочипов уже достаточно активно происходит в тех областях медицины, которые связаны с изучением раковых заболеваний. Различные типы опухолевых клеток в организме человека (и даже в одной конкретной ткани) могут сильно различаться по скорости роста, способности образовывать метастазы и по реакции па проводимое лечение. Часто невозможно определить тип опухоли только на основании внешних признаков. Однако раковые клетки имеют характерный вид экспрессии генов, называемый транскрипционным профилем, который при различных видах рака имеет довольно выраженные особенности. Это может служить основой для определения типа опухоли. В качестве примера приведем явный прогресс, который происходи т в области диагностики и лечения рака молочной железы. За последнее десятилетие в многочисленных клинических исследованиях с помощью микрочипов были определены транскрипционные профили нескольких тысяч типов рака молочной железы. Были созданы новые протоколы лечения, а успехи и неудачи тщательно отслеживались. Были идентифицированы отдельные гены и группы генов, усиленная экспрессия которых (иногда в определенных комбинациях) может служить прогностическим фактором. В результате возникли большие базы данных, позволяющие на основании транскрипционного профиля составить прогноз н подобрать наиболее подходящий метод лечения. Такой подход уже довольно широко применяется в онкологических клиниках, а значение его по мере накопления новых данных будет еще больше возрастать как для врачей, так и для пациентов. ■
Белковые чипы. Белки тоже можно разместить па твердой подложке и использовать для определения присутствия или отсутствия других белков в пробе. Например, исследователи готовят чип с антителами к определенным белкам, разминая их в виде отдельных ячеек па твердой подложке. Добавляют смесь белков, и если в ней присутствует белок, связывающийся с любым из антител, то тогда его можно обнаружить твердофазным ИФА (см. рис. 5-26. о). Разрабатывается также много других видов и приложений белковых чипов. Это еще один метод анализа, который можно использовать для изучения как одного белка, так и всех белков какой-либо биологической системы.
Обнаружение белок-белковых взаимодействий помогает определить клеточную и молекулярную функцию
Ключом к определению функции конкретного белка является выяснение того, с чем он связывается. В случае белок-белковых взаимодействий связь белка с неизвестной функцией с белком, функция которого хорошо изучена, может оказаться неоспоримым «обвинением в соучастии». И выявить эту связь можно разнообразными способами.
Сравнения геномного состава. Хотя и не дает доказательства прямой взаимосвязи, по подсказать функцию белка может всего лишь присутствие комбинации генов в определенных геномах. Можно просто отыскать геномы с определенными генами в базах данных, а затем выяснить, какие еще гены присутствуют в тех же самых геномах (рис. 9-24). Если в геноме два гена всегда встречаются вместе, это указывает на то, что белки, которые кодируются ими, функционально связаны. Подобные корреляции чрезвычайно полезны, если функция по крайней мере одного из белков известна.
Рис. 9-24. Применение сравнительной геномики для выявления функционально связанных генов. Одно из применений сравнительной геномики заключается в приготовлении филогенетических профилей для выявления генов, которые в геноме всегда встречаются вместе. В этом примере показано сравнение генов четырех организмов, но на практике компьютерные поисковые системы могут охватить множество видов. Обозначения Р1, Р2 и т. д. относятся к белкам, которые кодируются каждым видом. В данном методе не требуются гомологичные белки. Поскольку в этом примере белки Р3 и Р6 в геноме всегда встречаются вместе, они могут быть функционально связаны. Для подтверждения этого вывода потребуются дальнейшие исследования.

Очистка белковых комплексов. Благодаря созданию библиотек кДНК, в которых каждый ген сшит с эпитопным «хвостом» или тэгом (англ. tag), ученые могут получить иммунопреципитат белкового продукта гена при помощи антитела, которое связывается с эпитоном (рис. 9-15, б). Если меченый белок экспрессируется в клетке, то другие белки, которые связываются с ним, также можно осадить. Идентификация ассоциированных белков покажет некоторые из белок-белковых взаимодействий меченого белка. Существует много вариантов этого процесса. Например, тотальный экстракт клеток, экспрессирующих меченый белок, наносят на колонку, содержащую иммобилизованное антитело. Меченый белок связывается с антителом, а белки, которые взаимодействуют с меченым белком, тоже удерживаются в колонке. Соединение между белком и тэгом разрывается специфичной протеазой, а белковые комплексы элюируются из колонки и анализируются. Эти методы можно использовать для определения сложных сетей взаимодействий внутри клетки. Многие из концевых последовательностей, перечисленных в табл. 9-3, могут применяться в аналогичных хроматографических протоколах: сродство концевой последовательности к специфическому лиганду используется для идентификации белков, способных связываться с определенным белком, в который встроена эта концевая последовательность.
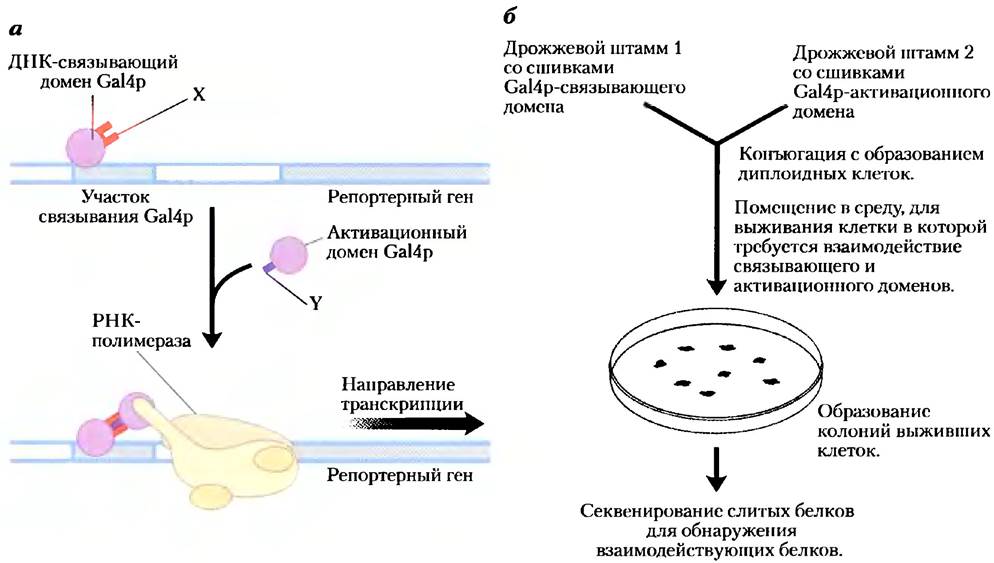
Дрожжевая двугибридная система. Усовершенствованный генетическийметодопределсниябелок- белковых взаимодействий основан на свойствах белка Gа14 (Gа14р), активирующего транскрипцию определенных генов дрожжей (см. рис. 28-31). У белка Gа14р есть два домена, один из которых связывается со специфической последовательностью ДНК, а другой активирует РНК-полимеразу, синтезирующую мРНК из соседнего репортерного гена. По отдельности каждый из доменов стабилен, по для активации РНК-полимеразы необходимо взаимодействие с активационным доменом, которому в свою очередь нужно позиционирование ДНК-связывающим доменом. Таким образом, чтобы домены работали правильно, они должны быть расположены рядом (рис. 9-25, а).
В этом методе колирующие белок участки изучаемых генов сливаются с кодирующими последовательностями либо ДНК-связывающего домена, либо активационного домена белка Gа14р, и получившиеся гены экспрессируют ряд слитых белков. Если белок, пришитый к ДНК-связывающему домену, взаимодействует с белком, пришитым к активационному домену, то начинается транскрипция. Репортерный ген, транскрибируемый при такой активации, как правило, кодирует белок, необходимый для клеточного роста, или фермент, катализирующий реакцию с окрашенным продуктом. Таким образом, при росте в подходящей среде клетки, которые содержат такую пару взаимодействующих белков, можно легко отличить от тех, которые ее не имеют. В большинстве случаев ген ДНК-связывающего домена Gа14р сливается со множеством генов в одном штамме дрожжей, а ген активационного домена Gа14р сливается со многими другими генами во втором штамме, затем штаммы дрожжей конъюгируют и выращивают колонии из отдельных диплоидных клеток (рис. 9-25, б). Это позволяет осуществлять широкомасштабный скрининг взаимодействующих в клетке белков.
Рис. 9-25. Дрожжевая двугибридная система, а) В этой системе для определения белок- белковых взаимодействий происходит соединение ДНК-связывающего и активационного доменов белка Gа14 дрожжей благодаря взаимодействию двух белков X и Y, к которым присоединен каждый из доменов. Взаимодействие вызывает экспрессию репортерного гена. б) У разных штаммов дрожжей, которые затем подвергаются конъюгации, создаются две сшивки. Конъюгированный раствор помещается в среду, в которой дрожжи не могут выжить, если у них не экспрессируется репортерный ген. Таким образом, у всех выживших колоний есть взаимодействующие пары слитых друг с другом белков. Секвенирование связанных белков у выживших клеток выявляет взаимодействующие белки. Дрожжевые двугибридные системы
Все эти методы дают важные сведения о функции белка. Тем не менее они не исключают подходов классической биохимии. Они просто предоставляют исследователю свободный доступ ко многим новым важным биологическим проблемам. Наконец, для полного понимания функциональной роли любого нового белка необходимы традиционные биохимические методы, которые, например, использовались для идентификации многих хорошо изученных белков. В совокупности с постоянно развивающимися методами биохимии и молекулярной биологии геномика и протеомика ускоряет открытие не только новых белков, но и еще не известных биологических процессов и механизмов.
Краткое содержание раздела 9.3 От геномов к протеомам
■ Протеом — совокупность белков, экспрессируемых геномом клетки. Новая область протеомики осуществляет попытку составления каталога и определения функций всех белков в клетке. Интегральный подход к анализу множества белков или других макромолекул в клетке иногда называют системной биологией.
■ Один из наиболее эффективных способов выяснения функции нового гена осуществляется методами сравнительной геномики, т. е. поиском в базах данных генов с одинаковыми последовательностями. Паралоги и ортологи — это белки (и их гены) с явными сходствами последовательностей и функций в одном и
разных видах соответственно. В некоторых случаях присутствие гена в комбинации с определенными другими генами, наблюдаемое в виде паттерна в нескольких геномах, может указать на возможную функцию.
■ Клеточные протеомы можно наблюдать двумерным гель-электрофорезом и изучать с помощью масс-спсктрометрии.
■ Функцию белка в клетке иногда можно предположить, выяснив, когда и где его ген экспрессируется. Ученые используют ДНК-микрочипы (чипы) и белковые чипы для изучения экспрессии гена на клеточном уровне.
■ С помощью некоторых новых методик, включая сравнительную геномику, иммунопреципитацию и дрожжевые двугибридные системы, можно регистрировать белок-белковые взаимодействия. Такие взаимодействия дают важные сведения о функции белка.