ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
11. БИОЛОГИЧЕСКИЕ МЕМБРАНЫ И ТРАНСПОРТ
11.3. Транспорт веществ через мембраны
Каждая живая клетка должна получать из окружающей среды материалы для биосинтеза и производства энергии и высвобождать побочные продукты метаболизма. Некоторые неполярные соединения могут растворяться в липидном бислое и пересекать мембрану самостоятельно, но полярным или заряженным веществам, или ионам для трансмембранного движения всегда необходимо участие мембранного белка. В некоторых случаях мембранный белок просто облегчает диффузию вещества по градиенту концентрации, но часто транспорт происходит против градиента концентрации, электрического заряда или того и другого; в этих случаях вещества должны «закачиваться» в клетку посредством процесса, который требует затрат энергии (рис. 11-25).
Рис. 11-25. Типы транспорта веществ через мембрану.
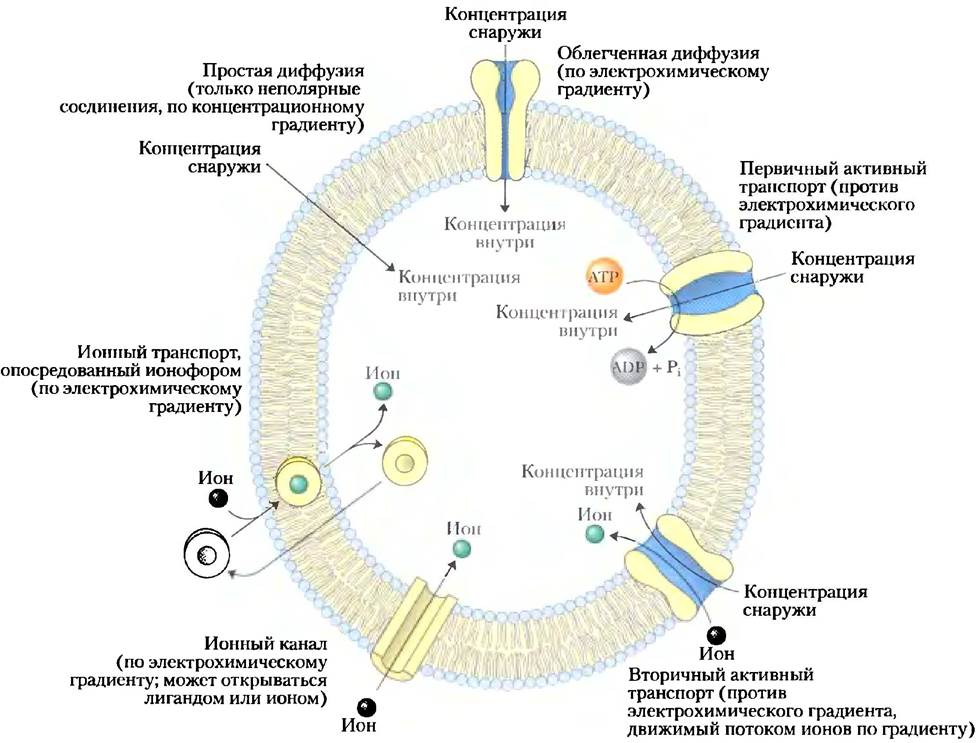
Эта энергия может поступать непосредственно от гидролиза АТР или может быть получена при движении другого вещества по электрохимическому градиенту. Ионы также могут передвигаться через мембрану через ионные каналы, образованные белками, или их могут переносить ионофоры — малые молекулы, которые экранируют заряд ионов и позволяют им диффундировать через липидный бислой. За очень редкими исключениями движение малых молекул через плазматическую мембрану опосредуется белками, такими как трансмембранные каналы, переносчики или насосы. В клетках эукариот разные компартменты содержат разные концентрации метаболических интермедиатов и продуктов, а также ионов, и они также должны переноситься через внутриклеточные мембраны посредством жестко регулируемых, опосредованных белками процессов.
Пассивному транспорту способствуют мембранные белки
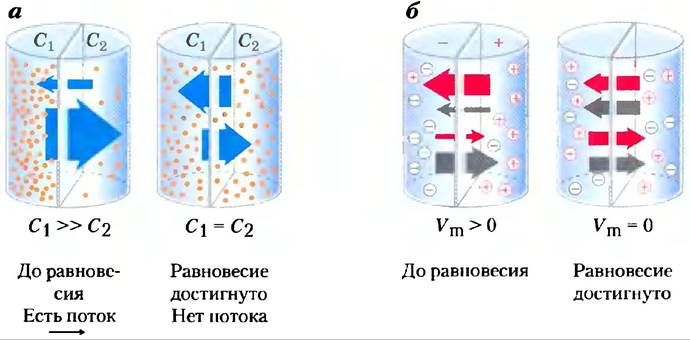
Когда два водных компартмента, содержащие неравные концентрации растворенного вещества или иона, разделены проницаемой перегородкой — мембраной, растворенное вещество движется через мембрану по механизму простой диффузии от области с большей концентрацией к области с более низкой концентрацией до тех пор, пока в обоих компартментах будет достигнута одинаковая концентрация вещества (рис. 11-26, а). Когда ионы противоположного заряда разделены мембраной, возникает трансмембранный электрический градиент — мембранный потенциал Vm (выражается в вольтах или милливольтах). Этот мембранный потенциал Vm есть та сила, которая препятствует переносу ионов через мембрану, что вызвало бы рост Vm; при этом ионы начинают двигаться так, чтобы уменьшить Vm (рис. 11-26, б). Таким образом, направление, в котором заряженное вещество спонтанно двигается через мембрану, зависит и от химического градиента (различие в концентрациях вещества), и от электрического градиента (Vm). Вместе эти два фактора определяются как электрохимический градиент или электрохимический потенциал. Такое поведение ве
ществ находится в соответствии со вторым законом термодинамики: спонтанное распределение молекул характеризуется максимальной неупорядоченностью и наименьшей энергией.
Рис. 11-26. Движение веществ через проницаемую мембрану, а) Результирующее движение электрически нейтральных веществ направлено в сторону более низкой концентрации до момента достижения равновесия. Концентрации вещества слева и справа от мембраны обозначены С1 и С2. Скорость трансмембранного движения (показана большими стрелками) пропорциональна градиенту концентрации C1/С2. б) Результирующее движение электрически заряженных веществ определяется комбинацией электрического потенциала (Vm) и разностью химических концентраций; результирующее движение ионов продолжается, пока этот электрохимический потенциал не достигнет нуля.
Чтобы пройти через липидный бислой, полярное или заряженное вещество прежде всего не должно взаимодействовать с молекулами воды в своей гидратной оболочке, затем оно должно диффундировать на расстояние ≈3 нм (30 А) через растворитель (липид, в котором оно плохо растворимо (рис. 11-27). Энергия, израсходованная на то, чтобы сбросить гидратную оболочку и перенести полярное вещество из воды через липид, приобретается вновь, когда вещество покидает мембрану с другой стороны и регидратируется. Промежуточная стадия трансмембранного перехода — это состояние с высокой энергией (ситуация такая же, как в переходном состоянии в химической реакции, катализируемой ферментом). В обоих случаях для достижения промежуточной стадии должен преодолеваться активационный барьер (рис. 11-27; ср. с рис. 6-3). Энергия активации (∆G*) транслокации полярного вещества в бислое настолько велика, что чистые липидные бислои фактически непроницаемы для полярных и заряженных частиц в течение времени, даже превосходящего периоды клеточного роста и деления.
Рис. 11-27. Изменение энергии при переходе гидрофильного вещества через липидный бислой биологической мембраны. а) При простой диффузии удаление гидратной оболочки чрезвычайно эндергоничный процесс, и энергия активации ∆G* диффузии через бислой очень высокая, б) Белок-транспортер уменьшает ∆G* диффузии вещества через мембрану. Он делает это посредством нековалентных взаимодействий с дегидратированным веществом, заменяя образование водородных связей с водой и предоставляя гидрофильный трансмембранный коридор.
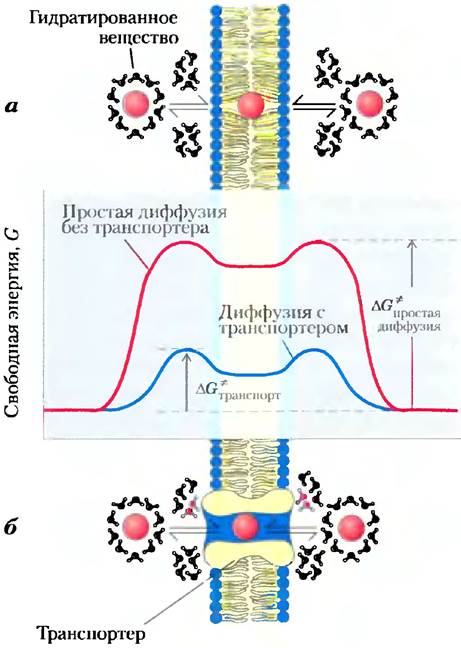
Мембранные белки понижают энергию активации транспорта полярных соединений и ионов, предоставляя специфическим веществам альтернативный путь через бислой. Белки, которые осуществляют такую облегченную диффузию (пассивный транспорт), не ферменты в обычном смысле; их «субстраты» перемещаются из одного компартмента в другой, но химически не изменяются. Мембранные белки, которые ускоряют движение вещества через мембрану путем облегченной диффузии, называются транспортерами или пермеазами.
Подобно ферментам, транспортеры связывают свои субстраты со стереохимической специфичностью посредством множественных слабых нековалентных взаимодействий. Отрицательное изменение свободной энергии, обусловленное этими слабыми взаимодействиями (∆Gсвязывания), уравновешивает положительное изменение свободной энергии, которое сопровождает потерю субстратом гидратной воды (∆Gгидратации), тем самым понижая ∆G* трансмембранпого перехода (рис. 11-27). Транспортеры пронизывают липидный бислой несколько раз, образуя трансмембранный канал, идущий параллельно гидрофильным аминокислотным боковым цепочкам. Канал предоставляет специфическому субстрату альтернативный путь перемещения через липидный бислой без необходимости растворяться в бислое, еще более понижая ∆G* трансмембранной диффузии. Результат — увеличенная на несколько порядков скорость трансмембранного перехода субстрата.
Транспортеры по их структурам можно сгруппировать в суперсемейства
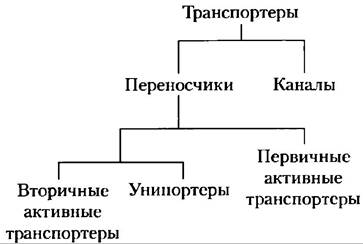
Из геномных исследований мы знаем, что транспортеры составляют существенную часть всех белков, кодируемых в геномах как простых, так и сложных организмов. В геноме человека, вероятно более 1000 различных транспортеров. Транспортеры делят на две очень большие категории: переносчики и каналы (рис. 11-28). Переносчики связываются со своими субстратами с высокой стереоспецифичностью, катализируют транспорт при скоростях, гораздо более низких, чем скорости свободной диффузии, и являются насыщаемыми в том же смысле, что и ферменты: при некоторой концентрации субстрата дальнейшее ее увеличение не приводит к увеличению скорости транспорта. Каналы обычно делают возможным трансмембранное перемещение со скоростями, на несколько порядков более высокими, чем скорости, характерные для переносчиков; процесс приближается к свободной диффузии. Каналы проявляют меньшую стереоспецифичность, чем переносчики, и не являются насыщаемыми. Большинство каналов, это олигомерные комплексы из нескольких, часто идентичных, субъединиц, в то время как многие переносчики функционируют в виде мономерных белков. Разделение на переносчики или каналы — это самая грубая классификация транспортеров. Внутри каждой из этих категорий есть разные типы суперсемейств, определяемые не только по первичным последовательностям, но и по вторичной структуре. Некоторые каналы построены главным образом из спиральных трансмембранных сегментов, другие имеют структуру β-цилиндра. Некоторые переносчики просто облегчают диффузию по концентрационному градиенту; это суперсемейство пассивных транспортеров. Активные транспортеры могут перемещать субстраты через мембрану против градиента концентрации, при этом некоторые используют энергию, выделяемую непосредственно в химической реакции (первичные активные транспортеры), а некоторые сопрягают транспорт одного субстрата с поглощением энергии, направленный в одну сторону, с транспортом другого субстрата с выделением энергии (вторичные активные транспортеры), направленным в другую сторону. Теперь нам предстоит рассмотреть несколько хорошо изученных представителей главных суперсемейств транспортеров. В последующих главах мы снова встретимся с некоторыми из этих транспортеров при обсуждении метаболических путей, в которых они участвуют.
Рис. 11-28. Классификация транспортеров.
Транспортер глюкозы эритроцитов опосредует пассивный транспорт
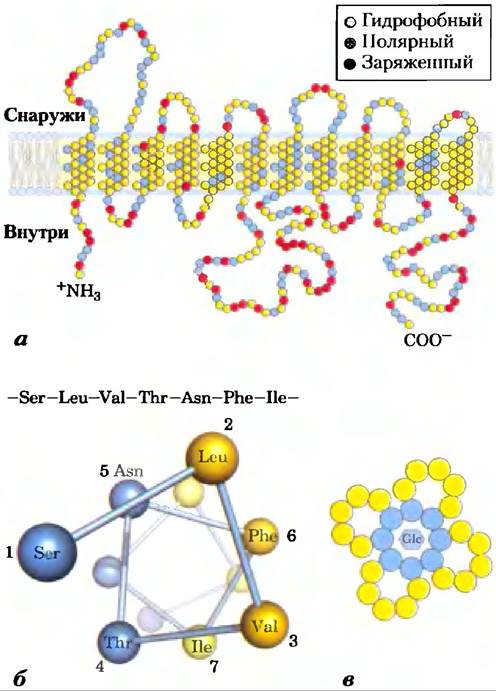
Производящий энергию метаболизм в эритроцитах зависит от постоянного поступления глюкозы из плазмы крови, где поддерживается концентрация глюкозы 5 мМ. Глюкоза попадает в эритроциты путем облегченной диффузии через специфический транспортер со скоростью, которая в 50 000 раз больше, чем скорость некатализируемой диффузии. Транспортер глюкозы эритроцитов (называемый GLUT1, чтобы отличать его от сходных глюкозных переносчиков в других тканях) является интегральным белком типа III (Мr ≈ 45 000) с 12 гидрофобными сегментами, каждый из которых, как принято считать, образует спираль, пронизывающую мембрану. В деталях структура GLUT1 пока неизвестна, но одна из правдоподобных моделей предполагает, что параллельное бок о бок расположение нескольких спиралей образует трансмембранный канал, выстланный гидрофильными остатками, которые могут образовать водородные связи с глюкозой при ее движении через канал (рис. 11-29).
Рис. 11-29. Предполагаемая структура GLUT1. а) Трансмембранные спирали представлены как наклонные ряды из трех или четырех аминокислотных остатков, каждый ряд изображает один виток α-спирали. Девять из 12 спиралей содержат три или более полярных, или заряженных аминокислотных остатков (голубые и красные), часто разделяющихся несколькими гидрофобными остатками (желтые). Данное изображение не отражает трехмерную структуру. б) Круговая диаграмма показывает распределение полярных и неполярных остатков на поверхности спирального сегмента. Вид на спираль со стороны N-конца перпендикулярно оси. Соседние остатки соединены в линейной последовательности стрелками, а каждый остаток по кругу расположен в той позиции, которую он занимает в спирали; напомним, что требуется 3,6 остатков для полного витка α-спирали. В данном примере полярные остатки (голубые) находятся на одной стороне спирали, а гидрофобные (желтые) — на другой. По определению, эта спираль амфифильна. в) Локализация бок о бок пяти или шести амфифильных спиралей, у каждой из которых полярная поверхность ориентирована по направлению к центральной полости, дает возможность образовать трансмембранный канал, выстланный полярными и заряженными остатками. Этот канал предоставляет большие возможности для образования водородных связей с глюкозой при ее движении через транспортер.
Транспорт глюкозы можно описать, используя аналогию с ферментативной реакцией, в которой «субстратом» является глюкоза вне клетки (Sснаружи), «продуктом» — глюкоза внутри внутри), а «ферментом» — транспортер (Т). Когда скорость поглощения глюкозы определяется как функция концентрации глюкозы снаружи (рис. 11-30), результирующая кривая — гипербола, и при высокой внешней концентрации глюкозы скорость поглощения приближается к Vmax. Формально такой процесс транспорта можно описать уравнениями
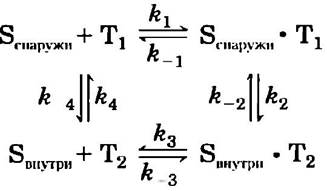
где r1, r-1 и т. д. — константы скоростей прямых и обратных реакций на каждой стадии; Т1 — конформация транспортера, обращенная наружу, а Т2 — обращенная внутрь. Все стадии транспорта глюкозы представлены на рис. 11-31. Поскольку каждая стадия обратима, переносчик, в принципе, способен как вводить глюкозу в клетку, так и выводить ее из клетки. Однако глюкоза всегда перемещается по градиенту своей концентрации; обычно это означает, что она поступает в клетку. Поступающая в клет-
ку глюкоза подвергается превращениям немедленно, так что ее внутриклеточная концентрация всегда поддерживается на низком уровне по сравнению с концентрацией в крови.
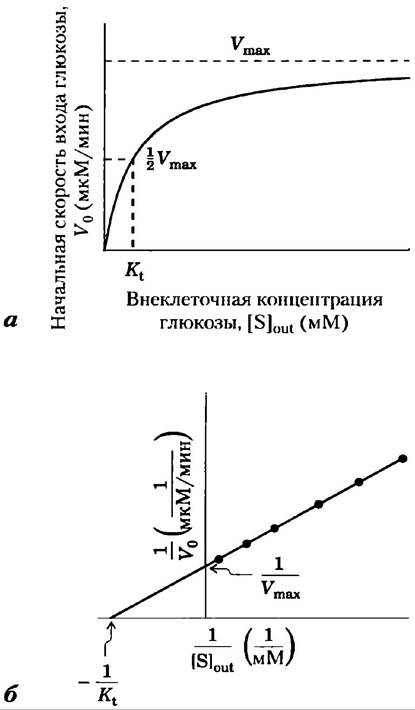
Рис. 11-30. Кинетика транспорта глюкозы в эритроциты. а) Начальная скорость входа глюкозы в эритроцит V0 зависит от начальной концентрации глюкозы вне клетки Sout(снаружи). б) График в двойных обратных координатах по данным (а). Кинетика облегченной диффузии аналогична кинетике ферментативной реакции (ср. графики рис. 6-11 и рис. 1 в доп. 6-1). Заметим, что Kt аналогична константе Михаэлиса КM.
Уравнение скорости для транспорта глюкозы можно вывести точно так же, как для ферментативных реакций (гл. 6); при этом получается выражение, аналогичное уравнению Михаэлиса-Ментен
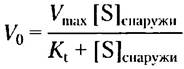 (11-1)
(11-1)
где V0 — начальная скорость накопления глюкозы внутри клетки при ее концентрации в окружающей среде [S]снаружи, а Кt — константа, аналогичная константе Михаэлиса, характерная для транспортной системы. Это уравнение описывает начальную скорость, т. е. скорость, наблюдаемую при [S] внутри= 0. Как и в случае ферментативной реакции, уравнение в двойных обратных координатах дает линейный график изменения 1/V0 от 1/[S]снаружи, откуда можем получить Кt и Vmах (рис. 11-30, б). Когда [S] = Кt, скорость поглощения составляет половину максимальной; перенос достигает половины насыщения. Концентрация глюкозы в крови 4,5-5 мМ или -3 Кt, это позволяет с полным основанием считать, что GLUT1 почти насыщен субстратом и работает со скоростью, близкой к Vmах.
Рис. 11-31. Модель переноса глюкозы в эритроциты с помощью GLUT1. Транспортер существует в двух конформациях: Т1 — со связывающим глюкозу сайтом, экспонированным на внешней поверхности плазматической мембраны, и Т2 — со связывающим глюкозу сайтом, расположенным на внутренней поверхности. Транспорт глюкозы протекает в четыре стадии. (1) Глюкоза в плазме крови связывается со стереоспецифическим сайтом на T1; это понижает энергию активации для (2) изменения конформации из Sснаружи • T1в Sвнутри • Т2, влияя на трансмембранный переход глюкозы. (3) Теперь глюкоза с Т2 высвобождается в цитоплазму, и (4) транспортер снова принимает конформацию Т1 и готов переносить другую молекулу глюкозы.
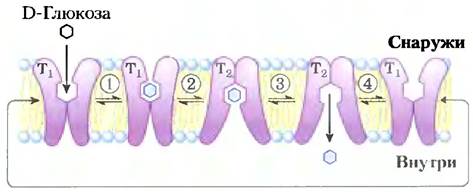
Поскольку при переходе Sснаружи в Sвнутри никаких химических связей не создается и нс разрушается, ни субстрат, ни продукт не становятся более стабильными, а, следовательно, процесс переноса глюкозы полностью обратим. По мере того как Sвнутри, приближается к Sснаружи, скорости входа и выхода становятся равными. Поэтому такая система не способна накапливать субстрат (глюкозу) внутри клетки в концентрациях, превышающих концентрацию в окружающей среде; равновесные концентрации глюкозы на обеих сторонах мембраны достигаются гораздо быстрее, чем это происходило бы в отсутствие специфического транспортера. GLUT1 специфичен к D-глюкозе, измеренная для него Кt составляет -1,5 мМ. Для близких аналогов глюкозы D-маннозы и D-галактозы, которые отличаются только положением одной гидроксильной группы, Кtсоставляет 20 и 30 мМ соответственно; для L-глюкозы Кt >3000мМ. Таким образом, GLUT1 демонстрирует три характерных для пассивного транспорта свойства: высокие скорости диффузии по градиенту концентрации, насыщаемость и специфичность.
Таблица 11-3. Транспортеры глюкозы, закодированные в геноме человека
Транспортер |
Ткани, где экспрессируется |
Ген |
Роль* |
GULT1 |
Повсеместно |
SLC2A1 |
Поглощение базальной глюкозы |
GULT2 |
Печень, островки поджелудочной железы, кишечник |
SLC2A2 |
В печени -- удаление избытка глюкозы из крови; в поджелудочной железе — регуляция высвобождения инсулина |
GULT3 |
Головной мозг |
SLC2A3 |
Поглощение базальном глюкозы |
CTJLT4 |
Мышцы, жир, сердце |
SLC2A4 |
Активность увеличивается инсулином |
GULT5 |
Кишечник, яички, почки, сперма |
SLC2A5 |
Первичный транспорт фруктозы |
GITLT6 |
Селезенка, лейкоциты, мозг |
SLC2A6 |
Вероятно, нет транспортной функции |
GULT7 |
Микросомы печени |
SLC2A7 |
- |
GULT8 |
Яички, бластодермический пузырек, мозг |
SLC2A8 |
|
GULT9 |
Печень, почки |
SLC2A9 |
- |
GULT10 |
Печень, поджелудочная железа |
SLC2A10 |
- |
GULT11 |
Сердце, скелетные мышцы |
SLC2A11 |
- |
GULT12 |
Скелетные мышцы, жировая ткань, тонкий кишечник |
SLC2A12 |
- |
* Прочерк означает, что роль пока не установлена.
МЕДИЦИНА. Нарушение транспорта глюкозы и воды при двух формах диабета
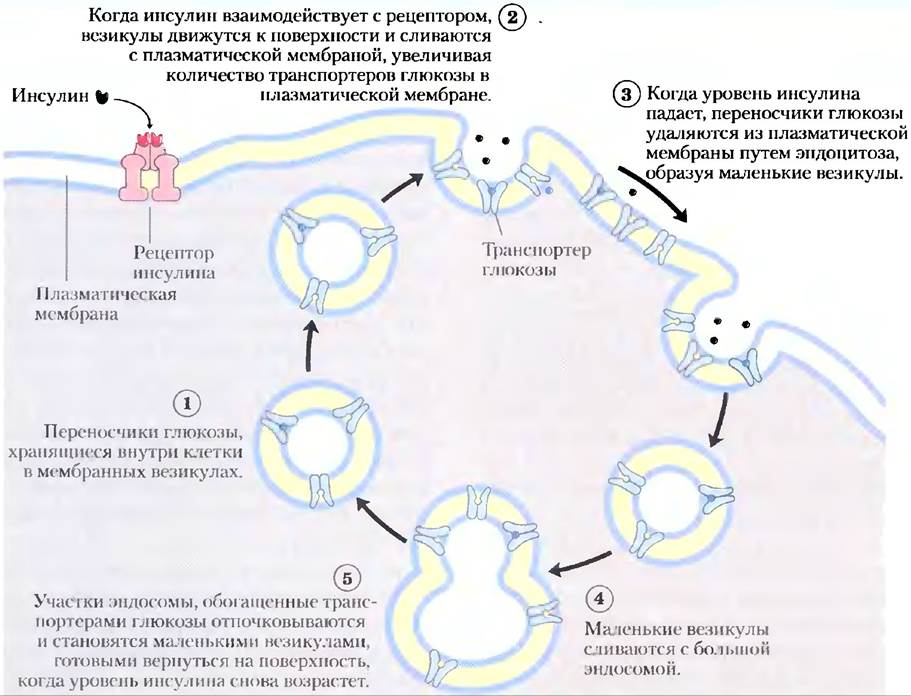
Когда переваривание богатой углеводами пищи приводит к повышенной по сравнению с нормой (-5 мМ) концентрации глюкозы между приемами нищи, избыточная глюкоза поглощается миоцитами сердечной и скелетных мышц (которые сохраняют ее в виде гликогена) и адиноцитами (которые превращают ее в триацилглицериды). Поступление глюкозы в миоциты и адипоциты опосредуется переносчиком глюкозы GLUТ4. Между приемами пищи некоторое количество GLUТ4 присутствует в плазматической мембране, но большая часть находится в мембранах маленьких внутриклеточных везикул (рис. 1). Инсулин, высвобождающийся из поджелудочной железы в ответ на высокий уровень глюкозы в крови, запускает движение этих внутриклеточных пузырьков к плазматической мембране, где они с ней сливаются, экспонируя таким образом молекулы GLUТ4 на внешней поверхности клетки (см. рис. 12-6). По мере введения в действие все большего числа молекул GLUТ4 скорость поглощения глюкозы увеличивается в 15 или более раз. Когда уровень глюкозы крови возвращается к норме, высвобождение инсулина замедляется и большинство молекул GLUТ4 удаляются из плазматической мембраны и сохраняются в везикулах.
Рис. 1. Регуляция инсулином переноса глюкозы в миоцит с помощью GLUT4.
При сахарном диабете I типа (юношеская форма) неспособность высвобождать инсулин (и соответственно приводить в действие транспортеры глюкозы)
приводит к снижению скорости поступления глюкозы в мышцы и жировую ткань. Одним из следствий этого является продолжительный период с высоким уровнем глюкозы в крови после приема богатой углеводами пищи. Это лежит в основе теста на толерантность к глюкозе для диагностики диабета (гл. 23).
Проницаемость для воды эпителиальных клеток, выстилающих почечную собирательную трубочку, обусловлена наличием аквапорина (АQР-2) в апикальных плазматических мембранах (обращенных в полость канала). Антидиуретический гормон (АДГ) регулирует удерживание воды, мобилизуя молекулы АQР-2, сохраняемые в везикулярных мембранах внутри эпителиальных клеток, во многом сходным образом с тем, как инсулин мобилизует GLUТ4 в мышечной и жировой ткани. Когда везикулы сливаются с плазматической мембраной эпителиальной клетки, проницаемость мембраны для воды очень сильно увеличивается, и большее количество воды реабсорбируется из собирательной трубочки и возвращается в кровь. Когда уровень АДГ падает, АQР-2 вновь поступает в везикулы, уменьшая удерживание воды. При относительно редком заболевании человека несахарном диабете генетический дефект в АQР-2 приводит к нарушению ресорбции воды почками. В результате происходит выделение огромных объемов очень разбавленной мочи.
В геноме человека закодированы 12 транспортеров глюкозы, каждый имеет уникальные кинетические свойства, картину распределения в тканях и функцию (табл. 11-3). В печени GLUТ2 выводит глюкозу из гепатоцитов для пополнения уровня последней в крови, когда уже использован печеночный гликоген. Для GLUТ2 Kt ≈ 66 мМ, и в соответствии с этим он может отвечать на увеличение уровня внутриклеточной глюкозы (образовавшейся при распаде гликогена) увеличением ее транспорта из клетки. В скелетных и сердечной мышцах, а также в жировой ткани работает другой транспортер глюкозы — GLUТ4 (Kt = 5 мМ), особенностью которого является стимуляция инсулином: его активность увеличивается, когда высвобождение инсулина сигнализирует о высокой концентрации глюкозы в крови, вследствие этого увеличивается скорость поглощения глюкозы мышечной или жировой тканью (в доп. 11-2 описаны некоторые дефекты этого транспортера).
Хлоридно-бикарбонатный обменник катализирует электронейтральный котранспорт анионов через плазматическую мембрану
Эритроциты содержат другую систему облегченной диффузии — анионный обменник, необходимый для транспорта СO2 к легким из таких тканей, как скелетные мышцы и печень. Продукт дыхания СO2, выделяемый из потребляющих кислород тканей в плазму крови, входит в эритроциты, где превращается в бикарбонат НСO3 ферментом карбонатгидразой. (Напомним, что НСO3 — это первичный буфер для поддержания pH крови; см. рис. 2-20.) НСО3- возвращается в плазму крови для транспорта в легкие (рис. 11-32). Поскольку растворимость НСO3 в плазме гораздо выше, чем у СO2, этот кружной путь увеличивает способность крови переносить углекислый газ из тканей в легкие. В легких НСO3 вновь поступает в эритроциты и превращается в СO2, который в конце концов высвобождается в легочное пространство и уходит с выдохом. Чтобы работать эффективно, этот челночный механизм требует очень быстрого транспорта НСO3 через мембрану эритроцита.
Рис. 11-32. Хлоридно-бикарбонатный обменник мембраны эритроцита. Эта котранспортная система делает возможными вход и выход НСО3- без изменений мембранного потенциала. Его роль заключается в увеличении способности крови переносить СO2.
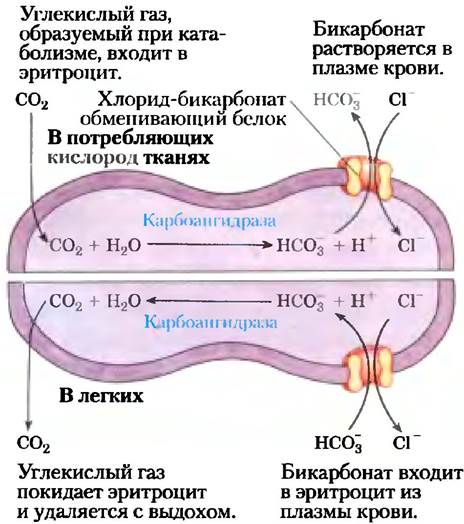
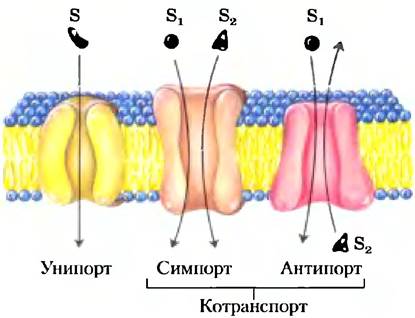
Хлоридно-бикарбонатный обменник, называемый также анионобменивающим (АЕ) белком, увеличивает проницаемость мембраны эритроцита для НСO3- более чем в миллион раз. Подобно транспортеру глюкозы, АЕ представляет собой интегральный белок, который, вероятно, пересекает мембрану по крайней мере 12 раз. Этот белок опосредует одновременное движение двух анионов: каждому иону НСO3-, который движется в одном направлении, соответствует один ион Сl-, который движется в противоположном направлении (рис. 11-33), так что в итоге нет никакого переноса заряда; обмен является электронейтральным. Сопряжение Сl и НСO3- обязательно; в отсутствие хлорида прекращается транспорт бикарбоната. В этом отношении анионный обменник типичен для всех систем, называемых котранспортными системами,которые одновременно переносят через мембрану два вещества. Когда, как в данном случае, два субстрата перемещаются в противоположных направлениях, процесс называется антипортом. При симпорте два субстрата одновременно движутся в одном направлении. Транспортеры, которые несут только один субстрат, такие как транспортер глюкозы в эритроцитах, называются системами унипорта (рис. 11-33).
Рис. 11-33. Три главных класса транспортных систем. Транспортеры отличаются количеством переносимых веществ (субстратов) и направлением, в котором каждый из субстратов транспортируется. Примеры всех трех типов транспортеров обсуждаются в тексте. Отметим, что эта классификация ничего не говорит нам о том, являются они энергопотребляющими (активный транспорт) или энергонезависимыми (пассивный транспорт).
В геноме человека обнаружены гены трех близкородственных хлоридно-бикарбонатных обменников, все они одинаково располагаются в мембране. Эритроциты содержат транспортер АЕ1, АЕ2 характерен для печени, в плазматических мембранах мозга, сердца и сетчатки присутствует АЕЗ. Подобные анионные обменники обнаружены также у растений и микроорганизмов.
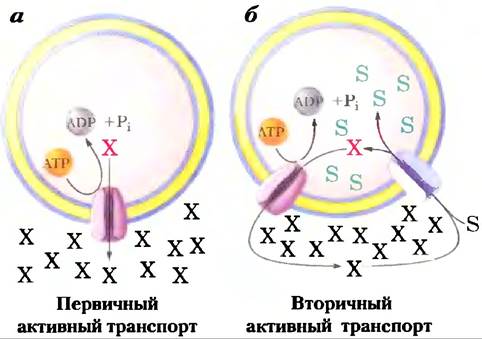
Активный транспорт приводит к перемещению веществ против градиента концентрации или электрохимического градиента
При пассивном транспорте частицы всегда движутся по электрохимическому градиенту и не накапливаются в концентрации, превышающей равновесную. Активный транспорт, напротив, приводит к накоплению веществ в концентрации выше равновесной. Активный транспорт термодинамически невыгоден (эндергоничен) и происходит только при сопряжении (прямом или непрямом) с экзергоническим процессом — поглощением солнечного света, реакцией окисления, распадом АТР или сопутствующим потоком какого-то другого вещества по его электрохимическому градиенту. При первичном активном транспорте накопление вещества сопряжено непосредственно с экзергоничсской химической реакцией, такой как превращение АТР в ADP + Pj (рис. 11-34). Вторичный активный транспортпроисходит, когда эндергопический («вверх») транспорт вещества сопряжен с экзергоническим («вниз») потоком другого вещества, которое первоначально было «закачано наверх» с помощью первичного активного транспорта.
Рис. 11-34. Два типа активного транспорта, а) При первичном активном транспорте энергия, высвобождаемая при гидролизе АТР, обеспечивает движение вещества против электрохимического градиента, б) При вторичном активном транспорте градиент иона X (часто Na+) возникает в результате первичного активного транспорта. Движение X по электрохимическому градиенту дает энергию, чтобы осуществлять котранспорт второго вещества (S) против его электрохимического градиента.
Количество энергии, необходимое для транспорта вещества против градиента концентрации, можно рассчитать из начального градиента. В химическом процессе, который превращает S в Р, происходит изменение свободной энергии:
∆G = ∆G°′ + RTIn ([Р] / [S]) (11-2)
где R = 8,315 Дж/моль • К — газовая постоянная, а T — абсолютная температура. При простой диффузии вещества из области, где его концентрация С1, в область, где его концентрация С2, никаких связей не образуется и не разрывается, и изменение стандартной свободной энергии ∆G°′ = 0. Изменение свободной энергии при транспорте ∆Gt, составляет
∆Gt = RTIn (С2/C1) (11-3)
Если концентрации вещества в двух компартментах различаются в 10 раз, энергия перемещения 1 моль незаряженного вещества при 25 °С через мембрану, разделяющую комиартменты, составляет
∆G = (8,315 Дж/моль • К) (298 К) In (10/1) = 5 700 Дж/моль = 5,7 кДж/моль
Уравнение 11-3 справедливо для всех незаряженных веществ.
■ Пример 11-1. Затраты энергии на перекачивание незаряженных растворенных веществ
Определите энергетические затраты (изменение свободной энергии) на перекачивание незаряженного растворенного вещества против 1,0 • 104- кратного градиента концентрации при 25 °С.
Решение. Используем уравнение 11-3. Подставим 1,0 • 104 вместо(С2/С1), 8,315 Дж/моль • К вместо R и 298 К вместо Т:
∆Gt = RTIn (С2/С1) = (8,315 Дж/моль • К) (298 К) In (1,0 • 104) = 23 кДж/моль
Когда транспортируется ион, его движение без сопровождающего противоположного иона приводит к эндергоническому разделению положительных и отрицательных зарядов, возникает разность потенциалов; такой процесс называется электроногенным транспортом. Энергетическая «стоимость» перемещения иона зависит от электрохимического потенциала (с. 634), суммы химического и электрического градиентов:
∆Gt = RTIn (С2/С1) + Z F ∆Ψ (11-4)
где Z— заряд иона, F = 96480 Дж/В • моль — постоянная Фарадея, ∆Ψ — мембранный потенциал (в вольтах). Для плазматической мембраны клеток эукариот ∆Ψ ≈ 0,05 В (внутри клетки более отрицательный, чем на внешней стороне), так что второй член уравнения 11-4 вносит существенный вклад в общее изменение свободной энергии при переносе иона. Концентрация ионов по разные стороны плазматических или внутриклеточных мембран в большинстве клеток различается в 10 раз, и поэтому для многих клеток и тканей активный транспорт является основным энергопотребляющим процессом.
■ Пример 11-2. Затраты энергии на перекачивание заряженного растворенного вещества
Определите энергетические затраты (изменение свободной энергии) на перекачивание ионов кальция из цитозоля, где их концентрация составляет около 1,0 • 10-7 М, во внеклеточную жидкость, где их концентрация приблизительно равна 1,0 мМ. Примите, что температура равна 37 °С (температура тела млекопитающих), а стандартный мембранный потенциал для плазматической мембраны 50 мВ (отрицательная величина внутри клетки).
Решение. В данном расчете следует учитывать, как градиент концентрации вещества, так и величину электрического потенциала. Используем уравнение 11-4. Подставим R = 8,315 ДжДмоль • К), Т= 310 К, С2 = 1,0 • 10-3, С1 = 1,0 • 10-7, F= 96500 Дж/ (В • моль), Z= +2 (для Са2+) и ∆Ψ = 0,050 В. Обратите внимание, что мембранный потенциал составляет 50 мВ (внутри клетки отрицательное значение), так что изменение потенциала при выходе иона из клетки наружу составляет 50 мВ.
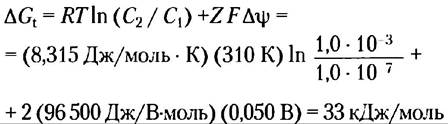
Механизм активного транспорта имеет фундаментальное значение в биологии. Как мы увидим в гл. 19, образование АТР в митохондриях и хлоропластах происходит по механизму АТР-зависимого ионного транспорта, работающего в обратном направлении. Энергия, поставляемая при спонтанном потоке протонов через мембрану, может быть рассчитана из уравнения 11-4; вспомним, что ∆G для движения по электрохимическому градиенту — отрицательная величина, a ∆G для транспорта ионов против градиента — положительная.
АТРазы P-типа подвергаются фосфорилированию в процессе каталитического цикла
К семейству активных транспортеров, называемых АТРазами P-типа, относятся переносчики катионов, которые обратимо фосфорилирутся с помощью АТР (название «Р-тип» — от обозначения фосфата), что составляет часть транспортного цикла; фосфорилирование инициирует конформационный переход, который является ключевым в перемещении катиона через мембрану. В геноме человека закодированы по крайней мере 70 транспортных АТРаз P-типа; они имеют сходные аминокислотные последовательности и структуру, особенно вблизи остатка Asp, который подвергается фосфорилированию. Все они представляют собой интегральные белки, состоящие из одной полипептидной цепи с восемью или десятью трансмембранными участками (тип III на рис. 11-8), и чувствительны к ингибированию аналогом фосфата ванадатом.
Транспортеры Р-типа широко распространены у эукариот и бактерий. Почти во всех тканях животных работают Та+/К+-АТРазы (антипортер для Na+ и К+) и Са2+-АТРазы (унипортер для Са2+) — АТРазы Р-типа, которые поддерживают различия в ионном составе между цитозолем и внеклеточной средой. Пристеночные клетки, выстилающие желудок млекопитающих, содержат АТРазу Р-типа, которая перекачивает через плазматическую мембрану Н+ и К+, обеспечивая тем самым кислотность содержимого желудка. У сосудистых растений АТРазы Р-типа выкачивают протоны из клетки, устанавливая электрохимический градиент в 2 единицы pH и 250 мВ между сторонами плазматической мембраны. Похожая АТРаза Р-типа у хлебной плесени р. Neurospora выкачивает протоны из клетки для установления отрицательного потенциала на внутренней стороне мембраны, который используется для поглощения субстратов и ионов из окружающей среды посредством вторичного активного транспорта. Бактерии используют АТРазы Р-типа для выведения токсичных ионов тяжелых металлов, таких как Cd2+ и Сu2+.
Наиболее изучена работа Са2+-насоса Р-типа, который поддерживает низкую концентрацию Са2+ в цитозоле практически всех клеток. Са2+- насос плазматической мембраныперемещает ионы кальция из клетки, а другой насос Р-типа в эндоплазматическом ретикулуме перемещает Са2+ в полость ЭР — в компартмент, отделенный от цитозоля. В миоцитах Са2+ обычно находится в специализированной форме эндоплазматического ретикулума, называемого саркоплазматическим ретикулумом; высвобождение этих ионов Са2+ служит сигналом мышечного сокращения.
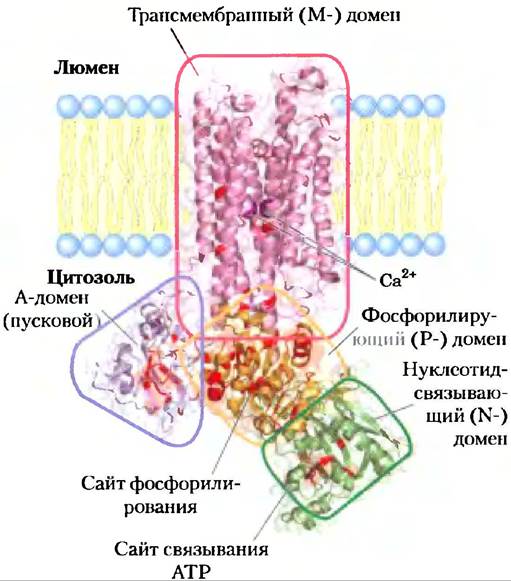
Кальциевые насосы саркоплазматического и эндоплазматического ретикулумов (SERCA) — АТРазы Р-типа, очень близкие по структуре и механизму. Насос SERCAсаркоплазматического ретикулума, на который приходится 80% белка в этой мембране, состоит из одного полипептида (Мr ~ 100 000), который пронизывает мембрану десять раз (рис. 11-35). Три цитоплазматических домена, образованных длинными петлями, соединяют трансмембранные спирали: N-домен, где связываются нуклеотид АТР и Mg2+; Р-домен, который содержит фосфорилированный остаток Asp, присущий всем АТРазам Р-типа; и А-домен (от англ. actuator — пусковой механизм), который обеспечивает контакт N- и Р-доменов с двумя Са2+-связывающими сайтами. М-домен содержит трансмембранные спирали и Са2+-связывающие сайты, которые локализованы вблизи середины мембранного бислоя на расстоянии 40-50 А от фосфорилированного остатка Asp, так что фосфорилирование-дефосфорилирование Asp не впрямую влияет на связывание ионов кальция.
Рис. 11-35. Са2+-насос саркоплазматического ретикулума: SERCA (PDB ID 1EUL). Десять трансмембранных спиралей окружают канал, по которому Са2+ движется через мембрану. Две из этих спиралей прерываются вблизи середины бислоя, а их неспиральные области образуют связывающие сайты для двух ионов Са2+ (пурпурные). Карбоксилатные группы остатка Asp в одной спирали и остаток Glu в другой главные в Са2+-связывающих сайтах. Три глобулярных домена располагаются со стороны цитоплазмы: N-домен (нуклеотид-связывающий; очерчен зеленым) имеет связывающий сайт для АТР; P-домен (фосфорилирующий) содержит остаток Asp351 (в оранжевом кружочке), который подвергается обратимому фосфорилированию, а А-домен (от англ. actuator — пусковой механизм; голубой треугольник) опосредует структурные переходы, изменяющие сродство Са2+-связывающего сайта к Са2+ и его направленность в цитоплазму или в полость ретикулума. Отметим, что между фосфорилирующим и Са2+-связывающими сайтами большое расстояние. Такая структура насоса SERCA является прототипом всех АТРаз P-типа; в ней обнаружены некоторые основания (выделены красным цветом), консервативные для всех членов семейства АТРаз Р-типа.
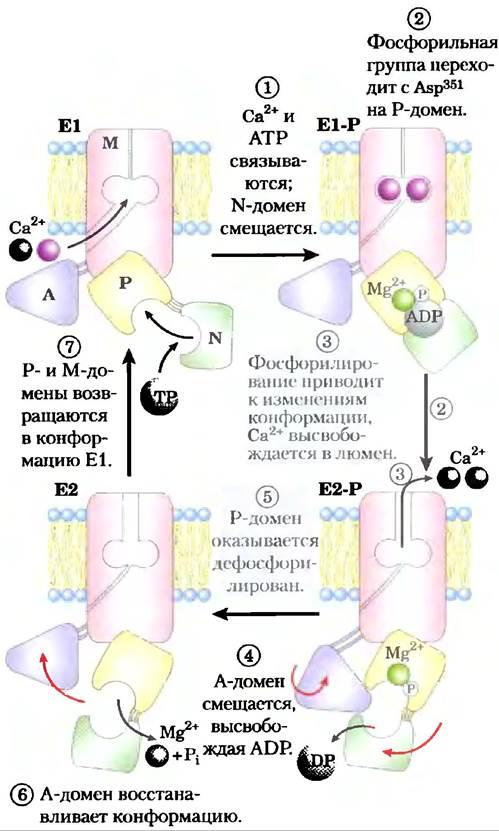
Предположительный механизм работы насосов SERCA (рис. 11-36) включает большие конформационные перестройки и фосфорилирование-дефосфорилирование ключевого остатка Asp в Р-домене, которые, как известно, происходят в течение каталитического цикла. В каждом каталитическом цикле два иона кальция проходят через мембрану, а АТР превращается в ADP и Pj. Роль связывания и гидролиза АТР — в осуществлении перегруппировки между двумя конформациями транспортера (Е1 и Е2). В конформации Е1 два Са2+-связывающих сайта находятся со стороны цитозоля в эндоплазматическом или саркоплазматическом ретикулуме и очень эффективно присоединяют ионы Са2+. Связывание АТР и фосфори- лирование Asp вызывают смену конформации Е1 на Е2, в которой Са2+-связывающие сайты обращены уже на внутреннюю (люменальную) сторону мембраны, а их аффинность к Са2+ значительно снижается, и Са2+ высвобождается в просвет полости ретикулума. По этому механизму энергия гидролиза АТР за один цикл фосфорилирования- дефосфорилирования идет на перенос Са2+ через мембрану против высокого электрохимического градиента.
Рис. 11-36. Механизм действия насоса SERCA. В начале транспортного цикла белок существует в конформации Е1, так что участки связывания ионов кальция находятся на стороне цитозоля. Происходит связывание двух Са2+, а затем молекула АТР связывается с переносчиком и фосфо- рилирует остаток Asp351, в результате чего образуется Е1-Р. Фосфорилирование способствует переходу в другую конформацию Е2-Р, в которой участки связывания ионов кальция (теперь обладающие низким сродством к ионам Са2+) оказываются на другой стороне мембраны (направлены в сторону внеклеточного пространства), что позволяет ионам кальция высвободиться и уйти. Наконец, Е2-Р подвергается дефосфорилированию, что приводит к возвращению белка в исходное состояние Е1 и к началу нового цикла переноса.
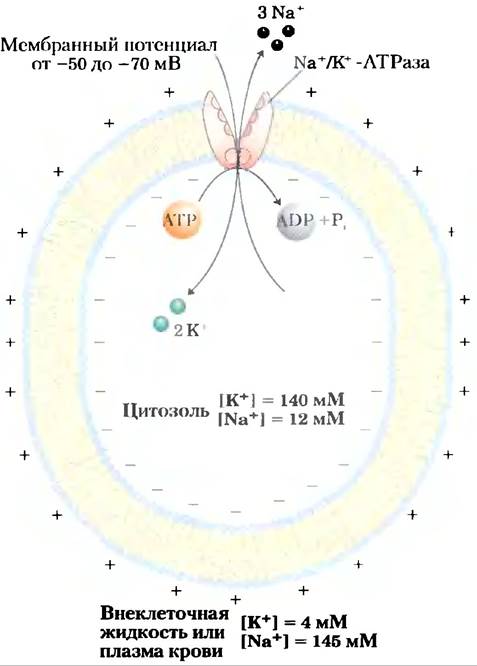
Вариации основного механизма мы находим в работе Na+/K+-ATPaзы плазматической мембраны, открытой Йенсом Скоу в 1957 г. Этот котранспортер сопрягает фосфорилирование- дефосфорилирование ключевого остатка Asp с одновременным движением Na+ и К+ против их электрохимических градиентов (рис. 11-37). Именно Na+/K+-ATPaзa отвечает за поддержание низкой концентрации Na+и высокой концентрации К+ в клетке по отношению к таковым в межклеточной жидкости (рис. 11-38). На каждую молекулу АТР, превращенного в ADP и Pj,приходится два иона К+, перемещенных внутрь, и три иона Na+, перемещенных наружу через плазматическую мембрану. Следовательно, котранспорт представляет собой электрогенный процесс, приводящий к разделению зарядов на мембране; в клетках животных образуется мембранный потенциал от -50 до -70 мВ (отрицательное значение внутри клетки по сравнению со значением снаружи). Этим свойством обладают многие клетки, а для проведения потенциалов действия в нейронах это имеет решающее значение. Центральная роль Nа+/К+-АТРазы отражается в энергии, вкладываемой в одну эту реакцию, — она составляет около 50% всей энергии, расходуемой человеком в состоянии покоя!

Рис. 11-37. Предположительный механизм транспорта Na+/K+-АТРазой ионов Na+ и К+.
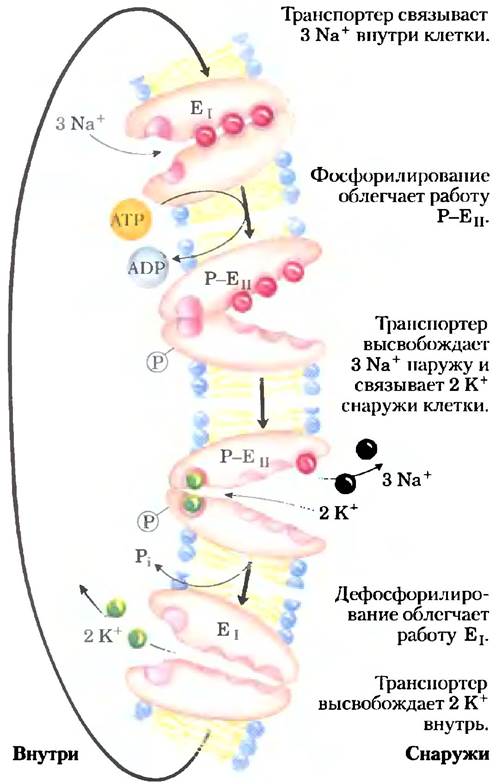
Рис. 11-38. Роль Na+/К+-АТРазы в клетках животных. В клетках животных эта система активного транспорта отвечает прежде всего за установление и поддержание внутриклеточной концентрации Nа+ и К+ и за генерацию трансмембранного электрического потенциала. Это достигается переносом трех ионов Nа+ из клетки на каждые два К+, поступающих внутрь. Электрический потенциал играет главную роль в электрической сигнализации в нейронах, а градиент Na+ используется для обеспечения котранспорта против градиента веществ в многих типах клеток.
АТРазы Р-типа — это обратимые АТР-зависимые протонные насосы
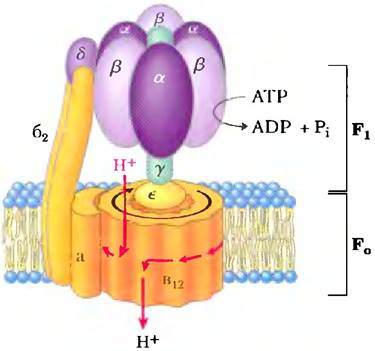
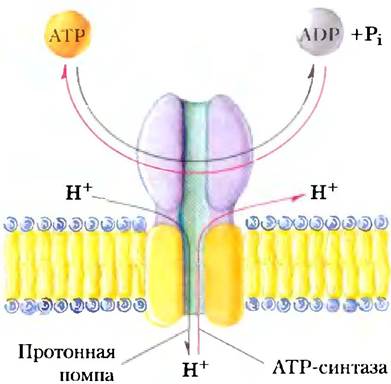
АТРазные активные транспортеры F-типа катализируют трансмембранный перенос протонов против градиента, приводимый в действие гидролизом АТР. Название «F-тип» происходит из определения этих АТРаз как энергосопрягающих факторов (англ. factors). Интегральный мембранный белковый комплекс F0 (рис. 11-39; нижний индекс «0» — от названия его ингибитора олигомицина) образует трансмембранную пору для протонов, а периферический белок F1 (индекс 1 показывает, что он был первым из нескольких факторов, выделенных из митохондрий) является молекулярной машиной, которая использует энергию АТР для перемещения протонов против градиента (в область с более высокой концентрацией Н+). Система F0F1 качающих протоны транспортеров развилась, по-видимому, на очень раннем этапе эволюции. Бактерии, такие как Е. coli, используют АТРазный комплекс F0F1 в плазматической мембране для того, чтобы выкачивать протоны наружу, а археи имеют гомологичный протонный насос — АТРазу А0А1.
Рис. 11-39. Структура F0F1-АТРазы/АТР-синтазы. АТРазы F-типа содержат периферический домен F1; состоящий из трех α-субъединиц, трех β-субъединиц, одной δ-субъединицы (фиолетовый цвет) и центрального стержня (y-субъединица, зеленый цвет). Интегральная часть АТРаз F-типа F0 (оранжевый) имеет множественные копии с-субъединицы, одну а- и две b-субъединицы. F0 образует трансмембранный канал, через который перекачивается в среднем четыре протона (красные стрелки) на каждую молекулу АТР, гидролизованную на β-субъединицах F1. Удивительный механизм, посредством которого эти два события сопрягаются детально описан в гл. 19. Он включает вращение F0 относительно F1 (черная стрелка). Структуры V0V1 и A0A1 практически идентичны структуре F0F1. Сходным является, вероятно, и механизм их действия.
Реакция, катализируемая АТРазами F-типа, обратима; протонный градиент может поставлять энергию для того, чтобы запустить обратную реакцию-синтез АТР (рис. 11-40). АТРазы F-типа, работающие в этом направлении, более принято называть АТР-синтазами. ATP-синтазы играют главную роль при образовании АТР в митохондриях в процессе окислительного фосфорилирования и в хлоропластах при фотофосфорилировании, а также у эубактерий и архей. Градиент протонов, нужный для запуска синтеза АТР, образуется в результате деятельности других протонных насосов, которые снабжаются энергией окисления субстрата или солнечного света. Мы вернемся к детальному описанию этих процессов в гл. 19.
Рис. 11-40. Обратимость АТРаз F-типа. АТР-зависимый протонный транспортер может также катализировать синтез АТР (красные стрелки), когда протоны движутся по электрохимическому градиенту. Это центральная реакция в процессах окислительного фосфорилирования и фотофосфорилирования (оба подробно описаны в гл. 19).
АТР-азы V-типа (V от англ. vacuolar — вакуолярный), составляющие класс протон- транспортирующих АТРаз, структурно (и, возможно, по механизму действия) сходные с АТРазами F-типа, ответственны за закисление внутриклеточных компартментов во многих организмах. Протонные насосы этого типа поддерживают в вакуолях грибов и высших растений pH между 3 и 6, т. е. гораздо ниже, чем pH окружающего цитозоля (pH 7,5). АТРазы V-типа обеспечивают также закисление лизосом, эндосом, комплекса Гольджи и секреторных везикул в животных клетках. Все АТР-азы V-типа имеют сходную структуру комплекса: интегральный (трансмембранный) домен V0, который служит протонным каналом, и периферический домен V1, который содержит ATP-связывающий сайт и обладает АТРазной активностью. Механизм, посредством которого АТРазы V-типа сопрягают гидролиз АТР с переносом протонов против градиента, детально не изучен.
ABC-транспортеры используют АТР для запуска активного транспорта множества субстратов
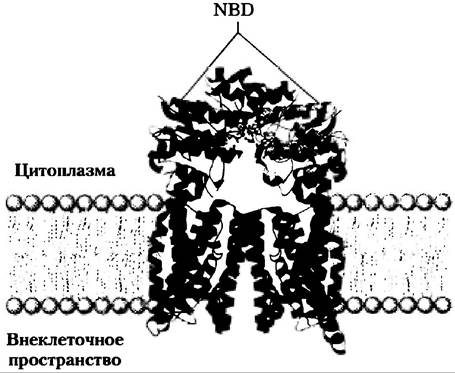
АВС-транспортеры (рис. 11-41) образуют большое семейство ATP-зависимых переносчиков, выкачивающих аминокислоты, пептиды, белки, ионы металлов, различные липиды, желчные соли и многие гидрофобные соединения, в том числе лекарства, из клетки против градиента концентрации. Один из АВС-транспортеров у человека мультилекарственный транспортер (MDRN1) отвечает за поразительную устойчивость определенных опухолей к действию противоопухолевых препаратов, в других случах эффективных. MDRN1 обладает широкой субстратной специфичностью к гидрофобным соединениям, включая, например, химиотерапевтические средства адриамицин, доксорубицин и винбла- стин. Выкачивая эти лекарства из клетки, транспортер препятствует их накоплению в опухоли и таким образом блокирует терапевтические эффекты. MDRN1 — интегральный мембранный белок (Мr ~ 170 000) с 12 трансмембранными сегментами и двумя ATP-связывающими доменами («кассетами»), которые и дают название данному семейству: ATP-связывающие кассетные транспортеры (от англ. АТР-binding cassettes transporters). ■
Все ABC-транспортеры содержат два нуклеотидсвязывающих домена (NBD) и два трансмембранных домена (рис. 11-41). В некоторых случаях все эти домены представляют собой один длинный полипептид; другие АВС-транспортеры состоят их двух субъединиц, причем каждая содержит NBD и домен с шестью (или иногда десятью) трансмембранными спиралями. Хотя многие из ABC-транспортеров находятся в плазматической мембране, некоторые обнаружены также в эндоплазматическом ретикулуме и в мембранах митохондрий и лизосом. Большинство ABC-транспортеров работают как насосы, но по крайней мере некоторые члены этого супер- семейства функционируют как ионные каналы, которые открываются и закрываются при гидролизе АТР. CFTR-транспортер (доп. 11-3) является С1 -каналом, который приводится в действие гидролизом АТР.
Рис. 11-41. ABC-транспортер E. coli. Импортер витамина В12 BtuCD (PDP ID 1L7V) — гомодимер с 10 спиральными трансмембранными доменами (голубой цвет). Два нуклеотидсвязывающих домена (NBD; красные) экспонированы в цитоплазму. Остатки, участвующие в связывании и гидролизе АТР, показаны в виде шаростержневых моделей.
МЕДИЦИНА. Дефект ионных каналов при кистозном фиброзе
Кистозный фиброз (КФ) — серьезное и довольно распространенное наследственное заболевание человека. Около 5% белых американцев являются его носителями, они имеют одну дефектную и одну нормальную копии соответствующего гена. Только у людей с двумя дефектными копиями проявляются выраженные симптомы болезни: закупорка желудочно-кишечного тракта и дыхательных путей, обычно приводящая к бактериальной инфекции и смерти из-за дыхательной недостаточности в возрасте до 30 лет. При КФ топкий слой слизи, который в норме покрывает внутреннюю поверхность легких, становится ненормально толстым, преграждая путь потоку воздуха и давая приют патогенным бактериям, особенно Staphylococcus aureus и Pseudomonas aeruginosa.
Дефектный ген у пациентов с КФ был открыт в 1989 г. Он кодирует мембранный белок, называемый мембранным регулятором проводимости (CFTR от англ, cystic fibrosistransmembrane conductance regulator). В зтом белке два сегмента, каждый содержит шесть трансмембранных спиралей, два нуклеотидсвязывающих домена (NBD) и регуляторный участок (рис. 1). Таким образом, CFTR очень близок по строению к АВС-транспортерам. В норме CFTR работает как канал, специфичный к ионам CI. Канал проводит ионы хлора через плазматическую мембрану, когда оба NBD связваны с АТР, а когда АТР на одном из NBD разлагается на ADP и Pj, он закрывается. Хлорный канал регулируется фосфорилированием нескольких остатков Ser в регуляторном домене и катализируется сАМР-зависимой протеинкиназой (гл. 12). Когда регуляторный домен не фосфорилирован, Сl--канал закрыт. Мутация CFTR, приводящая к развитию КФ, в 70% случаев — это деления остатка Phe в положении 508. Результатом является неправильная укладка мутантного белка и, следовательно, при включении его в плазматическую мембрану, — уменьшение проведения Сl через мембраны клеток эпителия, выстилающего дыхательные пути (рис. 2), пищеварительный тракт и железы внешней секреции (поджелудочная железа, потовые железы, желчные протоки и семявыносящие протоки).
Рис. 1. Три состояния мембранного регулятора проводимости CFTR. Белок состоит из двух участков, каждый из которых имеет по шесть трансмембранных спиралей; кроме того, на цитоплазматической поверхности мембраны находятся три функционально значимых домена: NBD1 и NBD2 (зеленые), которые представляют собой нуклеотидсвязывающие домены, присоединяющие АТР, а регуляторный домен (синий) является участком фосфорилирования под действием сАМР-зависимой протеинкиназы. Когда этот R-домен фосфорилирован, но в доменах NBD не произошло связывания АТР (слева), канал закрыт. Связывание АТР открывает канал (в центре), который находится в таком состоянии, пока не произойдет гидролиз АТР. Если регуляторный домен не фосфорилирован (справа), он связывается с доменами NBD и предотвращает связывание АТР и открытие канала. Наиболее распространенной мутацией, приводящей к развитию кистозного фиброза, является делеция остатка Phe508 в домене NBD: (слева). CFTR — типичный ABC-транспортер, но имеет две особенности: во-первых, в большинстве ABC-транспортеров отсутствует регуляторный домен, во-вторых, CFTR выступает в роли ионного канала (для ионов Сl-), что, нетипично для переносчика.
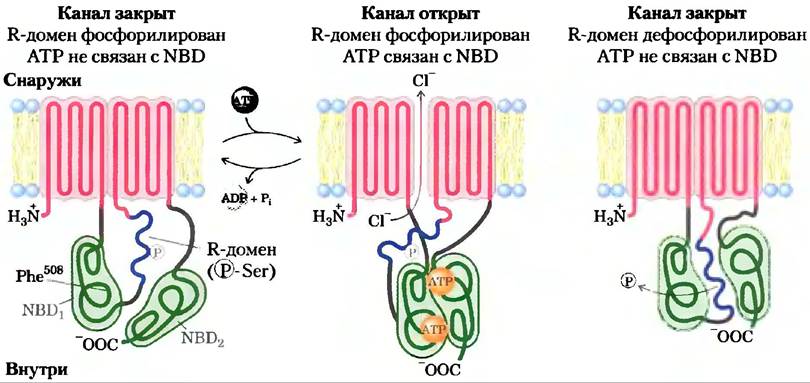
Рис. 2. Слизь, выстилающая легкие, улавливает бактерии. В здоровых легких эти бактерии уничтожаются и выбрасываются с помощью ресничек. При КФ бактерицидная активность нарушается, что приводит к повторным инфекциям и прогрессирующему поражению легких.
Ослаблению экспорта Сl сопутствует уменьшение выделения воды из клеток, приводящее к тому, что слизь на их поверхности высыхает, утолщается и становится чрезмерно липкой. В норме реснички на эпителиальных клетках, которые выстилают внутреннюю поверхность легких, непрерывно выбрасывают прочь бактерий, которые оседают на слизи, но утолщенная слизь эпителиальных клетках у людей, больных КФ, препятствует этому процессу. Постоянное действие таких бактерий, как S. aureus и Р. aeruginosa, все сильней и сильней повреждает легкие и уменьшает эффективность дыхания. Распространенной причиной смерти людей, страдающих КФ, являются респираторные заболевания.
Нуклеотидсвязывающие домены всех АВС- белков имеют похожие аминокислотные последовательности и, по-видимому, сходную трехмерную структуру; они представляют собой консервативный молекулярный мотор, который может сопрягаться с множеством насосов и каналов. При сопряжении с насосом АТР-зависимый мотор перемещает вещества против градиента концентрации; при сопряжении с ионным каналом мотор открывает и закрывает канал, используя АТР как источник энергии. Стехиометрия АВС-насосов такова: примерно одна молекула АТР гидролизуется при переносе одной молекулы субстрата, но ни механизм сопряжения, ни участок связывания субстрата неизвестны.
Некоторые АВС-транспортеры обладают очень высокой специфичностью к одному субстрату; другие менее «разборчивы». Геном человека содержит по крайне мере 48 генов, кодирующих АВС-транспортеры, многие из них участвуют в поддержании состава и состояния липидного бислоя, а также в транспорте стеринов, их производных и жирных кислот в организме. Флиппазы, которые переносят мембранные липиды в бислое с одного монослоя на другой, тоже АВС-транспортеры; ABC-транспортер в своем составе содержит и клеточный аппарат для экспорта избытка холестерина. Мутации в генах, которые кодируют некоторые из этих процессов, обусловливают генетические заболевания, в том числе кистозный фиброз (доп. 11-3), танжерскую болезнь (доп. 21-3), дегенерацию сетчатки, анемию и печеночную недостаточность.
АВС-транспортеры есть и у более простых животных, и у растений, и у микроорганизмов. Дрожжи несут 31 ген, кодирующий АВС- транспортеры, у мушки р. Drosophila их 56, у бактерии Е. coli — 80 (2% всего генома). Присутствие ABC-транспортеров, которое придает патогенным микробам устойчивость к антибиотикам (Pseudomonas aeruginosa, Staphylococcus aureus, Candida albicans, Neisseria gonorrhoeae, Plasmodium falciparum), имеет самое серьезное отношение к проблемам здоровья человека и делает эти транспортеры привлекательной мишенью для создания лекарств. ■
Таблица 11-4. Котранспортные системы, приводимые в действие градиентами Na+ и H+
Opганизм/ткань/тип клеток |
Переносимое вещество ( движется против градиента) |
Котранспортируемое вещество ( движется по градиенту) |
Тип транспорта |
Е. coli |
Лактоза Пролин Дикарбоновые кислоты |
Н+ Н+ Н+ |
Симпорт Симпорт Симпорт |
Кишечник, почки (позвоночных) |
Глюкоза Аминокислоты |
Na+ Nа+ |
Симпорт Симпорт |
Клетки позвоночных (многих типов) |
Са2+ |
Na+ |
Антипорт |
Высшие растения |
К+ |
Н+ |
Антипорт |
Грибы (р. Neurospora) |
К+ |
Н+ |
Антипорт |
Ионные градиенты снабжают энергией вторичный активный транспорт
Ионные градиенты, образующиеся при первичном транспорте Nа+ или Н+, могут в свою очередь обеспечивать движущую силу для котранспорта других веществ. Многие тины клеток содержат транспортные системы, которые сопрягают спонтанный поток ионов по градиенту с одновременным закачиванием против градиента другого иона, сахара или аминокислоты (табл. 11-4).
Переносчик лактозы (лактозопермеаза)
Е. coli — хорошо изученный прототип переносящих протоны транспортеров. Этот белок состоит из одной полипептидной цепи (417 остатков), которая функционирует в виде мономера, осуществляя перенос одного протона и одной молекулы лактозы в клетку и обеспечивая накопление лактозы (рис. 11-42). У Е. coli градиент протонов и заряда на плазматической мембране образуется, как правило, при окислении пищи, энергия окисления используется для выкачивания протонов наружу. (Этот механизм подробно обсуждается в гл. 19.) Липидный бислой непроницаем для протонов, но переносчик лактозы обеспечивает дорогу для возвращения протона, а лактоза одновременно переносится внутрь клетки (симпорт). Эндергоническое накопление лактозы сопряжено, таким образом, с экзергоническим входом протонов в клетку, и для суммарного процесса ∆G <0.
Рис. 11-42. Поглощение лактозы у Е. coli, а) Первичный транспорт Н+ из клетки, приводимый в действие посредством окисления разнообразного топлива, создает и протонный градиент, и электрический потенциал на мембране (отрицательный внутри). Вторичный активный транспорт лактозы в клетку включает симпорт Н+ и лактозы транспортером. Поглощение лактозы против градиента ее концентрации полностью зависит от этого тока Н+ внутрь, движимого электрохимическим градиентом, б) Когда поставляющие энергию окислительные реакции метаболизма блокируются цианид-ионом (CN-), транспортер лактозы устанавливает равновесие лактозы внутри и вне клетки путем пассивного транспорта. Мутации, которые влияют на Glu325 или Arg302, оказывают такое же действие, как цианид-ион. Пунктирная линия показывает концентрацию лактозы в окружающей среде.
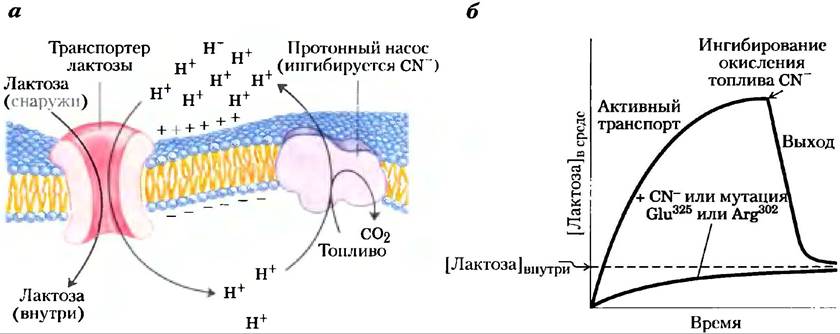
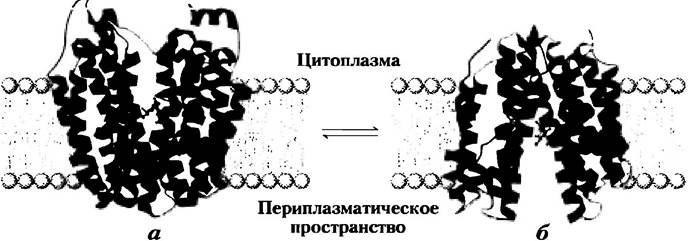
Транспортер лактозы — один из представителей главного суперсемейства облегчающих транспорт факторов (MFS — от англ. major facilitator superfamily), которое охватывает 28 семейств. Почти все белки в этом суперсемействе содержат по 12 трансмембранных доменов (за исключением нескольких, имеющих 14). Белки обладают сравнительно небольшой гомологией последовательностей, но сходство их вторичной структуры и топологии свидетельствует об одинаковой третичной структуре. Кристаллографический анализ транспортера лактозы Е. coli, проведенный Роном Кэбаком и Соу Иватой в 2003 г., позволяет получить представление об этой структуре (рис. 11-43, а). Этот белок содержит 12 трансмембранных спиралей и связывающие петли, которые «высовываются» в цитоплазму или перинлазматическое пространство. Все шесть N-концевых и шесть С-концевых спиралей образуют очень похожие домены, давая структуру с нестрогой двусторонней симметрией. В кристаллическом белке большая водная полость экспонирована с цитоплазмагической стороны мембраны. Субстратсвязывающий сайт находится в этой полости примерно в средней части мембраны. Сторона транспортера, обращенная наружу (периплазматическая сторона), накрепко закрыта, так что нет достаточно большого канала для входа лактозы. Предполагаемый механизм трансмембранного переноса субстрата (рис. 11-43, 6) включает колебательное движение между двумя доменами, осуществляемое связыванием субстрата и движением протона, при этом субстратсвязывающий сайт попеременно экспонируется в цитоплазму и периплазму. Эта модель, называемая моделью качающегося банана, сходна с моделью для GLUT1 (рис. 11-31).
Рис. 11-43. Транспортер лактозы (лактозопермеаза) Е. coli, а) Представление белка в виде ленточек, рассматриваемых параллельно плоскости мембраны, позволяет увидеть 12 трансмембранных спиралей, расположенных в двух почти симметричных доменах (окрашены в синий цвет разной интенсивности). С этой формой белка, для которой определена кристаллическая структура, сахар-субстрат (красный цвет) связывается близко к середине мембраны, где он экспонируется в направлении цитоплазмы (источник PDB ID 1PV7). б) Предположительная вторичная структура транспортера восстановлена из первичной по большим обратимым изменениям конформации, при которых два домена отклоняются друг от друга, экспонируя субстратсвязывающий сайт сначала в периплазму (структура справа), когда лактоза «подхватывается», затем в цитоплазму (слева), когда лактоза высвобождается. Взаимопревращение двух форм приводится в действие изменениями в спаривании (зависящем от трансмембранного протонного градиента) заряженных (способных протонироваться) боковых цепей, таких как цепи в Glu325 и Arg302(зеленый цвет).
Как движение протона в клетку сопряжено с поглощением лактозы? В результате обширных генетических исследований транспортера лактозы установлено, что из 417 аминокислотных остатков в белке только шести совершенно необходимы для котранспорта Н+ и лактозы — одни для связывания лактозы, другие для транспорта прото-
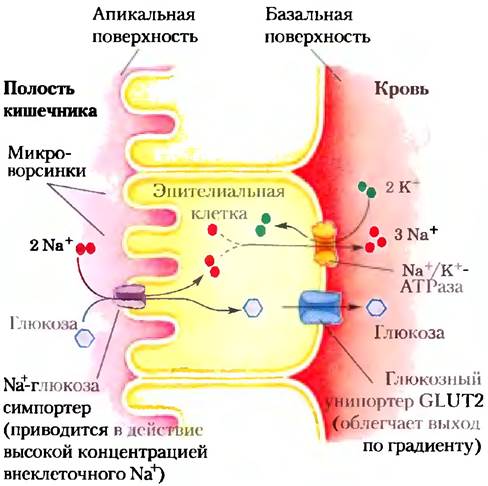
нов. Мутация в одном из двух остатков (Glu325 и Arg302; рис. 11-43) приводит к тому, что белок еще способен катализировать облегченную диффузию лактозы, но не способен сопрягать поток Н+ с переносом лактозы против ее градиента. Сходный эффект наблюдается для клеток дикого типа (без мутаций), когда их способность генерировать протонный градиент блокируется CN--ионами: переносчик выполняет облегченную диффузию нормально, но не может перекачивать лактозу против градиента концентрации (рис. 11-42, б). На баланс между двумя конформациями транспортера лактозы влияют изменения в образовании пар зарядов между боковыми цепями. В эпителиальных клетках кишечника глюкоза и некоторые аминокислоты накапливаются посредством симпорта с движением Na+по градиенту, созданному Na+/K+- АТРазой плазматической мембраны (рис. 11-44). Апикальная поверхность клетки кишечного эпителия покрыта микроворсинками — длинными тонкими выростами плазматической мембраны, которые многократно увеличивают площадь поверхности, экспонированную в сторону содержимого кишечника.
2Nа+снаружи + глюкозаснаружи —> 2Nа+внутри + глюкозавнутри
Рис. 11-44. Транспорт глюкозы в клетках кишечного эпителия. Молекула глюкозы котранспортируется с через апикальную плазматическую мембрану в эпителиальную клетку. Она движется через клетку к базальной поверхности, где переходит в кровь с помощью GLUТ2 — пассивного переносчика глюкозы. Nа+/K+-АТРаза продолжает выкачивать Na+наружу для поддержания градиента, который обеспечивает поглощение глюкозы. Nа+-глюкозные сим- портеры в апикальной плазматической мембране захватывают глюкозу из кишечника с помощью процесса, приводимого в действие «нисходящим» потоком Na+ по градиенту.
Энергия, необходимая для этого процесса, получается из двух источников: более высокая концентрация Nа+ снаружи, чем внутри (химический потенциал), и трансмембранный потенциал, который отрицателен на внутренней стороне мембраны, и поэтому Nа+ засасывается внутрь.
Пример 11-3 Энергетические затраты при симпорте
Рассчитайте максимальное отношение
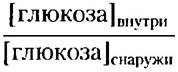
которое может достигаться с помощью Nа'- глюкозных симпортеров в плазматической мембране эпителиальной клетки, если [Nа+] внутри = 12 мМ, [Nа+]снаружи = 145 мМ, мембранный потенциал = -50 мВ (отрицательное значение внутри клетки), а температура составляет 37 °С.
Решение. Используя уравнение 11-4 (с. 559), можно рассчитать энергию электрохимического градиента ионов Nа+, т. е. определить энергетические затраты на перемещение одного иона Na+ против этого градиента:
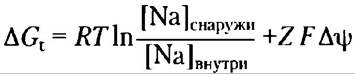
Подставим численные значения R, T и F, заданное значение для [Na+] (в молях), Z= +1 (поскольку ион Nа+ имеет один положительный заряд) и Аrр = 0,050 В. Обратите внимание, что мембранный потенциал равен 50 мВ (отрицательное значение внутри клетки), так что изменение потенциала при переносе иона из клетки наружу составляет 50 мВ.

Это значение ∆Gt представляет собой изменение потенциальной энергии, происходящее при переносе одного моля ионов Nа+, и эта энергия может использоваться для переноса глюкозы. Учитывая, что при переносе одной молекулы глюкозы при симпорте происходит перенос двух ионов Na+ по электрохимическому градиенту в клетку, получаем, что запас энергии для переноса 1 моль глюкозы составляет 2 • 11,2 кДж/моль = 22,4 кДж/моль. Теперь можно найти концентрацию глюкозы, которую можно получить с помощью такого насоса. Используем уравнение 11-3 (с. 559):
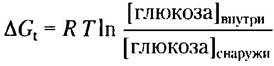
Подставляем значения для ∆Gt, R и Т и получаем

Таким образом, с помощью котранспортного механизма глюкоза может проникать в эпителиальную клетку до тех пор, пока ее внутриклеточная концентрация не превысит ее внеклеточную концентрацию (в кишечнике) почти в 6000 раз.
По мере того как глюкоза переносится из кишечника в эпителиальную клетку на апикальной поверхности, она одновременно переносится из клетки в кровь посредством пассивного транспорта с помощью глюкозного транспортера GLUТ2 на базальной поверхности (рис. 11-44). Решающая роль Nа+ в подобных системах симпорта и антипорта требует непрерывного выкачивания Nа+ из клетки для поддержания трансмембранного градиента Na+.
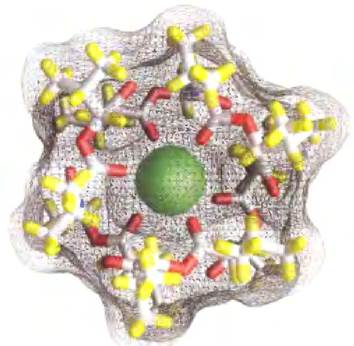
Ввиду важности ионных градиентов для активного транспорта и сохранения энергии, соединения, разрушающие ионные градиенты на клеточных мембранах, оказываются эффективными ядами, причем те из них, которые специфичны для инфекционных микроорганизмов, могут служить антибиотиками. Так, валиномицин, циклический пептид с гидрофобными свойствами, нейтрализует заряд К+, окружая этот ион шестью атомами кислорода карбоксильных групп (рис. 11-45), и работает как челнок, перенося К+ через мембрану по градиенту концентрации, уменьшая этот градиент. Соединения, которые переносят ионы через мембрану, действуя по типу челнока, называются ионофорами(«несущие ионы»). И валиномицин, и монензин (ионофор, переносящий Nа+) — антибиотики. Они убивают клетки микробов, обрывая процессы вторичного транспорта и энергозапасающие реакции. Монензин находит широкое применение в качестве противогрибкового и противопаразитарного средства. ■
Рис. 11-45. Валиномицин — K+ связывающий пептидный ионофор. Контуры поверхности показаны как прозрачная сетка, через которую видны палочкообразные структуры пептида и ион К+ (зеленый). Атомы кислорода (красный цвет), которые связывают К+, включены в центральную гидрофильную полость. Гидрофобные боковые аминокислотные цепи (желтый цвет) покрывают внешнюю сторону молекулы. Поскольку наружная сторона К+-валиномицинового комплекса гидрофобна, этот комплекс легко диффундирует через мембраны, перенося К+ по градиенту концентрации. Происходящая в результате потеря трансмембранного ионного градиента убивает микробные клетки, что делает валиномицин мощным антибиотиком.
Аквапорины образуют гидрофильные трансмембранные каналы для переноса воды
К семейству интегральных белков относятся аквапорины (АQР), которые были открыты Питером Эгром. Аквапорины образуют каналы для быстрого движения молекул воды через плазматическую мембрану (в табл. 11-5 приведено несколько примеров). У млекопитающих обнаружено 11 аквапоринов, причем каждый из них имеет специфическую локализацию и выполняет особую роль (табл. 11-5). Эритроциты, которые при поступлении крови через мозговой слой почек быстро набухают или сжимаются в ответ на резкие изменения в осмоляльности окружающей клетку среды, имеют высокое содержание аквапоринов в плазматической мембране (2 • 105 молекул АQР-1 на клетку). Секреция воды экзокринными железами, в которых образуются пот, слюна и слезы, происходит при участии аквапоринов. В образовании мочи и удерживании воды в нефронах (функциональных единицах почек) участвуют семь разных аквапоринов. Каждый почечный аквапорин локализован в нефроне специфическим образом, каждый имеет особые свойства и ретуляторные особенности. Например, АQР-2 в эпителиальных клетках почечного канальца регулируется вазопрессином (другое название — антидиуретический гормон): чем больше концентрация вазопрессина, тем больше воды реабсорбируется в почках. У мутантных мышей, не имеющих гена АQР-1, образуется очень много мочи (полиурия), а способность концентрировать мочу снижается, что является результатом снижения проницаемости для воды проксимальных канальцев. Известно, что генетические дефекты аквапоринов у человека являются причиной различных заболеваний, включая сравнительно редкую форму диабета, сопровождающегося полиурией (доп. 11-2).

Таблица 11-5. Параметры проницаемости и преобладающая локализация известных аквапоринов млекопитающих
Аквапорин |
Пропускаемое вещество (проницаемость) |
Локализация в тканях |
Локализация внутри клетки* |
АQP-0 |
Вода(низкая) |
Хрусталик |
Плазматическая мембрана |
АQР-1 |
Вода (высокая) |
Эритроциты, почки, легкие, эндотелий сосудов, мозг, глаза |
Плазматическая мембрана |
АЙР- 2 |
Вода (высоки») |
Почки, семявыносящие протоки |
Апикальная плазматическая мембрана, внутри клеточные везикулы |
АQP-3 |
Вота (высокая), глицерин (высокая), мочевина (изменяемая) |
Почки, кожа, легкие, глаза, толстая кишка |
Базолатеральная плазматическая мембрана |
АQP-4 |
Вода (высокая) |
Мозг, мышцы, почки легкие, желудок, тонкая кишка |
Базолатеральная плазматическая мембрана |
АQР-5 |
Вода (высокая) |
Слюнные железы, слезные железы, потовые железы, легкие, роговица глаз |
Апикальная плазматическая мембрана |
АQР 6 |
Вода(низкая), анионы (NО3- >Сl-) |
Почки |
Внутриклеточные везикулы |
АQР-7 |
Воlа (высокая), глицерин (высокая), мочевина (высокая), арсенит-ион |
Жировая ткань, почки, семенники |
Плазматическая мембрана |
АQР-8** |
Вода (высокая) |
Семенники, ночки, печень, поджелудочная железа, тонкая и толстая кишки |
Плазматическая мембрана, внутри клеточные везикулы |
АQР-9 |
Вода (низкая), глицерин (высокая), мочевина (высокая) арсенит-ион |
Толстая кишка, лейкоциты, мозг, семенники |
Плазматическая мембрана |
АQР-10 |
Вода (низкая), глицерин (высокая), мочевина (высокая) |
Тонкая кишка |
Внутриклеточные везикулы |
* Для аквапоринов, которые постоянно присутствуют в апикальной или базолатеральной мембранах, отмечена локализация в одной из этих мембран; для содержащихся в обеих мембранах указана локализация в плазматической мембране.
** АQР-8 может, кроме того, пропускать мочевину.
Аквапорины обнаружены у всех живых организмов. У растения Аrabidopsis thaliana 38 генов, которые кодируют различные типы аквапоринов, что отражает решающую роль движения воды в физиологии растений. Изменения в тургорном давлении, например, требуют быстрого передвижения воды через мембрану (см. с. 85).
Молекулы воды протекают через канал AQP-1 со скоростью ~ 109 с-1. Для сравнения — самое высокое число оборотов известно для фермента каталазы, и оно составляет 4 • 107 с-1, а у многих ферментов число оборотов — от 1 до 104 с-1 (табл. 6-7). Низкая энергия активации для перехода воды через аквапориновые каналы (∆G* <15 кДж/моль) наводит на мысль, что вода движется через каналы непрерывным потоком по осмотическому градиенту (об осмосе см. с. 85). Существенно, что аквапорины не допускают перемещения протонов (ионов гидроксония H3O+), которое лишило бы мембрану электрохимических потенциалов. И они не перемещаются. Откуда у аквапоринов такая исключительная селективность?
Ответ мы находим в структуре AQP-1, которая была установлена методом рентгеноструктурного анализа. Молекула AQP-1 (рис. 11-46, а) состоит из четырех идентичных мономеров (для каждого Мr = 28 000), каждый мономер образует трансмембранную пору с таким диаметром, чтобы пропускать молекулы воды «колонной по одному». Каждый мономер состоит из шести спиральных трансмембранных сегментов и двух более коротких спиралей, причем обе содержат последовательность Asn-Pro-Ala (NPA). Шесть трансмембранных спиралей образуют пору по длине мономера, а две короткие петли, содержащие последовательность NPA, простираются по направлению к середине бислоя с разных сторон, образуя «фильтр специфичности» — структуру, которая позволяет проходить только молекулам воды (рис. 11 -46, б).
Рис. 11-46. Аквапорин. Этот белок — тетрамер, состоящий из четырех идентичных мономеров, каждый из которых образует трансмембранную пору, а) Мономер аквапорина шпината SoPIP2; 1 (источник PBD ID 2B5F), вид из плоскости мембраны. Спирали образуют центральную пору, а два коротких спиральных сегмента (зеленые) взаимодействуют с последовательностями Asn-Pro-Ala (NPA), которые формируют часть водного канала и обнаружены во всех аквапоринах. б) На схеме аквапорина 1 быка (источник PBD ID 1J4N) видно, что пора (коричневая; заполнена молекулами воды, которые показаны красно-белыми шариками) сужается у остатка His180 до диаметра 2,8 А (примерно равен размеру молекулы воды), препятствуя прохождению молекул крупнее воды. Положительный заряд на Arg195предотвращает проникновение через пору катионов, в частности Н3O+. Две короткие спирали (показаны зеленым) обращены положительным концом своего диполя к поре, что помогает переориентировать молекулы воды по мере прохождения по каналу; это разрушает цепочки из молекул воды, связанных водородными связями, предотвращая перенос протона путем «протонных прыжков» (см. рис. 2-13).
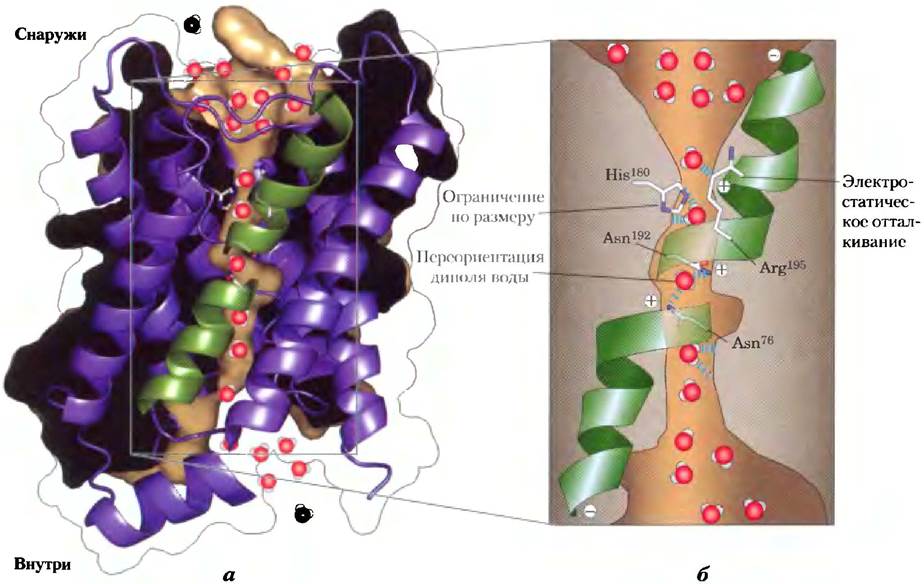
В центре мембраны водный канал сужается до диаметра 2,8 А, что строго ограничивает диаметр молекул, способных проникать через канал. Положительный заряд консервативного остатка Arg в этом узком месте предотвращает проникновение катионов, в частности Н3O+. Остатки, которые выстилают канал, каждого мономера AQP-1, обычно неполярны. Но карбонильные атомы кислорода в остове пептида, выступая то там, то здесь в узкую часть канала, могут образовывать водородные связи с отдельными молекулами проходящей воды; два остатка Asn (Asn76и Asn192) в петлях NPA также связываются с водой водородными связями. Эта структура не включает в себя ближние молекулы воды, которые мог ли бы образовать цепь, делающую возможным эффективный перескок протонов (см. рис. 2-13) через мембрану. Остатки Arg и His, а также электрические диполи, образованные короткими спиралями NPA-петель, обеспечивают наличие положительных зарядов, которые отталкивают все протоны, нс давая им проникнуть через поры, и, кроме того, предотвращают образование водородных связей между соседними молекулами воды.
Аквапорин, выделенный из шпината, является управляемым каналом и находится в открытом состоянии, когда два остатка Ser вблизи внутриклеточного конца канала фосфорилированы, и в закрытом состоянии, когда они дефосфорилированы. Этот белок был изучен в обоих состояниях при помощи РСА. Фосфорилирование способствует образованию конформации, в которой два соседних остатка Leu и остаток His оказываются вдавленными внутрь канала, что блокирует продвижение воды дальше этого места и эффективно перекрывает канал. Действие других аквапоринов регулируется по-другому, но в результате всегда достигается быстрое изменение проницаемости мембраны для молекул воды.
Обычно аквапорины пропускают только воду, однако некоторые из них с высокой скоростью пропускают глицерин и мочевину (табл. 11-5). Считается, что эти аквапорины играют важную роль в метаболизме глицерина. Например, AQP-7, обнаруженный в плазматической мембране адипоцитов (жировых клеток), эффективно транспортирует глицерин. У мышей с дефектом AQP-7 развивается ожирение, а во взрослом состоянии — диабет, по-видимому, вследствие невозможности переносить глицерин в адипоциты или из них при превращении триацилглицеридов в жирные кислоты и глицерин, и наоборот.
Ион-селективные каналы делают возможным быстрое перемещение ионов через мембраны
Ион-селективные каналы,впервые обнаруженные в нейронах и присутствующие, как теперь известно, в плазматических мембранах всех клеток, а также во внутриклеточных мембранах эукариот, имеют другой механизм переноса неорганических ионов через мембраны. Ионные каналы вместе с ионными насосами, такими как Na+/K+-ATPaзa, определяют проницаемость плазматической мембраны в отношении специфических ионов и регулируют концентрацию ионон в цитозоле и мембранный потенциал. В нейронах очень быстрые изменения в ионных каналах вызывают изменения мембранного потенциала (потенциала действия), которые передают сигналы с одного конца нейрона на другой. В миоцитах быстрое открытие Са2+-каналов в саркоплазматическом ретикулуме высвобождает ионы Са2+, которые запускают сокращение мышцы. Мы обсудим сигнальную роль ионных каналов в гл. 12. Здесь опишем структурную основу функционирования ионного канала, используя в качестве примеров бактериальный К+-канал, Na+-канал нейронов и ионный канал ацетилхолинового рецептора.
Ионные каналы отличаются от ионных транспортеров по крайней мере тремя свойствами. Во- первых, скорость переноса через каналы может быть на несколько порядков больше, чем число оборотов для транспортера, — от 107 до 108 ионов/с для ионного канала, что составляет почти теоретический максимум для неограниченной диффузии. Во-вторых, ионные каналы не являются насыщаемыми: скорость транспорта не достигает максимума при высокой концентрации субстрата. В-третьих, они являются управляемыми — открываются или закрываются в ответ на некоторые события в клетке. В лигандзависимых каналах (которые обычно представлены олигомерами) связывание внеклеточной или внутриклеточной малой молекулы вызывает аллостерический переход в белке, который открывает или закрывает канал. В потенциалзависимых ионных каналах изменение трансмембранного электрического потенциала (Vm) вызывает смещение заряженного домена белка относительно мембраны, при этом ионный канал открывается или закрывается. Оба типа регуляции могут быть очень быстрыми. Обычно канал открывается за доли миллисекунды и может оставаться открытым только в течение миллисекунд, делая это молекулярное устройство эффективным для очень быстрой передачи сигнала в нервной системе.
Работа ионного канала измеряется и характеризуется с помощью электрических параметров
Поскольку единичный ионный канал обычно остается открытым только в течение миллисекунд, для большинства биохимических экспериментов наблюдение за этим процессом выходит за границы возможного. Поэтому ионные потоки должны измеряться либо как изменения потенциалов Vm (в милливольтовой области), либо как электрические токи I (в области микроампер или пикоампер) с применением микрозлектродов и соответствующих усилителей. В методе пэтч-кламп, разработанном Эрвином Неером и Бертом Закманом в 1976 г., измеряются очень малые токи через крошечную область мембранной поверхности, содержащую всего только одну или несколько молекул ионных каналов (рис. 11-47). Исследователь может измерить величину и продолжительность тока, который идет во время одного открытия ионного канала, и определить частоту открывания канала и влияние на эту частоту трансмембранного потенциала, регуляторных лигандов, токсинов и других агентов. Исследования методом пэтч-кламп показали, что 104 ионов могут передвигаться через единичный ионный канал за 1 мс. Такой ионный ток обусловлен гигантским усилением первоначального сигнала; например, для открытия канала ацетилхолинового рецептора нужны только две молекулы ацетилхолина (см. ниже).
Рис. 11-47. Электрические измерения функции ионного канала. «Активность» ионного канала оценивается путем измерения тока ионов через него с использованием методики пэтч-кламп. Тонко оттянутой пипеткой (микропипеткой) надавливают на клеточную поверхность, и отрицательное давление в пипетке создает герметичное соединение между пипеткой и мембраной. Когда пипетка вытягивается из клетки, она вытягивает крошечный кусочек мембраны (который может содержать один или несколько каналов). После помещения пипетки и находящегося на ее кончике кусочка (пэтча) в водный раствор можно измерить активность канала по электрическому току между содержимым пипетки и водным раствором. Практически таким же образом создается электрический контур, в контуре поддерживается определенный трансмембранный потенциал, а измеряют ток, который должен поддерживать это напряжение. С помощью высокочувствительных детекторов можно измерять ток, протекающий через единичный ионный канал и составляющий обычно несколько пикоампер. При регистрации тока как функции времени (в миллисекундах) можно определить, насколько быстро канал открывается и закрывается, как часто он открывается и как долго остается открытым. Исследование, проведенное при разных Vm, позволяет оценить влияние изменения мембранного потенциала на эти параметры работы канала.
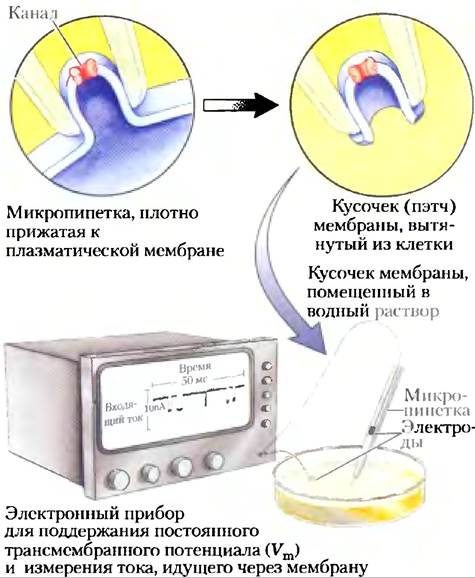

Структура К+-канала связана с его специфичностью
Структура калиевого канала бактерии Streptomyces lividans была расшифрована Родериком Маккинноном в 1998 г. по результатам кристаллографических исследований. Благодаря этому удалось понять, каким образом канал работает. Этот бактериальный ионный канал по аминокислотной последовательности родственный всем другим известным К+-каналам, включая потенциалзависимый К+-канал нейронов. Среди членов этого семейства белков наибольшее сходство аминокислотных последовательностей наблюдается в «области поры», которая содержит фильтр ионной селективности, позволяющий ионам К+ (радиус 1,33 А) проходить в 10 000 раз быстрее, чем ионам Na+(радиус 0,95 А), — со скоростью (около 108 ионов/с), что приближается к теоретическому пределу в случае неограниченной диффузии.

К+-канал состоит из четырех идентичных субъединиц, которые пронизывают мембрану и образуют конус внутри конуса, окружающего ионный канал, при этом широкий конец двойного конуса направлен во внеклеточное пространство (рис. 11-48). Каждая субъединица имеет две трансмембранные α-спирали, а также третью, более короткую спираль, которая принимает участие в формировании поры. Внешний конус образуется одной из трансмембранных спиралей каждой субъединицы. Внутренний конус, образованный четырьмя другими трансмембранными спиралями, окружает ионный канал и поддерживает фильтр ионной селективности.
Рис. 11-48. К+-канал Streptomyces lividans. (PDB ID 1BL8) а) Изображение в плоскости мембраны. Канал состоит из восьми трансмембранных спиралей (две от каждой из четырех идентичных субъединиц), образуя конус, широкий конец которого направлен в сторону внеклеточного пространства. Внутренние спирали конуса (более бледная окраска) выстилают трансмембранный канал, а внешние спирали взаимодействуют с липидным бислоем. Короткие сегменты от каждой субъединицы сходятся на открытом конце конуса, образуя фильтр селективности, б) При рассмотрении в направлении, перпендикулярном плоскости мембраны, видны четыре субъединицы, расположенные вокруг центрального канала достаточно широкого для того, чтобы пропускать единичный ион К+. в) Схема K+-канала в поперечном сечении; показаны структурные свойства важные для работы канала (см. также рис. 11-49).
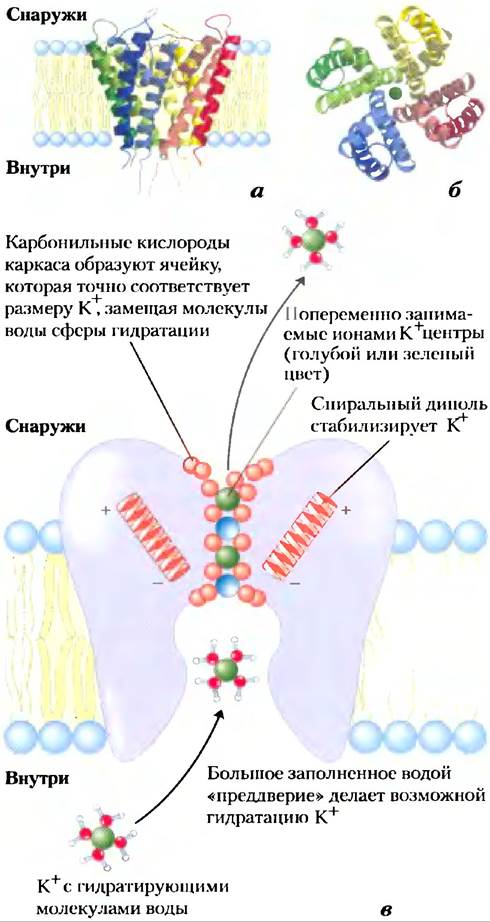
И высокую ионную специфичность, и интенсивный поток ионов через канал можно объяснить на основании наших знаний о структуре канала. На внешней и внутренней поверхностях плазматической мембраны входы в канал содержат несколько отрицательно заряженных аминокислотных остатков, которые, вероятно, увеличивают локальную концентрацию катионов, таких как К+ и Nа+. Путь иона через мембрану начинается (на внутренней поверхности) через широкий вход, наполненный водой, где ион может сохранять свою гидратную оболочку. Дальнейшая стабилизация обусловлена наличием в области поры коротких α-спиралей от каждой субъединицы, при этом частичные отрицательные заряды их электрических диполей «нацелены» на К+ в канале. На расстоянии, составляющем около двух третей пути через мембрану, канал сужается в области фильтра селективности, заставляя ион сбрасывать гидратирующие его молекулы воды. Атомы карбонильного кислорода в каркасе фильтра селективности замещают молекулы воды в гидратной оболочке, образуя серию совершенным образом скоординированных оболочек, через которую перемещается К+. Это выгодное взаимодействие с фильтром невозможно для иона Nа+, который слишком мал для того, чтобы вступить в контакт с потенциальными кислородными лигандами. Именно благодаря преимущественной стабилизации К+ в канале предпочтительна эта конформация, она выполняет функцию фильтра селективности, но мутации, которые изменяют аминокислотные остатки в этом сайте белка, лишают канат ионной селективности. Участки фильтра, ответственные за связывание ионов К+, устроены достаточно гибко, чтобы сужаться до размеров ионов Na+, входящих в канат; при этом происходят конформационные изменения, в результате которых канал перекрывается.
На фильтре селективности расположены четыре потенциальных К+-связывающих центра, каждый образован из кислородной «ячейки», которая предоставляет лиганды для ионов К+ (рис. 11-49). В кристаллической структуре фильтра селективности видны два иона К+, на расстоянии ~ 7,5 А друг от друга, две молекулы воды занимают незаполненные позиции. Ионы К+ проходят через фильтр «колонной по одному»; как раз их взаимное электростатическое отталкивание наиболее вероятно уравновешивает взаимодействие каждого иона с фильтром селективности и обеспечивает их движение. Движение двух ионов К+ является согласованным: сначала они занимают положения 1 и 3, затем перескакивают в положения 2 и 4 (рис. 11-48, в). Энергетическое различие между этими двумя конфигурациями (1/3 и 2/4) очень мало. Энергетически пора селективности не «череда холмов и долин», а плоская поверхность, которая идеальна для быстрого движения иона через канал. Структура канала, по-видимому, оптимизировалась в процессе эволюции и обеспечивает максимальные скорости потока и высокую специфичность.
Рис. 11-49. К+-связывающие сайты в поре селективности К+-канала. (РDВ ID 1J95) Карбонильные атомы кислорода (красный цвет) пептидного остова в поре селективности «высовываются» в канал, взаимодействуя с проходящим ионом К+ и стабилизируя его. Эти лиганды расположены самым оптимальным образом для того, чтобы взаимодействовать с каждым из четырех ионов К+, но не взаимодействовать с меньшими по размеру ионами Na+. Это преимущественное взаимодействие с К+ является основой ионной селективности. Взаимное отталкивание между ионами К+ приводит к тому, что одновременно бывают заняты только два из четырех центров (оба зеленых или оба голубых), и препятствует стремлению одиночного иона К+ закрепиться на одном сайте. Совместный эффект связывания К+ с карбонильным кислородом и отталкивания между ионами К+ гарантирует, что ион продолжит движение, изменяя свое положение за время 10-100 нс, и что отсутствуют большие энергетические барьеры для прохождения ионом его пути через мембрану.
Потенциалзависимые калиевые каналы имеют более сложную структуру по сравнению с тем, что изображено на рис. 11-48, но основные элементы те же. Например, потенциалзависимые каналы млекопитающих, относящиеся к семейству Shaker, представляют собой анионные каналы, аналогичные показанному на рис. 11-48 бактериальному канату, но содержат дополнительные белковые домены, чувствительные к мембранному потенциалу, которые перемещаются в ответ на изменение потенциала и при этом вызывают открытие или закрытие К+-канала (рис. 11-50). Наиболее важная трансмембранная спирать потенциал чувствительного домена калиевого канала из семейства Shaker содержит четыре остатка Arg. Положительные заряды на этих остатках заставляют спираль перемещаться по мембране в ответ на изменение электрического поля (мембранного потенциала).
Рис. 11-50. Структура потенциалзависимых калиевых каналов. (PDB ID 2А79) Кристаллическая структура комплекса Kvl.2- β2 из мозга крысы отражает основное строение К+-канала (соответствует рис. 11-48) и всех дополнительных элементов, обеспечивающих чувствительность канала к изменениям мембранного потенциала: четырех трансмембранных спиральных участков каждой субъединицы и четырех β-субъединиц. Весь комплекс (вид в плоскости мембраны (а) и вид в плоскости, перпендикулярной мембране, при взгляде извне (б)) изображен, как на рис. 11-48, причем каждая субъединица имеет свой цвет, а каждая из четырех β-субъединиц имеет тот же цвет, что и субъединица, с которой она связана. б) Все трансмембранные спирали одной субъединицы (красной субъединицы) пронумерованы от S1 до S6. Субъединицы S5 и S6 из каждой из четырех субъединиц образуют сам канал и соответствуют двум трансмембранным спиралям из каждой субъединицы на рис. 11-48. Спираль S4 содержит консервативный остаток Arg и считается главным движущим элементом потенциалчувствительного механизма. в) Схема устройства потенциалзависимого канала с изображением центральной поры и дополнительных структур, обеспечивающих чувствительность канала к изменениям потенциала. Содержащая консервативный остаток Agi, спираль S4 обозначена оранжевым цветом. Для простоты изображения β-субъединицы в данной проекции не показаны. Обычно трансмембранный электрический потенциал (отрицательный внутри клетки) воздействует на положительно заряженные боковые цепи остатка Arg в S4 со стороны цитозоля. При деполяризации мембраны напряжение ослабевает, а при полном обращении мембранного потенциала S4 вытягивается во внеклеточное пространство. г) Эти перемещения S4 сопряжены с открытием и закрытием калиевого канала, который показан на рисунке как открытым, так и закрытым. Хотя в закрытом канале присутствуют ионы К+, дно поры со стороны цитозоля закрыто, что предотвращает прохождение потока ионов.
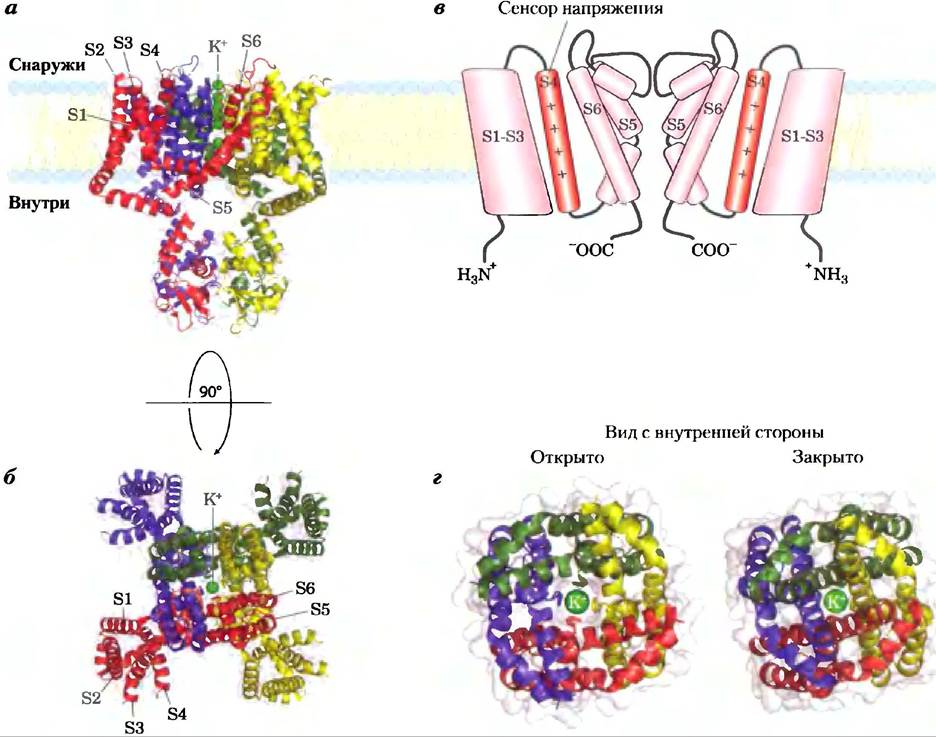
Кроме того, в клетках есть ионные канаты, которые избирательно пропускают ионы Na+или Са2+, но не пропускают ионы К+. В каждом случае способность избирательно пропускать тот или иной катион зависит от наличия в участке связывания кармана правильного размера (не слишком большого, но и не слишком маленького) для размещения иона; кроме того, в этом кармане должны быть правильным образом ориентированы карбонильные атомы кислорода, способные вытеснить гидратную оболочку иона. Такого соответствия можно достичь и с более мелкими молекулами, чем белки. Например, валиномицин (рис. 11-45) обладает выраженной специфичностью при связывании определенных ионов. Химики создали небольшие молекулы, которые с чрезвычайно высоким сродством связывают ионы лития (радиус 0,60 А), натрия (0,95 А), калия (1,33 А) или рубидия (1,48 А). Однако биологические структуры — канальные белки — не только специфическим образом связывают ионы, но и переносят их через мембрану.
Потенциалзависимые ионные каналы играют ключевую роль в работе нейронов
Практически любая быстрая передача сигнала между нейронами и тканями (например, мышечной тканью) осуществляется посредством быстрого открытия и закрытия ионных каналов в плазматической мембране. Например, натриевые каналы в плазматической мембране нейронов чувствуют мембранный потенциал и открываются или закрываются в ответ на его изменения. Эти потенциалзависимые каналы обычно избирательны по отношению к ионам натрия по сравнению со всеми другими однозарядными или двухзарядными катионами (которые проходят через эти каналы в 100 раз реже, чем ионы натрия) и обеспечивают очень высокую скорость потока (> 107ионов/с). В норме (в состоянии покоя) Nа+-каналы активируются (открываются) при падении мембранного потенциала, а далее подвергаются очень быстрой инактивации. Открытыми каналы бывают очень короткое время — порядка считанных миллисекунд, а закрытыми (неактивированными) гораздо дольше — несколько миллисекунд. На активации и инактивации натриевых каналов основана передача нервных импульсов (см. рис. 12-25).
Другой хорошо изученный ионный канал — никотиновый ацетилхолиновый рецептор, который участвует в передаче электрического сигнала от моторного нейрона на мышечное волокно в нейромышечном соединении (подает сигнал мышце, что нора сокращаться). (Никотиновые рецепторы первоначально отличали от мускариновых рецепторов по чувствительности первых к никотину, вторых — к алкалоиду из грибов мускарину. Они различаются также по структуре и функциям.) Ацетилхолин, выделенный моторным нейроном, диффундирует на расстояние нескольких микрометров в плазматическую мембрану миоцита, где он связывается с ацетилхолиновым рецептором. Это вызывает конформационные изменения в рецепторе, которые служат причиной открывания его ионного канала. Результирующее движение положительных зарядов внутрь деполяризует плазматическую мембрану, вызывая сокращение. Ацетилхолиновый рецептор позволяет Nа+, К+ и Са2+ перемещаться через мембрану с одинаковой легкостью, но другие катионы и все анионы не способны к перемещению. Движение Nа+ через ионный канал ацетилхолинового рецептора является ненасыщаемым (скорость изменяется пропорционально изменению концентрации внеклеточного натрия [Nа+]) и очень быстрым — около 2 • 107 ионов/с при физиологических условиях.

Ацетилхолиновый рецепторный канал — типичный представитель многих других ионных каналов, которые продуцируют электрические сигналы или отвечают на них: у него есть «ворота», которые открываются в ответ на стимуляцию сигнальной молекулой (в нашем случае это ацетилхолин), и внутренний временной механизм, который закрывает ворота через доли секунды. Таким образом, ацетилхолиновый сигнал является кратковременным — необходимое свойство проведения электрического сигнала.
На основе сходства между аминокислотными последовательностями других химически управляемых ионных каналов и ацетилхолинового рецептора рецепторные каналы, отвечающие на действие внеклеточных сигнальных веществ — y-аминомасляной кислоты (ГАМК), глицина и серотонина, классифицируются как относящиеся к суперсемейству ацетилхолинового рецептора и, вероятно, имеют одинаковую трехмерную структуру и механизм, регулирующий открытие канала. ГАМКA и глициновые рецепторы — это анионные каналы, специфичные для Сl- и НСO3-, а серотониновый рецептор, подобно ацетилхолиновому, катионспецифичный.
Другой класс лигандзависимых ионных каналов отвечает на действие внутриклеточных лигандов: 3',5'-циклического гуанозинмононуклеотида (сGМР) в глазу позвоночных, сGМР и сАМР в обонятельных нейронах и инозит-1,4,5- трисфосфата (IР3) во многих типах клеток. Эти каналы составлены из множественных субъединиц, каждый имеет шесть трансмембранных спиральных доменов. Мы обсудим сигнальные функции этих ионных каналов в гл. 12.
Ряд транспортеров, приведенных в табл. 11-6, в данной главе, не обсуждался; механизмы их работы рассмотрены ниже.
Таблица 11-6. Транспортные системы, описанные в данной книге
Транспортная система и локализация |
Номep рисунка |
Функция |
Антипортер адениннуклеотида внутренней мембраны митохондрии |
19-28 |
Импортирует субстрат ADP для окислительного фосфорилирования и экспортирует продукт АТР |
Ацилкарнитин/карнитин-транснортер внутренней мембраны митохондрии |
17-6 |
Импортирует жирные кислоты в матрикс для β-окислсния |
Pi/H-симпортep внутренней мембраны митохондрии |
19-28 |
Поставляет Pi для окислительного фосфорилирования |
Малат/α-кетоглугутаратный транспортер внутренней мембраны митохондрии |
19-29 |
Переносит восстанавливающие эквиваленты (в виде малаш) из матрикса в цитозоль |
Глутамат/аспартатный траtнспортер внутренней мембраны митохондрии |
19-29 |
Заканчивает перенос, начатый малат/ и кетоглутаратным челноком |
Транспортер нитрата внутренней мембраны митохондрии |
21-10 |
Поставляет в цитозоль цитрат как источник ацетил-СоА для синтеза липидов |
Транспортер пирувата внутренней мембраны митохондрии |
21-10 |
Часть механизма переноса цитрата из матрикса в цитозоль |
Транспортер жирных кислот плазматической мембраны миоцита |
17-3 |
Импортирует жирные кислоты для использования в качестве топлива |
Транспортеры протонов комплексов I, III, IV внутренней мембраны митохондрии |
19-6 |
Действует как энергозапасающий механизм при окислительном фосфорилировании, превращая ноток электронов в протонный градиент |
Гермогенин (белок-разобщитель), протонная пора внутренней мембраны митохондрии |
19-34 23-35 |
Сбрасывает протонный градиент в митохондриях в качестве механизма термогенеза и или ликвидации избыточного топлива |
Комплекс цитохрома bfпротонный транспортер тилакоида хлоропласта |
19-59 |
Работает как протонный насос, приводимый в действие электронным потоком но Z-схеме; источник протонного градиента для фотосинтетического образования АТР |
Бактериородопсин, светоуправляемый протонный насос |
19-66 |
Светоуправляемый источник протонного градиента для синтеза АТР галофильной бактерией |
F0F1 АТРаза/АТР-синтаза внутренней мембраны митохондрии,тилакоида хлоропласта и бактериальной плааматической мембраны |
19-61 |
Взаимопревращает энергию протонного градиента и ATР при окислительном и фотофосфорилировании |
Pi/триозофосфатный антипортер внутренней мембраны хлоропласта |
20-15, 20-16 |
Экспортирует фотосинтетнческий продукт из стромы; импортирует Рiдля синтеза АТР |
Бактериальный белковый транспортер |
27-44 |
Экспортирует секретируемые белки через плазматическую мембрану |
Белкопая транслоказа эндоплазматического ретикулума |
27-38 |
Переносит в ЭР белки предназначенные для плазматической мембраны, секреции иди органелл |
Белковая транслоказа ядерной поры |
27-42 |
Переносит белки между ядром и цитоплазмой |
Рецептор ЛПНП в плазматической мембране животной клетки |
21-42 |
Путем вызываемого рецепторами эндоцитоза импортирует липид-переносящие частицы |
Глюкозный транспортер плазматической мембраны животной клетки; регулируется инсулином |
12-16 |
Увеличивает способность мышечной и жировой ткани удалять избыток глюкозы из крови |
Р3-зависимый Са2+-канал эндоплазматического рети кулума |
12-10 |
Делает возможной передачу сигнала путем изменений концентрации Са2+ в цитозоле |
GMP-завиоимын Са2+-канал колбочек и палочек сетчатки |
12-36 |
В глазу позвоночных делает возможной передачу сигнала через родопсин, связывающийся с сАМР-фосфодиэтеразой |
Потенциалзависимый Na+-канал нейрона |
12-25 |
Создаст потенциалы действия при передаче нервного импульса |
Дефектные ионные каналы могут приводить к неблагоприятным физиологическим последствиям
Важность ионных каналов для физиологических процессов становится ясной по эффектам от мутаций в специфических каналообразующих белках (табл. 11-7, доп. 11-3). Генетические дефекты в потенциалзависимом Na+-канале плазматической мембраны миоцита приводят к болезням, при которых мышцы периодически либо подвергаются параличу (как при гиперкалиемическом периодическом параличе), либо становятся «одеревеневшими» (как при врожденной парамиотонии). Как было упомянуто ранее, кистозный фиброз обусловлен мутацией, которая изменяет одну аминокислоту в белке СFТR, СI--ионном канале; в этом случае нарушается не передача нервного импульса, а секреция клетками различных экзокринных желез, активность которых сопряжена с током ионов СI-.
Таблица 11-7. Некоторые заболевания, возникающие из-за дефектов ионных каналов
Ионный канал |
Поврежденный ген |
Заболевание |
Na+ (потенциалзависимый, скелетная мышца) |
SCN4A |
Гиперкалиемический периодический паралич (или врожденная парамиотония) |
Nа+ (потенциалзависимый, нейроны) |
SCN1A |
Генерализованная эпилепсия с фебрильными судорогами |
Nа+ (потенциалзависимый, сердечная мышца) |
SCN5A |
Синдром 3 удлинения QТ |
Са2+ (нейроны) |
CACNA1A |
Семейная гемиплегическая мигрень |
Са2+ (потенциалзависимый, сетчатка) |
CACNA1F |
Врожденная постоянная ночная слепота |
Са2+ (полицистин-10) |
PKD1 |
Поликистозная болезнь почки |
К+ (нейроны) |
KCNQ4 |
Доминантная тугоухость |
К+ (потенциалзависимый, нейроны) |
KCNQ2 |
Наследственные доброкачественные судороги новорожденных |
Неспецифический катионный (сGМР-регулируемый, сетчатка) |
CNCG1 |
Пигментация сетчатки |
Ацетилхолиновый рецептор (скелетная мышца) |
CHRNA1 |
Врожденный миастенический синдром |
Сl- |
CFTR |
Кистозный фиброз |
Многие природные токсины действуют на ионные каналы, и возможности этих токсинов еще более наглядно иллюстрируют важность нормального функционирования ионных каналов. Тетродотоксин (вырабатывается рыбами иглобрюхами, Sphaeroides rubripes) и сакси- токсин (вырабатывается морскими панцирножгутиковыми р. Gonyaulax, которые вызывают «красный прилив») оказывают свое действие при связывании с потенциалзависимыми Nа+-каналами нейронов, препятствуя возникновению
нормальных потенциалов действия. Из иглобрюхов готовят японский деликатес фугу, но могут его готовить только повара, специально обученные отделять сочные съедобные кусочки от смертельно ядовитых. Употребление в пищу моллюсков и ракообразных, вскормленных на р. Gonyaulax, также может быть смертельно опасным; моллюски нечувствительны к сакситоксину, но накапливают его в мышцах, которые становятся страшно ядовитыми для организмов, стоящих более высоко в пищевой цепи. Яд черной мамбы содержит дtндротоксин, который мешает работе потенциалзависимых К+-каналов. Турбокурарин — активный компонент яда кураре (использовался как яд для стрел в бассейне реки Амазонки) и два других токсина змеиных ядов — кобротоксин и бунгаротоксин — блокируют ацетилхолиновый рецептор или препятствуют открытию его ионного канала. Блокируя сигналы от нервов к мышцам, все эти токсины вызывают паралич и даже смерть. Зато чрезвычайно высокое сродство бунгаротоксина к ацетилхолиновому рецептору (Кd = 10-15 М) оказалось полезным для экспериментаторов: радиоактивно меченный токсин использовался для количественного определения рецептора в процессе его очистки. ■
Краткое содержание раздела 11.3 Транспорт веществ через мембраны
■ Для перемещения полярных соединений и ионов через биологические мембраны необходимы белки-переносчики (транспортеры). Некоторые транспортеры просто облегчают пассивную диффузию через мембрану от более высокой концентрации к более низкой. Другие осуществляют активное движение веществ против электрохимического градиента; такой транспорт должен быть сопряжен с источником метаболической энергии.
■ Переносчики, подобно ферментам, характеризуются насыщаемостью и стереоспецифичностью в отношении своих субстратов. Транспорт с участием таких систем может быть, как пассивным, так и активным. Первичный активный транспорт осуществляется под действием АТР или с помощью реакций с переносом электронов; вторичный активный транспорт является результатом сопряженного переноса двух веществ, одно из которых (часто Н+ или Na+) перемещается по электрохимическому градиенту, а другое — против градиента.
■ GLUT-трансиортеры, такие как GLUT1 эритроцитов, переносят глюкозу в клетки посредством облегченной диффузии. Эти транспортеры являются унипортерами, перенося только один субстрат. Симпортеры делают возможным одновременный перенос двух веществ в одном направлении; примерами могут служить транспортер лактозы Е. coli,приводимый в действие энергией протонного градиента (лактоза/Н+-симпортер), и транспортер глюкозы клеток кишечного эпителия, приводимый в действие градиентом Na+(симпорт глюкоза/Na+). Антипортеры опосредуют одновременный перенос двух веществ в противоположных направлениях; примерами могут служить хлоридно-бикарбонатный обменник в эритроцитах и повсеместно распространенная Na+/K+-ATPaзa.
■ В животных клетках Na+/K+-ATPaзa поддерживает разницу между цитозольной и внеклеточной концентрациями Na+ и К+, а результирующий градиент Na+ используется как источник энергии для самых разнообразных процессов вторичного активного транспорта.
■ Nа+/К+-АТРаза плазматической мембраны и Са2+-транспортеры саркоплазматического и эндоплазматического ретикулумов (насосы SERCA) являются примерами АТРаз P-типа; они подвергаются обратимому фосфорилированию в процессе каталитического цикла и ингибируются аналогом фосфата ванадатом. Относящиеся к АТРазам F-типа протонные насосы (ATP-синтазы) являются главными для энергосберегающих механизмов в митохондриях и хлоропластах. АТРазы V-типа создают градиенты протонов через некоторые внутриклеточные мембраны, в том числе вакуолярные мембраны растений.
■ ABC-транспортеры переносят из клетки наружу разнообразные субстраты, включая многие лекарства, используя АТР в качестве источника энергии.
■ Ионофоры — это жирорастворимые молекулы, которые связывают специфические ионы и пассивно переносят их через мембраны, рассеивая энергию электрохимических ионных градиентов.
■ Вода переносится через мембраны с помощью аквапоринов. Некоторые аквапорины подвержены регуляции; известны аквапорины, способные также переносить глицерин или мочевину.
■ Ионные каналы создают гидрофильные поры, через которые выбранные ионы могут диффундировать, двигаясь по электрическому градиенту или химическому градиенту концентрации; они обычно ненасыщаемы и обладают очень высокими скоростями потока. Многие ионные канаты высокоспецифичны для одного иона, большинство канатов регулируются либо потенциатом, либо лигандами (химически управляемые). В бактериальных К+-канатах фильтр селективности позволяет лигандам с правильной геометрией замещать гидратирующую ион К+ воду, когда он проходит через мембрану. Некоторые К+-каналы являются потенциалзависимыми. Ацетилхолиновый рецептор/канал регулируется ацетилхолином, который вызывает тонкие конформационные изменения, открывающие и закрывающие дорогу через мембрану.