ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
12. БИОСИГНАЛИЗАЦИЯ
12.5. Мультивалентные адаптерные белки и мембранные рафты
Изучение сигнальных систем, таких, как были рассмотрены нами до сих пор, позволило сделать два обобщения: 1) протеинкиназы, фосфорилирующие остатки Туr, Ser и Thr, играют ключевую роль в передаче сигнала; 2) обратимые белок- белковые взаимодействия, вызванные обратимым фосфорилированием остатков Туr, Ser и Thr в сигнальных белках, создают возможность для их взаимодействия с другими белками. На самом деле многие сигнальные белки мультивалентны в том смысле, что они могут взаимодействовать с несколькими различными белками одновременно, образуя мультибелковые сигнальные комплексы. В этом разделе мы представляем несколько примеров, иллюстрирующих общие принципы взаимодействий, зависимых от фосфорилирования белков в путях передачи сигналов.
Белковые модули связывают фосфорилированные остатки Tyr, Ser или Thr в белках-партнерах
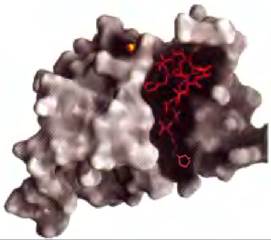
Белок Grb2 в инсулиновом сигнальном пути (рис. 12-15 и 12-19) через свой SН2-домен связывается с другими белками, которые содержат доступные остатки Ⓡ-Туr. Геном человека кодирует по крайней мере 87 SH2-содержащих белков, о многих из них известно, что они участвуют в передаче сигналов. Участок связывания остатка Ⓡ-Туrрасположен в глубоком кармане SH2-домена, при этом каждый из атомов кислорода фосфатной группы участвует в образовании водородных связей или в электростатических взаимодействиях; заметную роль в связывании играют положительные заряды двух остатков Arg. Едва заметные отличия в структуре SН2-доменов в различных белках объясняют специфичность их взаимодействий с разными белками, содержащими Ⓡ-Туr. Специфичность взаимодействий с SH2-доменами определяют от трех до пяти остатков на С-конце остатка Ⓡ-Туr (рис. 12-21).
Рис. 12-21. Структура SH2-домена и его взаимодействие с остатком Ⓡ-Туr в белке-партнере. (РDB ID 1SНС). Поверхность SН2-домена обведена серым контуром. Атом фосфора фосфатном группы во взаимодействующем Ⓡ-Туr показан в виде оранжевого шарика; большая часть остатка затенена. Следующие несколько остатков в направлении к С-концу белка-партнера выделены красным цветом. SН2-домен взаимодействует с Ⓡ-Туr (который как фосфорилированный остаток обозначен позиционным индексом 0), а также со следующими тремя в направлении к С-концу остатками (обозначены индексами +1, +2, +3). Некоторые SН2-домены (Srс, Fуn, Нcк, Nск) имеют тенденцию к взаимодействию с отрицательно заряженными остатками в положениях +1 и +2; другие (РLС-y1, SНР-2) имеют протяженную гидрофобную полость, которая «выбирает» алифатические остатки в положениях от +1 до +5. Этими различиями определяются подклассы SН2-доменов, специфичных по отношению к разным партнерам.
Фосфотирозинсвязывающие домены (РТВ- домены от англ. phosphotyrosine-binding domains) также связываются с Ⓡ-Туr в белках-партнерах, но по ключевым последовательностям и трехмерной структуре они отличаются от SН2-доменов. Геном человека кодирует 24 белка, содержащие РТВ-домены, в то числе IRS-1, который уже встречался нам в роли каркасного белка при передаче инсулинового сигнала (рис. 12-15). Остатки Ⓡ-Туr для связывания SН2-доменов и РТВ-доменов в белках-партнерах создаются тирозинкиназами и уничтожаются фосфопротеин- фосфатазами (РТРазами).
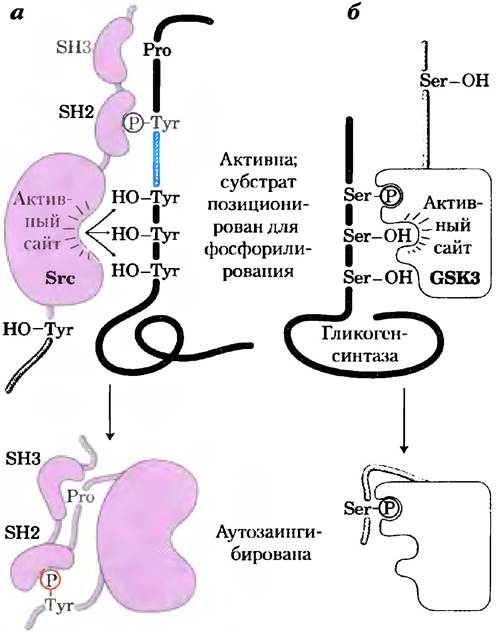
Другие сигнальные протеинкиназы, включая РКА, РКС, PKG и членов МАРК-каскада, фосфорилируют остатки Ser или Thr в своих белках- мишенях, которые в некоторых случаях приобретают способность взаимодействовать с партнерами через фосфорилированный остаток, запуская дальнейшие стадии процесса. Уже составлен алфавитный список доменов, связывающих остатки Ⓡ-Ser или Ⓡ-Thr, и без сомнения, еще много таких доменов предстоит обнаружить. Каждый домен лучше всего взаимодействует с определенной последовательностью, находящейся вблизи фосфорилированного остатка, так что домены представляют собой семейства высокоспецифичных распознающих сайтов, способных связывать специфический набор фосфорилированных белков. Доменсвязывающий партнер может находиться и в том же белке. Фосфорилирование некоторых протеинкиназ ингибирует их активность, благоприятствуя взаимодействию SН2-домена с Ⓡ-Туr в другом домене того же фермента. Например, растворимая Туr-протеинкиназа Src, фосфорилированная по ключевому остатку Туr, оказывается неактивной, поскольку для ее активности SН2-домен должен связываться с субстратом, а не с собственным внутренним Ⓡ-Туr (рис. 12-22, а). Киназа гликогенсинтазы 3 (GSK3) неактивна, если фосфорилирована по остатку Ser в аутоингибиторном домене (рис. 12-22, б). Дефосфорилирование этого домена позволяет ферменту связывать и фосфорилировать белки-мишени.
Кроме трех наиболее часто фосфорилируемых аминокислотных остатков существует четвертая структура, вокруг которой происходит формирование надмолекулярных комплексов сигнальных белков, — фосфорилированная «головка» мембранных фосфатидилинозитов. Многие сигнальные белки содержат домены, подобные доменам SH3 и PH (от англ. plexlrin homology domain), которые прочно связываются с РIР3, выступающим из внутреннего монослоя плазматической мембраны. В том участке мембраны, где фермент РI-ЗК создает эту «головку» (как в ответ на сигнал инсулина), начинают скапливаться связывающиеся с ней белки.
Рис. 12-22. Механизм аутоингибирования Src и GSK3. а) В активной форме Tyr-киназы Src SН2-домен связывается с Ⓡ-Туr субстрата, a SH3-домен — с богатой пролином областью субстрата, располагая активный центр киназы параллельно нескольким остаткам Туr на субстрате (наверху). Когда Src фосфорилируется по специфическому остатку Туr (внизу), SН2-домен связывается с внутренним Ⓡ-Туr вместо Ⓡ-Туr субстрата, препятствуя продуктивному связыванию киназы с ее белковым субстратом; таким образом, фермент аутоингибируется. б) В активной форме киназы 3 гликогенсинтазы (GSK3) внутренний Ⓡ-Ser-связывающий центр может связывать остаток Ⓡ-Ser в субстрате (гликогенсинтазе) и, следовательно, обеспечивает киназе позицию, нужную для фосфорилирования соседних остатков Ser (наверху). Фосфорилирование внутреннего остатка серина позволяет этому внутреннему сегменту киназы занять Ⓡ-Ser-связывающий участок, блокируя связывание субстрата (внизу).
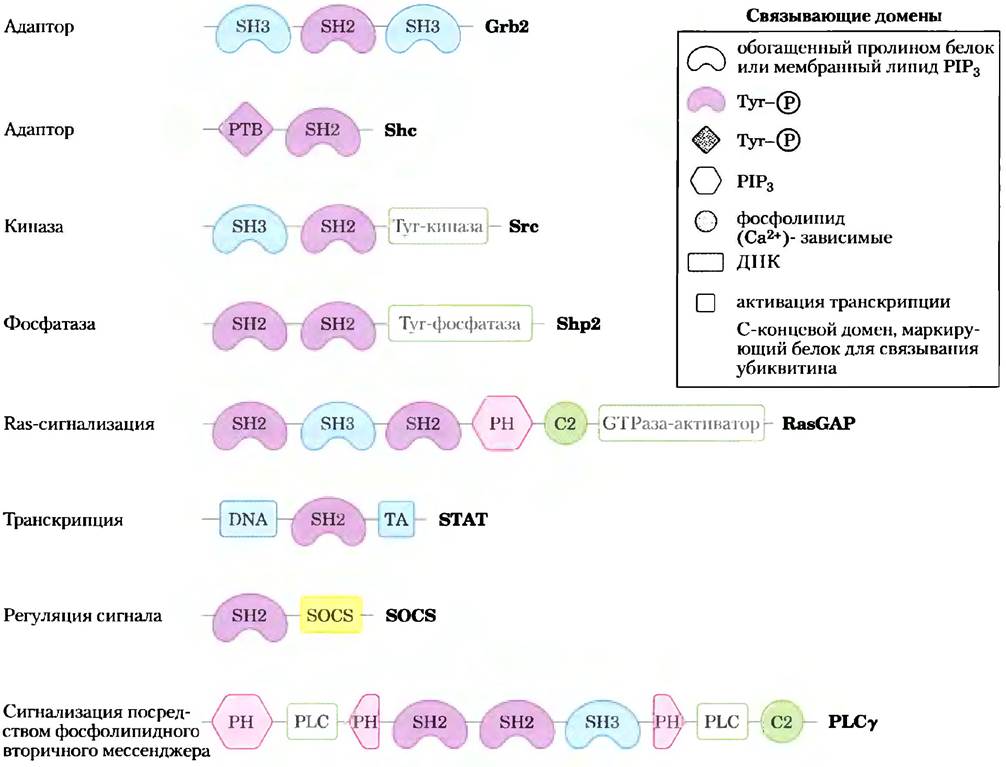
Большинство белков в плазматической мембране, участвующих в передаче сигналов, содержат один или несколько, белок- или фосфолипидсвязывающих доменов; многие имеют три или более таких домена и, таким образом, могут одновременно взаимодействовать с несколькими сигнальными белками. На рис. 12-23 представлены лишь несколько из большого числа известных мультивалентных белков — участников процесса сигнализации. В состав многих комплексов входят компоненты, специальные домены которых отвечают за связывание с мембраной. Значительная часть процессов передачи сигнала происходит на внутренней поверхности плазматической мембраны, поэтому естественно, что локализация молекул, которые должны столкнуться друг с другом для дальнейшей передачи сигнала, ограничена двумерным пространством — поверхностью мембраны. Вероятность столкновения в двумерном пространстве намного превосходит вероятность столкновения в трехмерном пространстве цитозоля.
Рис. 12-23. Некоторые связывающие модули сигнальных белков. Каждым белок изображен линией (N-конец слева); символы указывают локализацию консервативных связывающих доменов; об их специфичности см. текст; PH обозначает плекстриновую гомологию; другие сокращения см. в тексте); зелеными прямоугольниками показана каталитическая активность. Название каждого белка дается по С-концу. Эти сигнальные белки взаимодействуют с фосфорилированными белками или фосфолипидами в многих комбинациях, образуя интегральные сигнальные комплексы.
Подводя итоги, можно сказать, что изучение многих сигнальных белков и их многочисленных доменов, ответственных за связывание с другими компонентами, привело к воссозданию удивительной картины путей проведения сигналов в клетке. Первоначальный сигнал вызывает фосфорилирование рецептора или белка-мишени, приводя в действие совокупность больших мультибелковых комплексов, удерживаемых вместе на каркасах, которые формируются из адаптерных белков, имеющих мультивалентную связывающую способность. Некоторые из этих комплексов содержат несколько протеинкиназ, которые последовательно активируют друг друга, образуя каскад фосфорилирования и обеспечивая многократное усиление первоначального сигнала. Взаимодействие между протеинкиназами в каскаде происходит не в результате случайных столкновений в трехмерном пространстве. Например, в случае МАРК-каскада для связывания всех трех протеинкиназ (МАРК, МАРКК и МАРККК) служит целое семейство адаптерных белков, которые обеспечивают их близкое расположение, правильную ориентацию и, кроме того, придают взаимодействию протеинкиназ аллостерический характер, в результате чего их последовательное фосфорилирование происходит даже при очень слабых стимулах.
Фосфотирозинфосфатазы (РТРазы) удаляют фосфат из остатков Ⓡ-Туr, снимая эффект фосфорилирования. Некоторые из этих фосфатаз являются рецептороподобными мембранными белками, которые, по всей вероятности, регулируются пока еще не идентифицированными внеклеточными факторами; другие РТРазы растворимы и содержат SH2-домены. Кроме того, клетки животных содержат протеинфосфосерин- и протеинфосфотреонинфосфатазы, которые снимают эффекты Ser- и Thr-специфичных протеинкиназ. Передача сигналов происходит в белковых «цепях», эффективно создающихся сигнальным рецептором в ответ на действие эффектора и способных моментально выключаться посредством гидролиза одной фосфоэфирной связи.
Мультивалентность сигнальных белков делает возможным образование ансамблей из большого числа разнообразных комбинаций сигнальных модулей, каждая комбинация, по-видимому, соответствует определенным сигналам, типам клеток и метаболическим состояниям. Множество протеинкиназ и фосфопротеинсвязывающих доменов, каждый с собственной специфичностью (необходимая консенсусная последовательность в субстрате), образуют много комбинаций и множество сигнальных контуров исключительной сложности.
Мембранные рафты и кавеолы могут обособлять сигнальные белки
Мембранные рафты (с. 543) — это области мембранного бислоя, обогащенные сфинголипидами, стеринами и некоторыми белками; многие связаны с бислоем посредством GPI-якорей.
Адренергический рецептор перемещается в рафты, содержащие G-белки, аденилатциклазу, РКА и специфическую протеинфосфатазу, РР2, которые вместе образуют высокоинтегрированную сигнальную единицу. Изоляция всех элементов, необходимых для начала и завершения ответа на сигнал, в небольшом участке плазматической мембраны позволяет клетке быстро увеличивать концентрацию вторичного мессенджера в строго ограниченном пространстве.
По-видимому, некоторые рецепторные тирозинкиназы (EGF-R и PDGF-R) локализуются в рафтах, и подобная изоляция, скорее всего, имеет функциональное значение. Когда холестерин удаляется из рафтов путем обработки циклодекстрином (связывает холестерин и удаляет его из мембран), рафты разрушаются, а некоторые сигнальные пути оказываются поврежденными.
Если рецепторная тирозинкиназа в рафте фосфорилируется, а фосфотирозинфосфатаза, которая снимает это фосфорилирование, находится в другом рафте, то дефосфорилирование Тyr-киназы будет заторможено или полностью предотвращено. Возможно, взаимодействия между адаптерными белками достаточно сильны для того, чтобы втянуть в рафт сигнальный белок или чтобы вытолкнуть рецепторы из рафта. Например, рецепторы EGF в изолированных фибробластах обычно концентрируются в особых рафтах, называемых кавеолами (рис. 11-21), но если их обработать EGF, то рецепторы покидают рафт. Эта миграция зависит от активности рецепторной протеинкиназы; мутантные рецепторы, лишенные этой активности, остаются в рафте при обработке EGF. Кавеолин — интегральный мембранный белок, локализованный в кавеоле, — фосфорилируется по остатку Туг в ответ на действие инсулина и после фосфорилирования может позволить активированному теперь рецептору EGF втянуть своих партнеров по связыванию в рафт. Обособление сигнальных белков в рафтах добавляет еще одно «измерение» к уже достаточно сложным процессам, инициируемым внеклеточными сигналами.
Краткое содержание раздела 12.5 Мультивалентные адаптерные белки и мембранные рафты
■ Многие сигнальные белки содержат домены, связывающие фосфорилированные остатки Туr, Ser или Thr в других белках; специфичность связывания для каждого домена определяется последовательностями аминокислот, которые примыкают к фосфорилированному остатку в субстрате.
■ SH2- и РТВ-домены связываются с белками, содержащими остатки Ⓡ-Туr; другие домены связывают в разных ситуациях остатки Ⓡ-Ser и Ⓡ-Thr.
■ SH3- и РН-домены связывают мембранный фосфолипид РIР3.
■ Многие сигнальные белки являются мультивалентными, содержащими несколько различных связывающих модулей. Комбинируя субстратную специфичность разных протеинкиназ со специфичностью доменов, которые связывают фосфорилированные остатки Туr, Ser или Thr, и с фосфатазами, которые могут быстро инактивировать сигнальный путь, клетки создают большое количество мультибелковых сигнальных комплексов.
■ Мембранные рафты и кавеолы замыкают группы сигнальных белков в небольших областях плазматической мембраны, способствуя их взаимодействиям и делая сигнализацию более эффективной.