ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
12. БИОСИГНАЛИЗАЦИЯ
12.6. Регулируемые ионные каналы
Ионные каналы играют основную роль в передаче электрических сигналов в возбудимых клетках
Некоторые клетки многоклеточных организмов являются «возбудимыми»: они умеют детектировать внешний сигнал, превращать его в электрический сигнал (в частности, изменять мембранный потенциал) и проводить далее. Возбудимые клетки играют ключевую роль в нервной проводимости, сокращении мышц, секреции гормонов, процессах чувственного восприятия, обучения и запоминания. Возбудимость сенсорных клеток, нейронов и миоцитов зависит от передатчиков сигнала — ионных каналов, которые в ответ на разнообразные стимулы предоставляют регулируемый путь через плазматическую мембрану для движения неорганических ионов, таких как Nа+, К+, Са2+ и Сl-. Ионные каналы являются регулируемыми (гл. 11); они могут открываться или закрываться в зависимости от того, будет ли соответствующий рецептор активирован или путем связывания со специфическим лигандом (например, нейромедиатором), или изменением трансмембранного электрического потенциала Vm. Na+/К+-АТРаза создает дисбаланс заряда на плазматической мембране, выбрасывая из клетки 3Nа+ на каждые 2К+, переносимые внутрь (рис. 12-24, а), и делая заряд внутри отрицательным по отношению к внешнему. Говорят, что мембрана поляризована.
Рис. 12-24. Трансмембранный электрический потенциал. а) Электрогенная Na+/К+-АТРаза создает трансмембранный электрический потенциал в -60 мВ (отрицательный внутри). б) Голубые стрелки показывают направление, в котором стремятся двигаться ионы через плазматическую мембрану животной клетки под совместным действием химического и электрического градиентов. Химический градиент перемещает Nа+ и Са2+ внутрь (приводя к деполяризации мембраны), а К+ — наружу (приводя к гиперполяризации). Электрический градиент движет Сl- наружу, против градиента концентрации (создавая деполяризацию).

Ключевые договоренности.
Vm — отрицательный, когда заряд внутри клетки отрицателен по отношению к заряду снаружи. Для типичной животной клетки Vm составляет от -60 до -70 мВ. ■
Поскольку ионные каналы обычно пропускают либо анионы, либо катионы, но не оба типа ионов, ионный поток через канал вызывает перераспределение заряда на двух сторонах мембраны, изменяя Vm. Вход положительно заряженных ионов, например, Nа+, или выход отрицательно заряженных (Сl-) деполяризуют мембрану, благодаря чему Vmстремится к нулю. Наоборот, выход К+ гиперполяризует мембрану, и Vm становится более отрицательным. Эти ионные потоки через каналы являются пассивными в противоположность активному транспорту с помощью Na+/К+ - АТРазы.
Направление спонтанного потока ионов через поляризованную мембрану определяется электрохимическим потенциалом этого иона на мембране, который складывается из двух компонентов: разности концентраций (С) данного иона с двух сторон от мембраны и разности электрического потенциала (обычно выражается в милливольтах). Энергия (∆С), которая вызывает спонтанное продвижение катиона (скажем, Nа+) по ионному каналу внутрь клетки, является функцией отношения концентраций иона на двух сторонах мембраны (Свнутри/Сснаружи) и разности электрических потенциалов (∆Ψ или Vm):
∆G = RTIn (Свнутри/Сснаружи) + ZFVm (12-1)
где R — газовая постоянная, Т — абсолютная температура, Z — заряд иона и F — константа Фарадея. Обратите внимание, что знак заряда иона определяет знак второго слагаемого в уравнении 12-1. В типичном нейроне или миоците концентрации Nа+, К+, Са2+ и Сl- в цитозоле очень отличаются от их концентраций во внеклеточной жидкости (табл. 12-6). Для приведенных концентраций и потенциала покоя -60 мВ, используя уравнение 12-1, получим, что открытие Na+- или Са2+-канала приведет к спонтанному выходу К+ (и гиперполяризации мембраны) (рис. 12-24, б).
Таблица 12-6. Концентрации ионов в клетках и внеклеточных жидкостях (мМ)
К+ |
Na+ |
Са2+ |
Сl- |
|
Тип клеток |
Внутри Снаружи |
Внутри Снаружи |
Внутри Снаружи |
Внутри Снаружи |
Аксон кальмара |
100 20 |
50 440 |
≤0,4 10 |
40-150 560 |
Мышца лягушки |
124 2,3 |
10,4 100 |
<0,1 2,1 |
1,5 78 |
Эти ионы продолжают двигаться через канал только до тех пор, пока комбинация градиента концентрации и электрического потенциала обеспечивает движущую силу, согласно уравнению 12-1. Например, по мере того как Nа+ движется по градиенту концентрации, он деполяризует мембрану. Когда мембранный потенциал достигает +70 мВ, действие этого мембранного потенциала (сопротивление дальнейшему входу Nа+) в точности равно действию градиента концентрации (увеличение потока Nа+ внутрь). При этом равновесном потенциале (E) движущая сила (∆G) равна нулю. Равновесный потенциал характерен для каждого вида ионов, поскольку градиенты концентраций различаются.
Количество ионов, которые должны двигаться, чтобы заметно изменить мембранный потенциал, пренебрежимо мало по сравнению с концентрациями Na+, К- и Сl- в клетках и внеклеточной жидкости, так что ионные потоки, которые возникают при передаче сигнала в возбудимых клетках, не оказывают существенного влияния на концентрацию этих ионов. Однако поскольку внутриклеточная концентрация Са2+ обычно очень мала (-10-7 М), вход Са2+ внутрь может значительно изменить концентрацию ионов кальция в цитозоле.
В любой момент времени мембранный потенциал клетки представляет собой результат того, сколько ионных каналов какого типа открыто в этот момент. В большинстве клеток в состоянии покоя открыто больше К+-каналов, чем Nа+-, Сl- или Са2+-каналов, и поэтому потенциал покоя ближе к Е для К+ (-98 мВ), чем для любого другого иона. Когда открыты каналы для иона Nа+, Сl или Са2+, мембранный потенциал для него стремится к Е. Регулируемое во времени открывание и закрывание ионных каналов и обусловленные этим кратковременные изменения мембранного потенциала лежат в основе электрической сигнализации, посредством которой нервная система стимулирует сокращение скелетных мышц, биение сердца или заставляет секреторные клетки высвобождать их переносчики сигнала. Более того, многие гормоны оказывают действие, изменяя мембранные потенциалы в клетках-мишенях. Эти механизмы не ограничиваются организмами животных; ионные каналы играют важную роль в ответах на сигналы от окружающей среды у бактерий, простейших и растений.
Чтобы проиллюстрировать действие ионных каналов при передаче сигнала от клетки к клетке, опишем механизмы, посредством которых нейрон проводит импульс по всей своей длине и через синапс к следующему нейрону (миоциту), используя ацетилхолин в качестве нейромедиатора.
Потенциалзависимые ионные каналы создают потенциалы действия в нейронах
В нервной системе передача сигналов совершается сетью нейронов — специализированных клеток, проводящих электрический импульс (потенциал действия) с конца клетки (тело клетки) через удлиненный цитоплазматический отросток (аксон). Электрический сигнал запускает высвобождение молекул нейромедиатора в синапсе, передавая сигнал следующей клетке цепи. Для этого механизма передачи сигналов необходимы три типа потенциалзависимых ионных каналов. По всей длине аксона находятся потенциалзависимые Nа+-каналы (рис. 12-25), которые закрыты, когда мембрана находится в состоянии покоя (Vm = -60 мВ), но открываются на короткое время, когда мембрана локально деполяризуется в ответ на действие ацетилхолина (или какого-то другого нейромедиатора). Вдоль аксона также находятся потенциалзависимые К+-каналы,которые открываются чуть позже, чем Na--каналы, в ответ на деполяризацию, индуцированную открыванием Na+-каналов. Таким образом, проходящий по аксону деполяризующий поток ионов натрия (ионы входят в клетку) быстро сменяется реполяризующим выходом ионов калия. На удаленном (дистальном) конце аксона находятся потенциалзависимые Са2+-каналы. Когда волны деполяризации и реполяризации, вызванные действием Nа+- и К+-каналов, достигают этих каналов, они открываются, ионы Са2+ входят из межклеточного пространства и запускают высвобождение нейромедиатора ацетилхолина, который передает сигнал следующей нервной клетке (запустить потенциал действия!) или мышце (сократиться!).
Потенциалзависимые Nа+-каналы очень избирательны по отношению к ионам натрия по сравнению с другими катионами (в 100 раз или более) и обеспечивают очень высокую скорость потока (>107 ионов/с). После открывания при активации Na+-каналы очень быстро подвергаются инактивации из-за снижения мембранного потенциала — каналы закрываются через несколько миллисекунд и остаются неактивными многие миллисекунды. Так как К+-каналы открываются в ответ на деполяризацию, вызванную открыванием Na+-каналов, итоговый выход ионов калия реполяризует мембрану локально. По аксону проходит волна деполяризации по мере того, как деполяризация в отдельных участках запускает волну открывания близлежащих сначала Nа+-, а затем К+-каналов (рис. 12-25). За открыванием каждого Nа+-канала следует короткий период рефрактерности, в течение которого канал не может открыться вновь; это обеспечивает однонаправленность волны деполяризации — потенциала действия — от тела нейрона к концу аксона (стадия (1) на рис. 12-25).
Рис. 12-25. Роль потенциалзависимых и химически регулируемых ионных каналов в передаче нервных импульсов. Первоначально плазматическая мембрана пресинаптического нейрона поляризуется (отрицательный заряд внутри) посредством действия электрогенной Nа+/К+-АТРазы, которая выкачивает 3 иона Nа+ наружу на каждые 2 иона К+, закачиваемые в нейрон (см. рис. 12-24). (1) Стимул, действующий на этот нейрон, вызывает перемещение потенциала действия вдоль аксона (белая стрелка) по направлению от тела клетки. Открытие одного потенциалзависимого Nа+-канала делает возможным вход Nа+; возникающая в результате этого локальная деполяризация вызывает открывание соседнего Nа+-канала и т. д. Направленность перемещения потенциала действия обеспечивается коротким периодом рефрактерности, который следует за открыванием каждого потенциалзависимого Nа+-канала. (2) Когда волна деполяризации достигает конца аксона, открываются потенциалзависимые Са2+-каналы, делая возможным вход Са2+ в пресинаптический нейрон. (3) В результате этого концентрация внутриклеточного Са2+ увеличивается, что запускает высвобождение (путем экзоцитоза) нейромедиатора ацетилхолина в синаптическую щель. (4) Ацетилхолин связывается с рецептором на постсинаптическом нейроне, вызывая открытие регулируемого ацетилхолином ионного канала. (5) Внеклеточные Na+ и Са2+ входят через этот канал, деполяризуя постсинаптическую клетку. Таким образом, электрический сигнал проходит к телу постсинаптического нейрона и перемещается вдоль аксона к третьему нейрону при соблюдении той же последовательности событий.
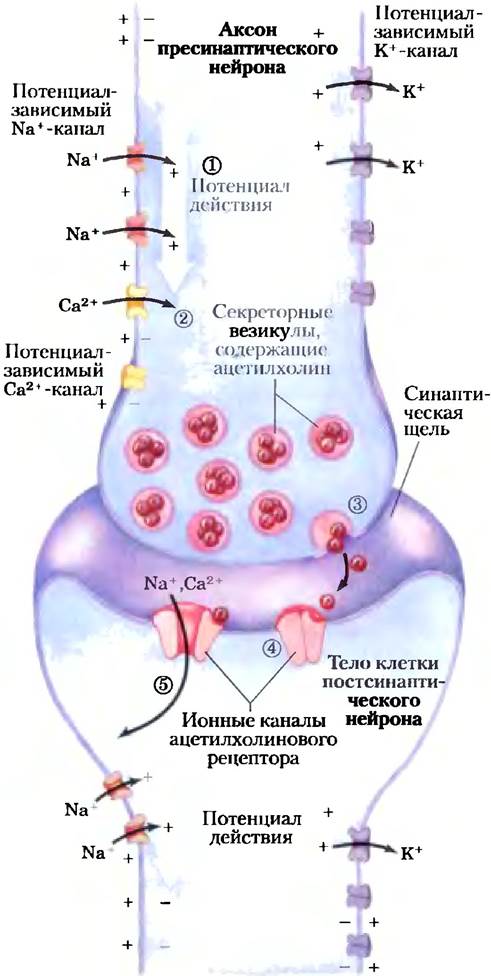
Когда волна деполяризации достигает потенциалзависимых Са2+-каналов, они открываются (стадия (2)), и ионы кальция входят в клетку из межклеточного пространства. Увеличение концентрации Са2+ в цитоплазме приводит к высвобождению ацетилхолина экзоцитозом в синаптическую щель (стадия (3)). Ацетилхолин диффундирует в постсинаптическую клетку (другой нейрон или миоцит), где связывается с рецептором и запускает деполяризацию. Так сигнал проходит в следующую клетку «цепочки». Итак, регулируемые ионные каналы передают сигналы одним из двух способов: изменяя цитозольную концентрацию иона (например, Са2+), который затем работает как вторичный мессенджер (первичный мессенджер — это гормон или нейромедиатор), или изменяя Vm и влияя на другие мембранные белки, которые чувствительны к Vm. При передаче электрического сигнала через один нейрон на следующий работают оба механизма.
В разд. 11.3 мы достаточно подробно обсудили структуру и механизм действия потенциалзависимого калиевого канала (см. рис. 11-48,11-49 и 11-50). Здесь остановимся подробнее на действии натриевых каналов. Основной элемент натриевого канала — большой полипептид (1840 аминокислотных остатков) из четырех доменов, организованных вокруг центрального канала (рис. 12-26, а, б), по которому ионы натрия проходят через мембрану. Специфичность канала к ионам натрия создается с помощью «поры», образованной участками между трансмембранными спиралями 5 и 6 каждого домена. В спирали 4 каждого домена сосредоточено много положительно заряженных остатков Аrg; считается, что этот участок перемещается в мембране при изменениях трансмембранного потенциала от -60 мВ (потенциал в состоянии покоя) до -30 мВ. Перемещение спирали 4 приводит к открыванию канала, на чем и основано его потенциалзависимое действие (рис. 12-26, в).
Рис. 12-26. Потенциалзависимые Na+-каналы нейронов. Натриевые каналы в разных тканях и в разных организмах построены из различных субъединиц, но основную функцию выполняет главная α-субъединица. а) α-Субъединица представляет собой большой белок, состоящий из четырех гомологичных доменов (от I до IV; здесь они изображены раздельно для большей наглядности), каждый из которых содержит шесть трансмембранных спиралей (от 1 до 6). Спираль 4 в каждом домене (синяя) чувствительна к изменениям напряжения, спираль 6 (оранжевая), по- видимому, образует активирующий вход. Область поры (красная), образованная участками между спиралями 5 и 6, представляет собой фильтр, а участок между доменами III и IV (зеленый) — инактивирующий вход. б) Четыре домена закручены вокруг центрального трансмембранного канала, образованного полярными аминокислотными остатками. Четыре поры (красные) сходятся вместе вблизи внешней поверхности мембраны, образуя селективный фильтр, имеющий одинаковое строение во всех натриевых каналах. Фильтр обеспечивает способность канала отличать ионы натрия от других ионов близкого размера. Инактивирующий вход (зеленый) закрывается (пунктирная линия) вскоре после открывания активирующего входа. в) Действие потенциалчувствительного механизма основано на том, что при изменении трансмембранного потенциала спираль 4 (синяя) устанавливается в перпендикулярном направлении к плоскости мембраны. Как показано в верхней части рисунка, большой положительный заряд на спирали 4 способствует тому, что при появлении отрицательного внутреннего мембранного потенциала (Vm) эта спираль оказывается втянутой внутрь. При деполяризации это притяжение ослабевает, так что спираль 4 возвращается в релаксированное состояние (внизу). Это изменение сообщается активирующему входу (оранжевый), в результате чего происходят конформационные изменения, открывающие канал при деполяризации.
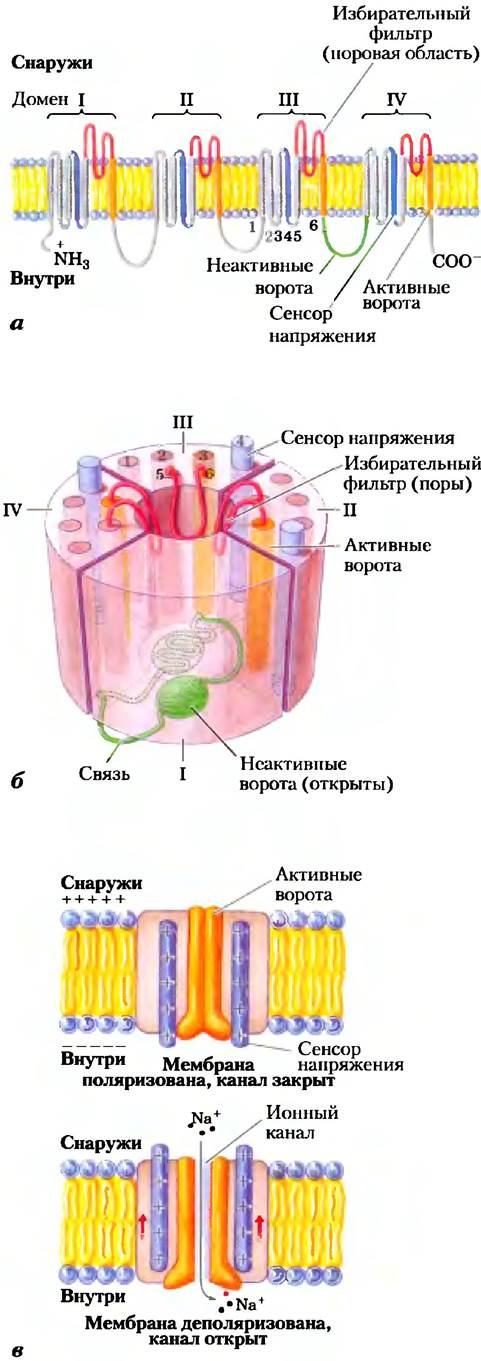
Инактивация канала, по-видимому, происходит по механизму «шарика на веревочке». Белковый домен на цитоплазматической стороне натриевого канала (инактивирующий вход, «шарик») привязан к каналу короткой полипептидной цепочкой («веревочка»; рис. 12-26, б). Этот домен свободно движется на «веревочке», когда канал закрыт, но, когда канал открывается, внутри канала освобождается участок, с которым «шарик» связывается, перекрывая канал. Вероятно, длительность пребывания ионного канала в открытом состоянии определяется длиной «веревочки»: чем длиннее «веревочка», тем дольше канал открыт. По схожему механизму могут инактивироваться и другие регулируемые ионные каналы.
Ацетилхолиновый рецептор — регулируемый лигандом ионный канал
Никотиновый ацетилхолиновый рецептор участвует в передаче электрического сигнала в некоторых типах синапсов, а также в нервно-мышечных соединениях (между моторным нейроном и мышечным волокном), подавая мышцам сигнал сокращения. (Никотиновые ацетилхолиновые рецепторы и мускариновые ацетилхолиновые рецепторы отличали друг от друга по чувствительности первых к никотину, а вторых — к грибному алкалоиду мускарину. Эти рецепторы имеют разное строение и выполняют разные функции.) Ацетилхолин, высвобождаемый пресинаптическим нейроном или моторным нейроном, диффундирует на несколько микрометров к плазматической мембране постсинаптического нейрона или миоцита, где связывается с ацетилхолиновым рецептором. Это связывание вызывает изменение конформации молекулы рецептора, заставляя ионный канал открыться. Возникающий поток катионов в клетку деполяризует плазматическую мембрану. В мышечной ткани это приводит к сокращению мышечного волокна. Ацетилхолиновый рецептор позволяет проходить ионам Са2+ и К+, но другие катионы и никакие анионы пройти не могут. Прохождение ионов натрия через ацетилхолиновый рецепторный канал является ненасыщаемым (это означает, что скорость потока ионов линейно зависит от внеклеточной концентрации Nа+), а скорость прохождения очень высока — около 2 • 107 ионов в секунду при физиологических условиях.
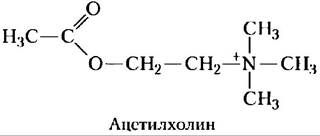
Подобно другим регулируемым ионным каналам, ацетилхолиновый рецептор открывается в ответ на стимул, посылаемый сигнальной молекулой, и имеет свой механизм отсчета времени, закрывающий канал через несколько миллисекунд. Таким образом, ацетилхолиновый сигнал краткосрочный, что, как мы видели, представляет собой важное свойство механизма передачи электрического сигнала. Нам понятны структурные изменения, которые приводят к открытию ацетилхолинового рецептора, однако не до конца изучен точный механизм «десенситизации», в результате которого вход в канал остается закрытым даже при продолжительном присутствии ацетилхолина.
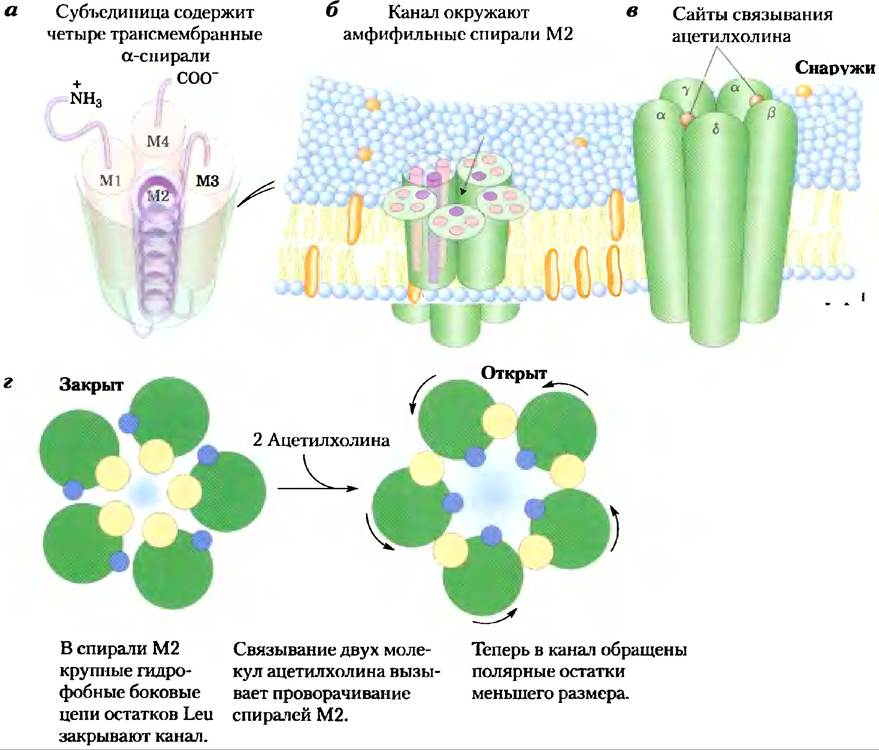
Никотиновый ацетилхолиновый рецептор состоит из пяти субъединиц: одной β-, одной y-, одной δ-субъединицы и двух идентичных α-субъединиц, каждая из которых содержит участок связывания ацетилхолина. Все пять субъединиц содержат сходную аминокислотную последовательность и третичную структуру, во всех пяти присутствуют по четыре трансмембранных спиральных участка (от M1 до М4) (рис. 12-27, а). Пять субъединиц окружают центральную пору, образованную их М2-спиралями (рис. 12-27, 6, в). В тех участках канала, которые выступают за пределы цитоплазматической и клеточной поверхностей, пора имеет ширину 20 Â, но в пределах двойного липидного слоя она сужается. Вблизи центра двойного липидного слоя располагается кольцо объемных гидрофобных боковых цепей лейцина из спиралей М2, расположенных так близко друг к другу, что они не позволяют ионам проходить через канал (рис. 12-27, г). Аллостерические изменения конформации, индуцированные присоединением ацетилхолина к двум α-субъединицам, сопровождаются небольшим поворотом спиралей М2, в результате чего эти гидрофобные остатки удаляются от центра канала, открывая канал для прохождения ионов.
Рис. 12-27. Ацетилхолиновый ионный канал, а) Каждая из пяти гомологичных субъединиц (α2βyδ) содержит четыре трансмембранные спирали (от М1 до М4). Спираль М2 амфифильна, другие содержат в основном гидрофобные аминокислотные остатки, б) Пять субъединиц окружают центральный трансмембранный канал, образованный полярными остатками спиралей М2. В верхней и в нижней частях канала располагаются кольца отрицательно заряженных аминокислотных остатков, в) Модель ацетилхолинового рецептора, основанная на данных электронной микроскопии и рентгеноструктурного анализа родственного белка (ацетилхолинсвязывающего белка моллюска), г) Вид сверху на поперечное сечение, проходящее через центр спирали М2: видны боковые цепи пяти остатков лейцина (желтые; по одному из каждой спирали М2), которые направлены внутрь канала, что делает канал слишком узким для прохождения ионов Са2+, Nа+ или К+. Когда оба центра связывания ацетилхолина (по одному на каждой субъединице) оказываются занятыми, происходят конформационные изменения. Спираль М2 слегка поворачивается, и пять остатков лейцина выходят из центра канала, а на их место встают полярные основания меньшего размера (синие). В результате канал открывается, давая проход ионам Са2+, Nа+ или К+.
Нейроны содержат рецепторные каналы, которые отвечают на действие различных нейромедиаторов
Клетки животных, особенно клетки нервной системы, содержат множество ионных каналов, потенциалзависимых и регулируемых химическими лигандами, или каналов, зависящих от потенциала и химических веществ одновременно. Нейромедиаторы 5-гидрокситриптамин (серотонин), глутамат и глицин могут действовать через рецепторные каналы, родственные по структуре рецептору ацетилхолина. Серотонин и глутамат индуцируют открытие катионных (К+, Na+, Са2+) каналов, в то время как глицин открывает Cl -каналы. Катионные и анионные каналы отличаются по аминокислотной последовательности (очень немного) вдоль гидрофильного канала. Катионные каналы содержат в ключевых позициях отрицательно заряженные боковые цепи Glu и Asp. Когда в эксперименте несколько этих кислых остатков заме-
щали основными остатками, катионный канал превращался в анионный.

В зависимости от того, какой ион проходит через канал, лиганд (нейромедиатор) этого канала либо деполяризует, либо гиперполяризует клетку-мишень. Один нейрон обычно принимает вводимую информацию от нескольких (или многих) других нейронов, при этом каждый высвобождает характерный для него нейромедиатор со свойственным ему деполяризующим или гиперполяризующим эффектом. Таким образом, Vm клетки-мишени отражает интегрированный ввод информации от многих нейронов (рис. 12-1, г). Клетка отвечает возникновением потенциала действия, только если интегрированный ввод вызывает суммарную деполяризацию достаточной величины.
Рецепторные каналы для ацетилхолина, глицина, глутамата и y-аминомасляной кислоты (ГАМК) управляются внеклеточными лигандами. Внутриклеточные вторичные мессенджеры, такие как cAMP, cGMP (3',5'-циклический GMP, близкий аналог сАМР), IР3 (инозит-1,4,5- трисфосфат), Са2+ и АТР, регулируют ионные каналы другого типа, которые, как мы увидим в разд. 12.10, участвуют в передаче сигналов от органов чувств — зрительных, обонятельных и вкусовых.
Токсины поражают ионные каналы
Многие мощные токсины, обнаруженные в природе, действуют на ионные каналы. Например, в разд. 11.3 мы упоминали о том, что дендротоксин (яд черной мамбы) блокирует потенциалзависимые калиевые каналы, тетродотоксин (образуемый иглобрюхом) действует на потенциалзависимые натриевые каналы, а кобротоксин нарушает работу ацетилхолиновых рецепторов. Почему в процессе эволюции сложилось так, что именно ионные каналы, а не какие-либо ключевые ферменты энергетического обмена, стали излюбленной мишенью токсинов?
Ионные каналы представляют собой необычайно сильные усилители. Через один- единственный канал за одну секунду проходит около 10 млн ионов. Это означает, что для передачи сигнала необходимо сравнительно небольшое количество белков ионных каналов на один нейрон. Поэтому сравнительно небольшое количество молекул токсина, обладающих высоким сродством к ионному каналу, способны оказать весьма сильное влияние на передачу нервного сигнала в организме. Для достижения эффекта подобной силы посредством влияния на метаболические ферменты, концентрация которых в клетке обычно гораздо выше, чем белков ионных каналов, понадобилось бы значительно большее число молекул токсина.
Краткое содержание раздела 12.6 Регулируемые ионные каналы
■ Ионные каналы, управляемые мембранным потенциалом или химическими лигандами, — главные участники передачи сигналов в нейронах и других клетках.
■ Потенциалзависимые Na+- и К+-каиалы мембран нейронов проводят потенциал действия вдоль аксона в виде волны деполяризации (вход Na+), за которой следует реполяризация (выход К-).
■ Открытие потенциалзависимых каналов происходит в результате того, что трансмембранный пептид, несущий на себе высокую плотность зарядов (благодаря наличию остатков Arg или других заряженных аминокислотных остатков), перемещается в плоскости, перпендикулярной плоскости мембраны.
■ Когда потенциал действия доходит до дистального конца пресинаптического нейрона, он вызывает высвобождение нейромедиатора. Нейромедиатор (например, ацетилхолин) диффундирует к постсинаптическому нейрону (или миоциту при нервно-мышечном сопряжении), связывается со специфическим рецептором на плазматической мембране и вызывает изменения Vm.
■ Ацетилхолиновый рецептор нейронов и миоцитов — химически регулируемый ионный канал; связывание ацетилхолина приводит к конформационным изменениям, в результате которых канал становится доступным для прохождения ионов Nа+ и Са2+.
■ Образуемые многими организмами нейротоксины атакуют ионные каналы нервных клеток, поэтому действуют быстро и являются смертельно опасными.