ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 1. ОСНОВЫ БИОХИМИИ СТРОЕНИЕ И КАТАЛИЗ - 2011
ЧАСТЬ I. СТРОЕНИЕ И КАТАЛИЗ
12. БИОСИГНАЛИЗАЦИЯ
12.10. Сенсорная передача сигнала в процессах зрения, обоняния и вкуса
Восприятие света, запахов и вкусовых ощущений (зрение, обоняние и вкус) у животных осуществляется специализированными сенсорными нейронами, которые используют механизмы передачи сигналов, в своей основе сходные с механизмами, работающими при действии гормонов, нейромедиаторов и ростовых факторов. Первоначальный сенсорный сигнал в большой степени усиливается с помощью механизмов, включающих регулируемые ионные каналы и внутриклеточные вторичные мессенджеры; система адаптируется к продолжительной стимуляции, изменяя свою чувствительность к стимулу (десенситизация); и наконец, сенсорные сигналы от разных рецепторов (на разных входах) интегрируются перед тем, как конечный сигнал поступит в мозг.
Система зрения использует классический механизм GРСR
В глазу позвоночных свет, входящий через зрачок, фокусируется на высокоорганизованном скоплении светочувствительных нейронов (рис. 12-35).
Рис. 12-35. Восприятие света глазом позвоночного.
Хрусталик глаза фокусирует свет на сетчатке, которая состоит из слоев нейронов. Первичные фотосенсорные нейроны — это палочки (желтый цвет), которые отвечают за ночное зрение и зрение с высоким разрешением, и колбочки трех подтипов (розовый цвет), которые обеспечивают цветовое зрение. Палочки и колбочки образуют синапсы с несколькими видами соединительных нейронов, которые передают и интегрируют электрические сигналы. В конце концов эти сигналы проходят через зрительный нерв от нейронов ганглия в мозг.
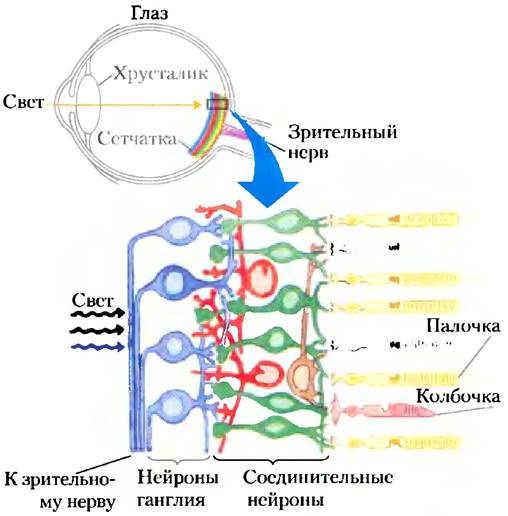
Светочувстительные клетки глаза относятся к двум типам: палочки (около 109 клеток на всю сетчатку), которые воспринимают низкий уровень освещенности, но не могут определять цвега, и колбочки (около 3 • 106 клеток на всю сетчатку), которые менее чувствительны к свету, но могут различать цвета. Оба тина клеток представляют собой длинные, узкие специализированные сенсорные нейроны с двумя отдельными клеточными компартментами: внешний сегмент содержит множество мембранных дисков, нагруженных мембранным белком родопсином, внутренний сегмент содержит ядро и много митохондрий, которые производят АТР, необходимый для передачи зрительного сигнала.
Подобно другим нейронам, на палочках и колбочках возникает трансмембранный электрический потенциал (Vm), обусловленный работой ионного насоса Na+/K+-ATPaзы в плазматической мембране внутреннего сегмента (рис. 12-36). Существенный вклад в мембранный потенциал вносит также ионный канал в наружном сегменте. Он делает возможным перенос либо, либо Са2+ и регулируется (открывается) с помощью сGМР. В темноте палочки содержат достаточное количество сGМР для поддержания канала в открытом состоянии. Мембранный потенциал, таким образом, определяется суммарным транспортом Nа+ и К+ (суммарным изменением их концентрации внутри и снаружи) через внутренний сегмент (поляризацией мембраны) и входом Nа+ через ионные каналы внешнего сегмента (деполяризацией мембраны).
Рис. 12-36. Индуцированная светом гиперполяризация палочек. Палочка состоит из внешнего сегмента, который заполнен стопками мембранных дисков (здесь не показаны), содержащими фоторецептор родопсин, и внутреннего сегмента, в котором находятся ядро и другие органеллы. Колбочки имеют похожую структуру. Во внутреннем сегменте АТР приводит в действие Na+/K+-ATPaзy, которая создает трансмембранный электрический потенциал, выкачивая наружу 3 Na+ на каждые 2 К+, закачиваемые внутрь. Мембранный потенциал уменьшается из-за потока Na+ и Са2+, поступающих в клетку через cGMP-регули- руемые катионные каналы плазматической мембраны наружного сегмента. Поглощая свет, родопсин запускает процесс деградации cGMP (зеленые точки) в наружном сегменте, что приводит к закрытию катионного канала. В отсутствие входа катионов через этот канал клетка гиперполяризуется. Этот электрический сигнал передается в мозг посредством разных нейронов, показанных на рис. 12-35.
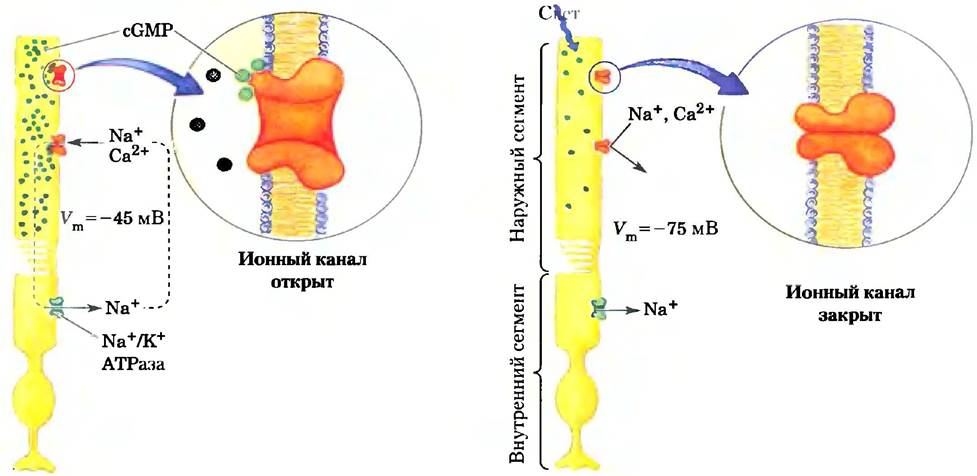
Суть сигнализации в палочках или колбочках сетчатки заключается в происходящем под действием света уменьшении концентрации сGМР, что приводит к закрыванию сGМР-регулируемых ионных каналов. Благодаря работе Nа+/К+-АТРазы плазматическая мембрана становится гиперполяризованной. Палочки и колбочки образуют синапсы с соединительными нейронами (рис. 12-31), которые переносят информацию об электрической активности к нейронам ганглия, находящегося у вну-
тренней поверхности сетчатки. Нейроны ганглия интегрируют информацию на выходе, полученную от многих палочек или колбочек, и отправляют результирующий сигнал через зрительный нерв на зрительную кору головного мозга.
Передача зрительного сигнала начинается, когда свет падает на родопсин, многие тысячи молекул которого находятся в каждом диске наружных сегментов палочек и колбочек. Родопсин (Мr = 40 000) — интегральный белок с характерным строением GPCR, он содержит семь пронизывающих мембрану α-спиралей (рис. 12-37). N-концевой домен родопсина вдается в диск, а С-конец обращен в цитозоль наружного сегмента. Поглощающий свет пигмент (хромофор) 11-цис- ретиналь ковалентно связан с опсином,белковым компонентом родопсина, образуя основание Шиффа с остатком Lys. Ретиналь расположен вблизи середины бислоя (рис. 12-37), его длинная ось ориентирована почти в плоскости мембраны. При поглощении фотона ретиналевым компонентом родопсина энергия света вызывает фотохимические превращения; 11-цис-ретипаль превращается в полностью транс-ретиналь (см. рис. 1-18, б, 10-21). Такое изменение в структуре хромофора вызывает конформационные изменения в молекуле родопсина — это первая стадия проведения зрительного сигнала.
Ретиналь — производное витамина At (ретинола), образующегося из β-каротина (см. рис. 10-21). Недостаток витамина А в пище приводит к куриной слепоте (плохому зрению при слабом уровне освещенности); эта болезнь достаточно широко распространена в некоторых развивающихся странах. Устраняет это заболевание употребление в пищу витамина А или богатых им овощей (таких как морковь). ■
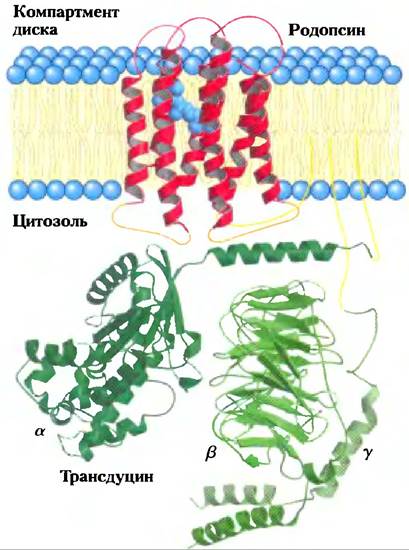
Рис. 12-37. Вероятная структура комплекса родопсина с G-белком трансдуцином (PDB ID 1 ВАС). Родопсин (красный цвет) содержит семь трансмембранных спиралей, встроенных в мембрану диска наружного сегмента палочки, и ориентирован таким образом, что С-конец находится на цитозольной стороне, а N-конец — внутри диска. Хромофор 11-цис-ретиналь (голубой цвет), связанный в виде основания Шиффа с Lys256 седьмой спирали, расположен вблизи центра бислоя. (Это расположение напоминает локализацию адреналинсвязывающего сайта в β-адренергическом рецепторе.) Несколько остатков Ser и Thr вблизи С-конца служат субстратами фосфорилирования, которое является частью механизма десенситизации родопсина. Для цитозольных петель (оранжевый цвет), взаимодействущих с G-белком трансдуцином, пока неизвестна точная локализация. Показано вероятное расположение трех субъединиц трансдуцина (зеленый цвет). Родопсин на С-конце связан с пальмитоилом; как α-, так и y-субъединицы трансдуцина связаны с липидами (желтый цвет), что способствует их заякориванию на мембране.
Возбужденный родопсин осуществляет передачу сигнала через G-белок для уменьшения концентрации cGMP
Родопсин в конформации возбужденного состояния взаимодействует со вторым белком трансдуцином, который находится вблизи на цитоплазматической поверхности мембраны диска (рис. 12-37). Трансдуцин (Т) принадлежит к тому же семейству гетеротримерных GTP- связывающих белков, что и Gsи Gi. Хотя он предназначен специально для передачи зрительных сигналов, трансдуцин имеет много общих функциональных свойств с Gsи Gi. Он может связываться либо с GDP, либо с GTP. В темноте GDP находится в связанном состоянии, все три субъединицы белка (Тα, Тβ, TY) остаются вместе и никакого сигнала не посылается. Когда родопсин возбуждается светом, он взаимодействует с трансдуцином, катализируя замещение связанного GDP на GTP из цитозоля (рис. 12-38, стадии (1) и (2)). Затем рансдуцин диссоциирует на Тα и Тβy, a Tα-GTP передает сигнал от возбужденного рецептора на следующий компонент системы сигнализации — GMP-фосфодиэстеразу (PDE); этот фермент превращает cGMP в 5'-GMP(стадии (3) и (4)). Отметим, что это вовсе не та фосфодиэстераза циклических нуклеотидов, которая гидролизует сАМР, чтобы завершить β-адренергический ответ. сGМР-специфичная РDЕ — уникальный фермент зрительных клеток сетчатки.
Рис. 12-38. Молекулярные «последствия» поглощения фотона родопсином в наружном сегменте палочки. Вверху (стадии (1)-(5)) — возбуждение; внизу (стадии (6)-(9)) — восстановление и адаптацию после освещения.
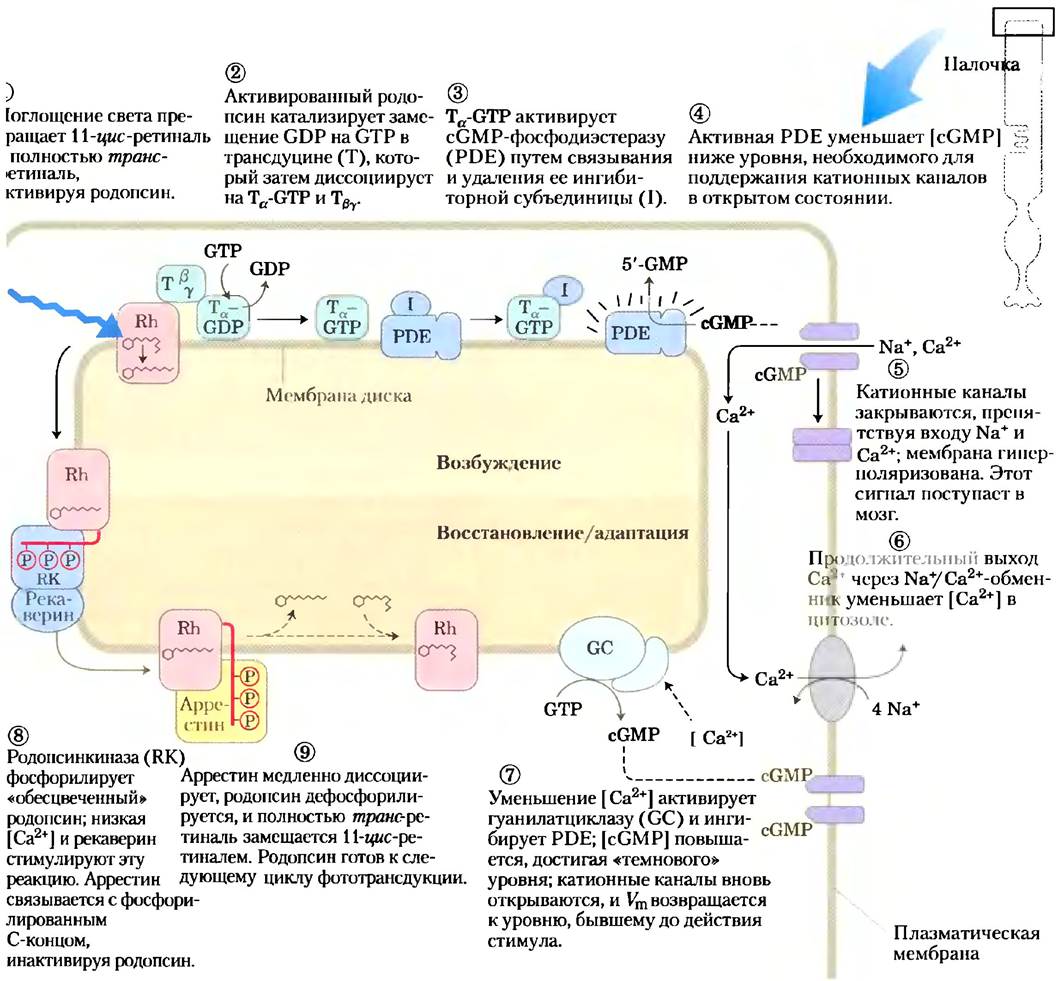
РDЕ представляет собой интегральный белок с активным центром на цитоплазматической стороне мембраны диска. В темноте прочно связанная ингибиторная субъединица очень эффективно подавляет активность РDЕ. Когда Тα-GТР соударяется с РDЕ, ингибиторная субъединица отделяется, и ферментативная активность немедленно возрастает на несколько порядков. Каждая молекула активной РDЕ разрушает множество молекул сGМР с образованием биологически неактивного 5'-GМР. При этом концентрация сGМР в наружном сегменте понижается за доли секунды. При новой, более низкой концентрации сGМР сGМР-регулируемые ионные каналы закрываются, блокируя обратный вход Nа+и Са2+ в наружный сегмент и вызывая гиперполяризацию мембраны клетки палочки или колбочки (стадия (5)). В этом процессе первоначальный стимул — фотон — изменяет Vm клетки.
За несколько стадий процесса передачи зрительного сигнала происходит огромное его усиление. Каждая возбужденная молекула родопсина активирует по крайней мере 500 молекул трансдуцина, каждая из которых может активировать молекулу РDЕ. Этой фосфодиэстеразе свойственно поразительно высокое число оборотов — каждая активированная молекула гидролизует 4 200 молекул сGМР в секунду. Связывание сGМР с сGМР-регулируемыми ионными каналами является кооперативным процессом (по крайней мере, три молекулы сGМР должны присоединиться, чтобы открыть один канал), и относительно небольшое изменение в концентрации сGМР проявляется, таким образом, в большом изменении ионной проводимости. Результатом этого усиления является высокая чувствительность к свету. Поглощение одного фотона закрывает 1000 или более ионных каналов и примерно на 1 мВ изменяет мембранный потенциал клетки.
Зрительный сигнал быстро прекращается
Ваш взгляд движется по этой строке и изображения первых слов быстро исчезают — еще прежде, чем вы увидите следующие слова. В этот короткий интервал времени происходит множество биохимических процессов. Очень скоро после прекращения освещения палочек или колбочек фоточувствительная система выключается. α-Субъединица трансдуцина (с присоединенным GТР) обладает GТРазной активностью. В течение миллисекунд после уменьшения интенсивности света GТР гидролизуется и Тα реассоциирует с Тβy. Ингибиторная субъединица РDЕ, которая была связана с Тα-GТР, высвобождается и реассоциирует с РDЕ, сильно ингибируя этот фермент. Чтобы вернуть концентрацию сGМР к ее «гем-новому» уровню, фермент гуанилатциклаза превращает GTP в cGMP (стадия (7) на рис. 12-38) по реакции, которая ингибируется высокой концентрацией Са2+(>100 нМ). При освещении уровень кальция падает, поскольку стационарная концентрация Са2+ в наружном сегменте создается в результате выкачивания Са2+ с помощью Nа+/Са2+-обменпика плазматической мембраны и движения Са2+ внутрь через открытые cGMP- регулируемые каналы. В темноте этот процесс обеспечивает [Са2+] » 500 нМ, что достаточно, чтобы ингибировать синтез cGMP. После короткого освещения вход Са2+ замедляется и [Са2+] надает (стадия (6)). Ингибирование гуанилатци- клазы облегчается, и циклаза превращает GTP в cGMP, чтобы возвратить систему в состояние до действия стимула (стадия (7)).
Родопсин тоже подвергается изменениям в ответ на продолжительное освещение. Конформационные изменения, индуцированные поглощением света, приводят к тому, что в С-концевом домене становятся доступными несколько остатков Thr и Ser. Они быстро фосфорилируются родопсинкиназой (стадия (8) на рис. 12-38), по структуре и функции гомологичной β-адренергичсской киназе (βARK), которая десенситизирует β-адренергический рецептор (рис. 12-8). При высокой концентрации ионов кальция Са2+-связывающий белок рековерин ингибирует родонсинкиназу, но ингибирование снимается, когда концентрация Са2+ надает после освещения, как описано выше. Фосфорилировапный С-концевой домен родопсина связывается с белком арресгином 1, что препятствует дальнейшему взаимодействию между активированным родопсином и трансдуцином. Аррестин 1 — близкий гомолог аррестина 2 (βarг; рис. 12-8). Для возвращения молекулы возбужденного родопсина в исходное состояние надо удалить полностью транс-ретиналь, заменив его на 11-цис-ретиналь; на это требуется относительно длительное время (от секунд до минут), после чего родопсин готов к новому раунду возбуждения (стадия (9) на рис. 12-38).
Колбочки специализируются на цветовом зрении
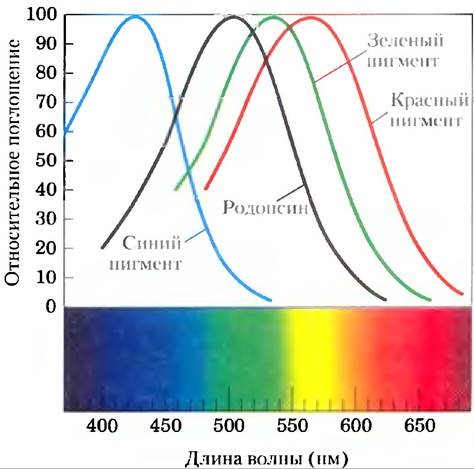
Цветовое зрение колбочек основано на сенсорной передаче сигнала — механизме, идентичном описанному выше, но запускаемом немного отличающимися световыми рецепторами. Три типа колбочек предназначены для регистрации света различных областей спектра, они используют три похожих фоторецепторных белка (опсина). Каждая колбочка экспрессирует только один вид опсина, по все опсипы близки родопсину по размеру аминокислотной последовательности и, по-видимому, по трехмерной структуре. Различия между оисипами, тем не менее, достаточно существенны, чтобы хромофор 11-цис-ретиналь размещался в грех несколько отличающихся компартментах, из- за чего три фоторецептора характеризуются различными спектрами поглощения (рис. 12-39). Мы различаем цвета и оттенки, интегрируя «выход» сигнала с колбочек трех типов, каждый из которых содержит один их трех фоторецепторов.
Рис. 12-39. Спектры поглощения очищенного родопсина и красных, зеленых и синих рецепторов колбочек. Спектры, полученные от отдельных клеток- колбочек, выделенных из трупного материала; пики находятся при 420, 530 и 560 нм, максимум поглощения родопсина — 500 нм. Человеческий глаз позволяет увидеть свет с длиной волны 380-750 нм.
У человека цветовая слепота, например, неспособность отличать красное от зеленого, очень широко распространенный генетически наследуемый признак. Различные виды цветовой слепоты возникают из-за различных мутаций опсина. Одна из форм слепоты обусловлена потерей красных фоторецепторов; имеющие этот дефект люди называются минус-красными дихроматами (они видят только два основных цвета). У других не достает зеленого пигмента, они являются минус-зелеными дихроматами.
Дополнение 12-4. МЕДИЦИНА. Цветовая слепота: эксперимент Джона Дальтона был завершен был завершен после смерти ученого
Химик Джон Дальтон (известный как автор атомной теории) страдал цветовой слепотой. Он считал вероятным, что стекловидное тело его глаз (жидкость, которая заполняет глазное яблоко позади хрусталиков) имело голубую окраску в отличие от бесцветной жидкости в нормальных глазах. Он предложил, чтобы после его смерти его глаза были проанализированы на предмет определения цвета стекловидного тела. Его желание было исполнено. Через день после смерти Дальтона в июле 1844 г. Джозеф Рэнсом извлек сто глаза и обнаружил, что стекловидное тело было абсолютно бесцветным. Как и многие ученые, Рэнсом неохотно выбрасывая образны. Он поместил глаза Дальтона в сосуд с консервантом (рис. 1), где они оставались в течение полутора столетий.
Рис. 1. Глаза Дальтона

И вот в середине 1990-х гг. английские молекулярные биологи взяли образцы сетчатки глаз Дальтона и выделили ДНК. Используя генные последовательности, известные для опсилов красных и зеленых фотопигментов, они амплифицировали соответствующие последовательности (применяя методики, описанные в гл. 9) и определили, что у Дальтона был ген опсина для красного фотопигмента, но не было гена опсина для зеленого фотопигмента. Дальтон был дихроматом, не различавшим зеленый цвет; это заболевание называют дальтонизмом по имени ученого. Так через 150 лет после смерти ученого начатый им эксперимент по проверке гипотезы о причине его цветовой слепоты был, наконец, завершен.
В некоторых случаях присутствуют и красные, и зеленые фоторецепторы, но в них содержатся измененные аминокислотные последовательности, что вызывает сдвиги в их спектре поглощения, приводящие к аномалиям цветного зрения. В зависимости от того, какой пигмент изменен, такие люди являются аномальными трихроматами с дефектами красного или зеленого пигмента. Проверка генов зрительных рецепторов позволила поставить диагноз цветовой слепоты у одного известного «пациента» спустя более чем столетие после его смерти (доп. 12-4)! ■
Обоняние и вкус у позвоночных основаны на сигнальных механизмах, подобных механизмам зрительной системы
Сенсорные клетки, ответственные за восприятие запаха и вкуса, имеют много общего с палочками и колбочками, которые регистрируют свет. Обонятельные нейроны несут ряд длинных тонких жгутиков, простирающихся от одного конца клетки до слизистого слоя, который покрывает клетку. Эти жгутики обеспечивают большую площадь поверхности для взаимодействия с обонятельными сигналами. Рецепторы обонятельных стимулов являются белками мембраны жгутиков с хорошо знакомой структурой GPCR с семью трансмембранными α-спиралями. Обонятельным сигнальным фактором может быть любое из множества соединений, для которых имеются специфические рецепторные белки. Наша способность различать запахи обусловлена наличием сотен разных обонятельных рецепторов на языке и носовых канатах, затем поступающая от рецепторов информация интегрируется в головном мозге для того, чтобы распознать общую картину; при этом набор запахов, которые мы способны различать, значительно превосходит число рецепторов.
Обонятельный стимул поступает в сенсорные клетки путем диффузии через воздух. В слизистом слое, покрывающем обонятельные нейроны, молекула пахучего вещества (одоранта) связывается непосредственно с обонятельным рецептором или со специфическим связывающим белком, который переносит одорант к рецептору (рис. 12-40). Взаимодействие между одорантом и рецептором приводит к изменению конформации рецептора, результатом чего является замещение связанного GDP на GTP на G-белке Golf, аналогов трансдуцина и Gs β-адренергической системы. Затем активированный Gоlf активирует аденилатциклазу жгутиковой мембраны, которая синтезирует сАМР из АТР, и локальная концентрация сАМР повышается. сАМР-регулируемые Na+ - и Са2+- каналы мембраны открываются, а вход Na+ и Са2+ вызывает небольшую деполяризацию, называемую рецепторным потенциалом. Если на рецептор попадает достаточное число молекул одоранта, то рецепторный потенциал достаточно силен, чтобы возбудить в нейроне потенциал действия. Он передается в мозг в несколько стадий и регистрируется как специфический запах. Все эти события происходят за время от 100 до 200 мс.
Рис. 12-40. Молекулярный уровень восприятия запахов. Эти взаимодействия происходят в жгутиках обонятельных рецепторных клеток.
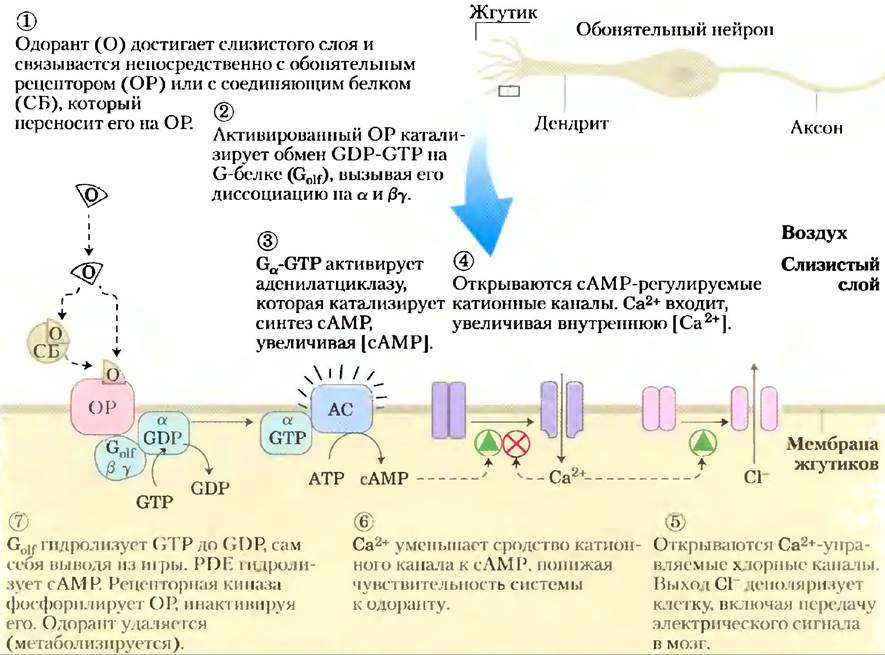
Когда обонятельный стимул перестает действовать, передающая сигнал система отключает сама себя различными способами. сАМР-зависимая фосфодиэстераза возвращает концентрацию сАМР к тому уровню, который был до действия стимула. Golfгидролизует связанный GTP до GDP, тем самым самоинактивируясь. Фосфорилирование рецептора специфической киназой препятствует его взаимодействию с Golf по механизму, аналогичному тому, который реализуется при десенситизации β-адренергического рецептора и родопсина. И наконец, некоторые одоранты ферментативно разрушаются под действием оксидаз.
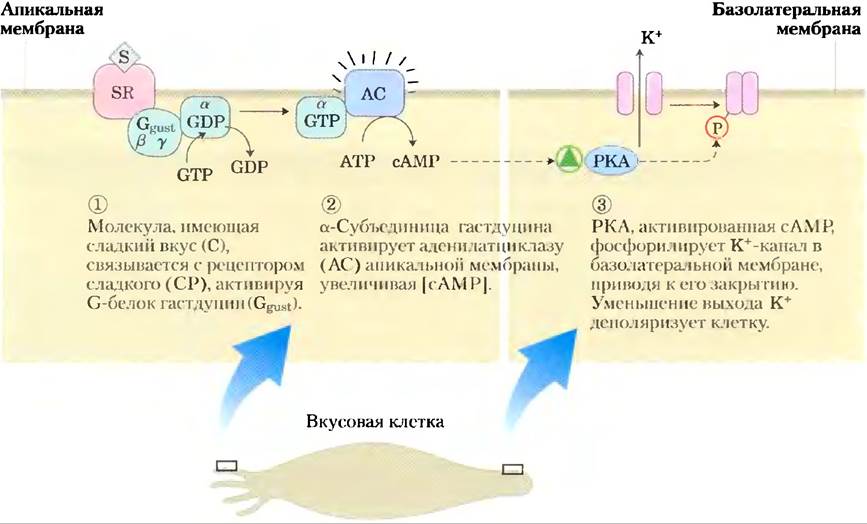
Ощущение вкуса у позвоночных обусловлено деятельностью вкусовых нейронов, сгруппированных во вкусовых сосочках на поверхности языка. В этих сенсорных нейронах сернентиновые рецепторы сопряжены с гетеротримерным G-белком гастдуцином (очень похожим на транс- дуцин в палочках и колбочках). Молекулы со сладким вкусом — те, которые связываются с рецепторами на «сладких» вкусовых сосочках. Когда такая молекула связывается с рецептором, гастдуцин активируется путем замещения, связанного GDP на GTP и затем стимулирует образование сАМР аденилатциклазой. Происходящее вследствие этого увеличение концентрации сАМР активирует РКА, которая фосфорилирует К+-каналы в плазматической мембране, заставляя их закрываться. Уменьшение выхода ионов К+ деполяризует мембрану (рис. 12-41). Другие вкусовые сосочки специализируются на ощущении горьких, кислых или соленых веществ, в механизме передачи сигнала при этом используются различные комбинации вторичных мессенджеров и ионных каналов.
Рис. 12-41. Механизм передачи вкусового сигнала от сладких веществ.
GPCR сенсорных систем и гормональной сигнализации имеют общие свойства
Мы рассмотрели четыре системы передачи сигналов (гормональная сигнализация, зрение, обоняние, вкус), в которых мембранные рецепторы посредством G-белки сопрягаются с ферментами, генерирующими вторичные мессенджеры. Очевидно, что сигнальные механизмы возникли на ранних стадиях эволюции; при исследованиях геномов было обнаружено несколько сотен генов, кодирующих GPCR у позвоночных, членистоногих (у дрозофилы и комара) и круглого червя Caenorhabditis elegans. Даже обычные пивные дрожжи р. Saccaromyces используют GPCR и G-белки для обнаружения объекта для спаривания. Основные структуры стали консервативными, а модификации дали новым организмам способность реагировать на множество стимулов (табл. 12-8). Из приблизительно 29 000 генов в геноме человека 1000 кодируют GPCR, включая сотни рецепторов к обонятельным стимулам, а также «сиротские» рецепторы, для которых природные лиганды пока неизвестны.
Таблица 12-8. Некоторые вещества, передающие сигнал через GPCR

Все хорошо изученные системы передачи сигнала, которые действуют посредством гетеротримерных G-белков, имеют некоторые общие особенности (рис. 12-42). Рецепторы содержат семь трансмембранных сегментов, домен (обычно петля между спиралями 6 и 7), взаимодействующий с G-белком, и цитоплазматический домен на С-конце, который подвергается обратимому фосфорилированию по нескольким остатками Ser и Thr. Лигандсвязывающий сайт (или световой рецептор) погружен глубоко в мембрану и включает в себя остатки из нескольких трансмембранных сегментов. Связывание лиганда (или поглощение света) индуцирует конформационное изменение в рецепторе, при этом открывается домен, который может взаимодействовать с G-белком. Гетеротримерные G-белки активируют или ингибируют эффекторные ферменты (аденилатциклазу, PDE или PLC), которые изменяют концентрацию вторичного мессенджера (cAMP, cGMP, IP3 или Са2+). В гормончувствительных системах конечным результатом является активация протеипнкиназы, которая регулирует какой-либо клеточный процесс путем фосфорилирования ключевого для этого процесса белка. В сенсорных нейронах другой результат — изменение мембранного потенциала и последующий электрический сигнал, который проходит к другому нейрону на пути, связывающем сенсорную клетку с головным мозгом.
Рис. 12-42. Общие свойства сигнальных систем, отвечающих на гормоны, свет, запахи и вкусы. GPCR обеспечивают специфичность сигнала, а их взаимодействие с G-белками обеспечивает его усиление. Гетеротримерные G-белки активируют эффекторные ферменты: аденилатциклазу (АС), фосфолипазу С (PLC) и фосфодиэстеразы (PDE), разлагающие сАМР или cGMP. Изменения концентрации вторичных мессенджеров (сАМР, cGMP, IР3) приводят к изменениям ферментативной активности при фосфорилировании или к изменениям проницаемости (Р) поверхностных мембран для Са2+, Na+и К+. Происходящая в результате деполяризация или гиперполяризация сенсорной клетки (сигнал) передается через соединительные нейроны к сенсорным центрам в головном мозге. В наиболее хорошо изученных случаях установлено, что десенситизация включает в себя фосфорилирование рецептора и связывание белка (аррестина), который прерывает взаимодействие рецептора с G-белком. VR — рецептор вазопрессина, β-AR — β-адренергический рецептор. Другие сокращения для рецепторов и G-белков те же, что и ранее.
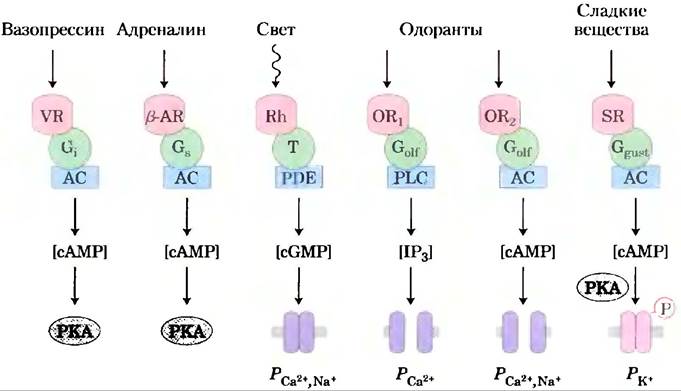
Все эти системы самоинактивируются. Связанный GTP превращается в GDP благодаря присущей G-белкам СТРазной активности, которая часто усиливается активирующими СТРазу белками (GAP — от англ. GTPase-activating proteins) или RGS-белками (англ. regulators of G-protein signaling; см. рис. 12-5). В некоторых случаях эффекторные ферменты, которые являются мишенями G-белковой модуляции, также выполняют функцию GAP. Механизм десенситизации, включающий фосфорилирование С-концовой области после связывания аррестина, очень распространен, а, может быть, и универсален.
Краткое содержание раздела 12.10 Сенсорная передача сигнала в процессах зрения, обоняния и вкуса
■ Зрение, обоняние и вкус у позвоночных обеспечиваются GPCR, использующими гетеротримерные G-белки для изменения мембранного потенциала Vm сенсорного нейрона.
■ В палочках и колбочках сетчатки свет активирует родопсин, который стимулирует замену GDP на GTP в G-белке трансдуцине. Свободная α-субъединица трансдуцина активирует cGMP-фосфодиэстеразу, которая понижает концентрацию cGMP и вследствие этого закрывает cGMP-зависимые ионные каналы в наружном сегменте нейрона. Происходящая в результате этого гиперполяризация палочки или колбочки передает сигнал на следующий нейрон сигнального пути и, в конечном итоге, в головной мозг.
■ В обонятельных нейронах стимулы запускают, действуя через GРСR и G-белки, либо увеличение концентрации сАМР (активируя аденилатциклазу), либо увеличение содержания Са2+ (путем активации фосфолипазы С). Эти вторичные мессенджеры действуют на ионные каналы и соответственно на Vm.
■ Вкусовые нейроны содержат GРСR, которые реагируют на вкусовые вещества путем изменения концентрации сАМР, что в свою очередь изменяет Vm, регулируя (открывая или закрывая) ионные каналы.
■ У разных видов наблюдается высокая степень консервативности в наборе сигнальных белков и механизмах передачи сигналов.