Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Гликолиз - центральный путь катаболизма глюкозы
Первая стадия гликолиза завершается расщеплением углеродного скелета глюкозы
На рис. 15-3 показаны отдельные ферментативные этапы первой стадии гликолиза и структурные формулы соответствующих соединений. Из этой схемы, дополняющей рис. 15-2, видно, каким образом шестиуглеродная цепь глюкозы расщепляется на две молекулы трехуглеродного соединения глиперальдегидфосфата.
а. Фосфорилирование глюкозы
На этом первом этапе молекула D-глюкозы активируется для участия в последующих реакциях путем фосфорилирования за счет АТР в положении 6 с образованием глюкозо-6-фосфата (рис. 15-3). Эта реакция, которая в условиях клетки протекает необратимо, катализируется ферментом гексокиназой

Гексокиназа присутствует почти во всех клетках-животных, растительных и бактериальных. Она катализирует фосфорилирование не только D-глюкозы, но и некоторых других обычных гексоз, например D-фруктозы и D-маннозы. Гексокиназу удалось выделить из дрожжевых клеток в кристаллическом виде, и ее трехмерная структура была детально изучена методом рентгеноструктурного анализа. Связывание гексокиназы с гексозой происходит по типу индуцированного соответствия: молекула фермента претерпевает при этом глубокое конформационное изменение (см. рис. 12 и 13 к дополнению 9-4). Для проявления активности гексокиназе необходимы ионы Mg2+, поскольку истинным субстратом для этого фермента служит не АТР -, а комплекс MgATP2- (разд. 14.8).
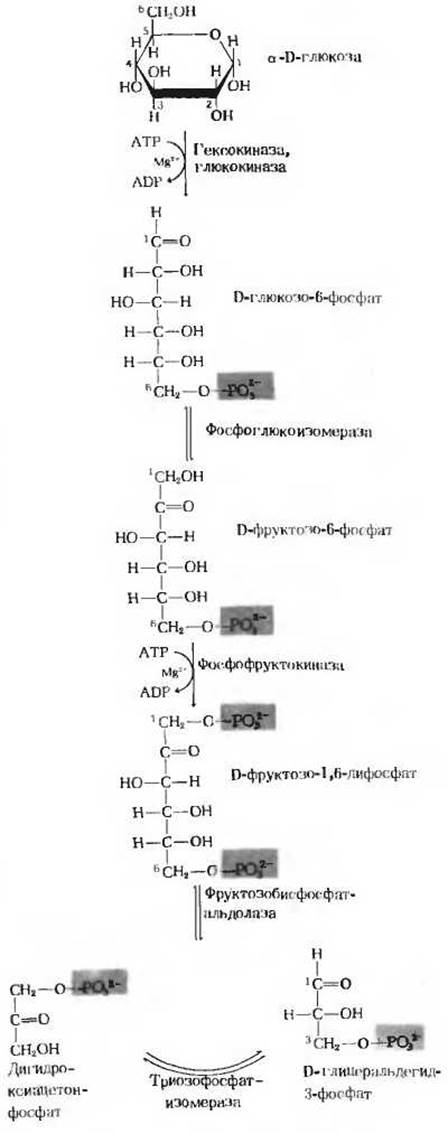
Рис. 15-3. Последовательность реакций, составляющих первую стадию гликолиза. Названия ферментов выделены красным. Цифры указывают положение атомов углерода. Глюкозо-6-фосфат, фруктозо-6-фосфат и фруктозо-1,6-дифосфат представлены здесь для простоты в виде структур с открытой цепью, хотя в действительности они существуют в клетке в виде а-аномерных форм с замкнутым кольцом.
У разных организмов и в разных тканях гексокиназа представлена различными изоформами (разд. 9.23). Хотя все эти изоформы катализируют одну и ту же реакцию (рис. 15-3), они различаются между собой по своим кинетическим свойствам. Гексокиназа мышечных клеток характеризуется, например, низкой величиной КМ для глюкозы (около 0,1 мМ), поэтому она фосфорилирует глюкозу крови (4-5 мМ) с максимальной скоростью. Мышечная гексокиназа резко ингибируется продуктом катализируемой ею реакции - глюкозо-6-фосфатом. Это обстоятельство наряду с некоторыми другими данными позволило сделать вывод, что гексокиназа выполняет в мышцах функцию регуляторного фермента. Глюкозо-6-фосфат является при этом одновременно и продуктом реакции, и аллостерическим ингибитором. Когда концентрация глюкозо-6-фосфата в клетке поднимается выше нормального уровня, он временно и обратимо ингибирует гексокиназу, так что скорость его образования приводится в соответствие со скоростью утилизации.
В печени присутствует другая форма фермента, получившая название глюкокиназы, которая не обнаружена в других тканях. Глюкокиназа отличается от изоферментов группы гексокиназы тремя особенностями: во-первых, она специфична только в отношении D-глюкозы и не действует на другие гексозы; во-вторых, глюкозо-6-фосфат не является для нее ингибитором и, наконец, в-третьих, она характеризуется гораздо более высокой по сравнению с гексокиназой величиной КМ для глюкозы (около 10 мМ). Глюкокиназа печени вступает в действие только тогда, когда концентрация глюкозы в крови заметно возрастает, как это бывает, например, после приема пищи, богатой углеводами. В этих условиях глюкокиназа действует на избыточную глюкозу крови и переводит ее в глюкозо-6-фосфат для отложения в запас в виде гликогена печени. У больных сахарным диабетом количество глюкокиназы снижено, и это имеет для организма очень серьезные последствия. При сахарном диабете поджелудочная железа не вырабатывает достаточного количества инсулина (гл. 25); уровень глюкозы в крови в связи с этим сильно повышен, а в печени из-за недостаточности глюкокиназы образуется мало гликогена.
б. Превращение глюкозо-6-фосфата во фруктозо-6-фосфат
Фермент фосфоглюкоизомераза (его удалось выделить в высокоочищенном виде из мышечной ткани) катализирует обратимую реакцию изомеризации (рис. 15-3), в результате которой глюкозо-6-фосфат (альдоза) превращается во фруктозо-6-фосфат (кетозу). Карбонильная группа перемещается при этом из положения 1 в положение 2:
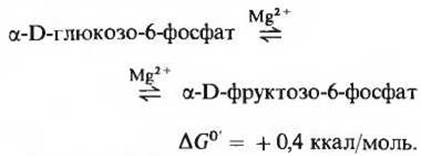
Поскольку эта реакция сопровождается относительно небольшим изменением стандартной свободной энергии, она легко протекает в обоих направлениях. Фосфоглюкоизомераза нуждается в ионах Mg2+ и обладает специфичностью в отношении глюкозо-6-фосфата и фруктозо-6-фосфата.
ч. Фосфорилирование фруктозо-6-фосфата с образованием фруктозо-1,6-дифосфата
Это вторая из двух «пусковых» реакций гликолиза. Фосфофруктокиназа (рис. 15-3), которой для проявления активности требуются ионы Mg2+, катализирует перенос фосфатной группы от АТР в положение 1 D-фруктозо-6-фосфата, в результате чего образуется фруктозо-1,6-дифосфат:
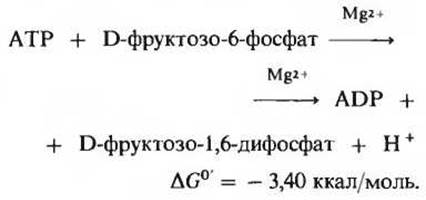
В условиях клетки эта реакция практически необратима.
Фосфофруктокиназная реакция-второй важный «контрольный пункт» гликолиза. Подобно гексокиназе, фосфофруктокиназа представляет собой регуляторный фермент (гл. 9); среди известных регуляторных ферментов это один из наиболее сложных. Фосфофруктокиназа - главный регуляторный фермент гликолиза в мышцах. Всякий раз, когда в клетке начинает иссякать запас АТР или же накапливается избыток продуктов его распада, т.е. ADP и АМР (особенно АМР), активность фосфофруктокиназы возрастает. И, напротив, фосфофруктокиназа ингибируется, когда в клетке оказывается достаточно АТР и другого клеточного «топлива», например цитрата или жирных кислот. О регуляторном действии фосфофруктокиназы мы еще будем говорить ниже.
г. Расщепление фруктозо-1,6-дифосфата
Эта реакция катализируется ферментом, который называется фруктозодифосфатальдолазой или просто альдолазой. Фермент легко может быть выделен в кристаллическом виде из экстрактов мышц кролика. Катализируемая альдолазой реакция представляет собой обратимую альдольную конденсацию (рис 15-3). Фруктозо-1,6-дифосфат обратимо расщепляется с образованием двух триозофосфатов: глицералъдегид-3-фосфата (альдозы) и дигидроксиацетонфосфата (кетозы):
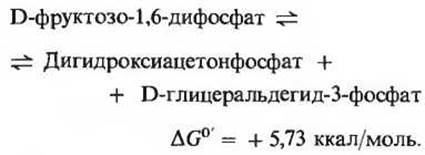
Альдолаза животных тканей не требует ионов Mg2+, но у многих микроорганизмов этот фермент содержит ионы Zn2+. Хотя ∆G0' альдолазной реакции выражается большой положительной величиной, при внутриклеточных значениях pH и концентрации эта реакция может легко идти как в том, так и в другом направлении. Продукты прямой реакции быстро удаляются (вовлекаются в дальнейшие превращения).
д. Взаимопревращения триозофосфатов
Из двух триозофосфатов, образующихся в альдолазной реакции, только один, а именно глицеральдегид-3-фосфат способен подвергаться расщеплению в последующих реакциях гликолиза. Однако дигидроксиацетонфосфат может легко и обратимо превращаться в глицеральдегид-3-фосфат под действием пятого фермента гликолитического пути триозофосфатизомеразы (рис. 15-3)
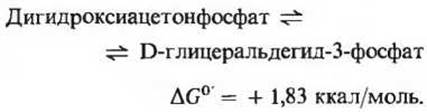
Отметим, что в результате этой реакции 1-й, 2-й и 3-й углеродные атомы исходной глюкозы становятся неотличимыми соответственно от 6-го, 5-го и 4-го атомов (рис. 15-4).
Этой реакцией завершается первая стадия гликолиза. Таким образом, на первой стадии гликолиза молекула гексозы фосфорилируется по положениям 1 и 6, а затем расщепляется с образованием в конечном счете двух молекул глицеральдегид-3-фосфата. Ниже мы увидим, что и другие гексозы, например D-фруктоза, D-манноза и D-галактоза, также могут превращаться в глицеральдегид-3-фосфат.