Основы биохимии Том 2 - А. Ленинджер 1985
Биоэнергетика и метаболизм
Гликолиз - центральный путь катаболизма глюкозы
На второй стадии гликолиза запасается энергия
Вторая стадия гликолиза (см. последовательность реакций на рис. 15-5) включает реакции фосфорилирования, в ходе которых свободная энергия, содержавшаяся в исходной молекуле глюкозы, высвобождается и запасается в форме АТР. Поскольку из одной молекулы глюкозы образуются две молекулы глицеральдегид-3-фосфата, обе половины молекулы глюкозы на второй стадии гликолиза вовлекаются в одни и те же реакции. Превращение двух молекул глицеральдегид-3-фосфата в две молекулы пирувата сопровождается образованием четырех молекул ATP из ADP. Однако суммарный выход ATP на одну расщепленную молекулу глюкозы равен всего лишь двум молекулам, поскольку на первой стадии гликолиза две молекулы ATP расходуются на фосфорилирование молекулы гексозы в положениях 1 и 6.
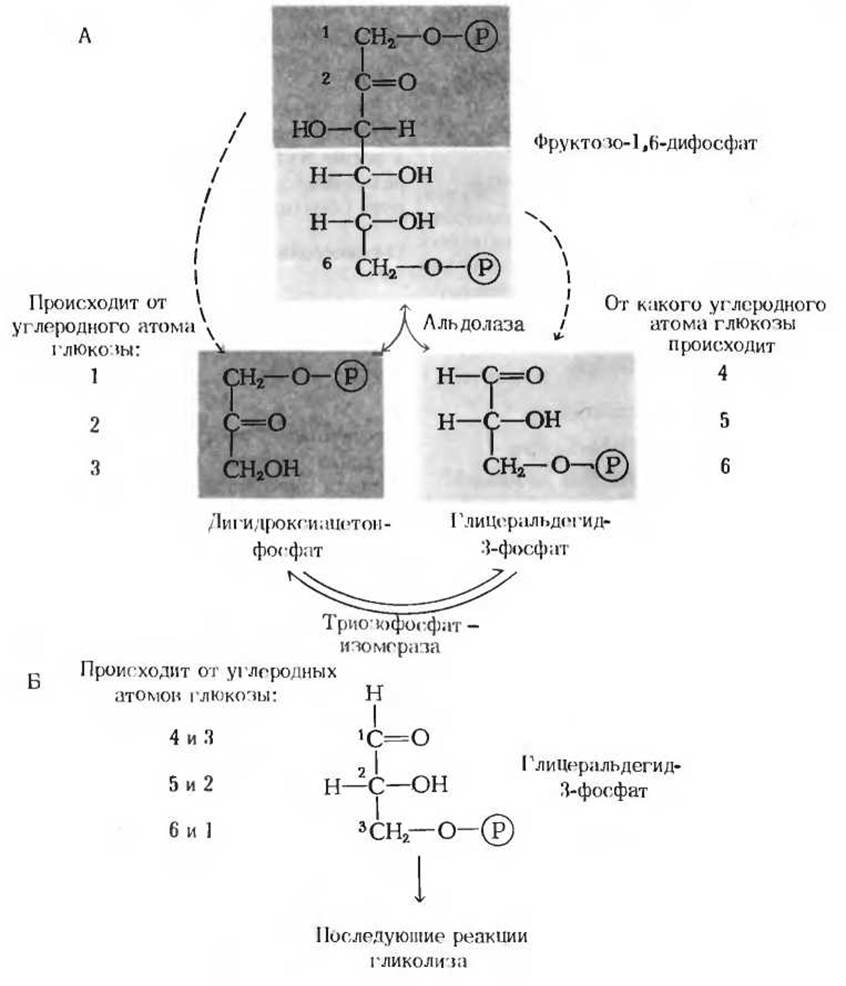
Рис. 15-4. Судьба атомов углерода глюкозы при образовании глицеральдегид-3-фосфата.
А. Альдолазная и триозофосфатизомеразная реакции. Б. В результате триозофосфатизомеразной реакции две половины исходной молекулы глюкозы превращаются в две молекулы глицеральдегид-3-фосфата. Каждый из трех атомов углерода глицеральдегид-3-фосфата ведет свое происхождение от одного из двух атомов глюкозы, как это показано на рисунке. Нумерация атомов углерода глицеральдегид-3-фосфата не совпадает с нумерацией атомов углерода D-глюкозы. Об этом следует помнить при интерпретации результатов экспериментов с D-глюкозой, в которых метку несет только один из ее атомов углерода.
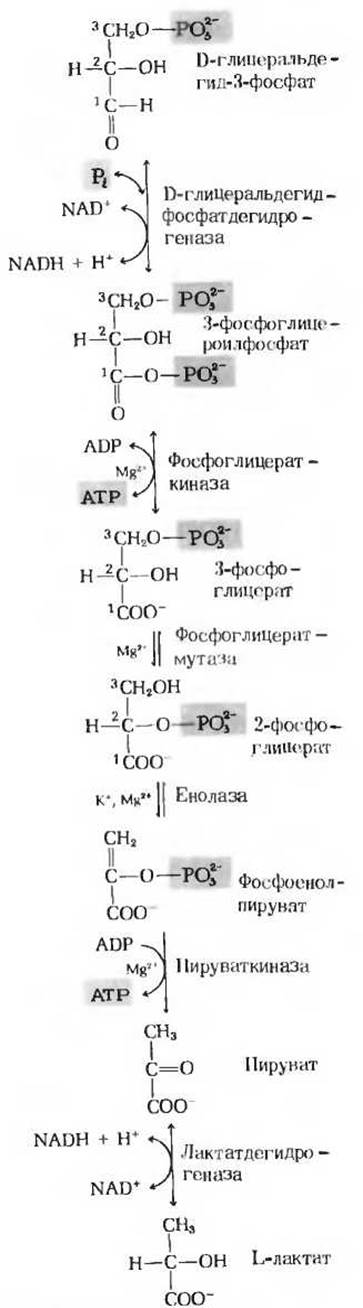
Рис. 15-5. Вторая стадия гликолиза.
и. Окисление глицеральдегид-3-фосфата до 3-фосфоглицероилфосфата
Это первая из двух реакций гликолиза, которые ведут к запасанию энергии в форме АТР (рис. 15-5). Фермент глицеральдегидфосфатдегидрогеназа катализирует обратимую реакцию
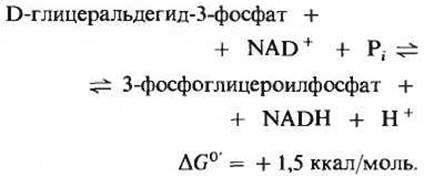
В результате этой сложной реакции альдегидная группа D-глицеральдегид-3-фосфата окисляется, но при этом образуется не карбоновая кислота, как можно было бы ожидать, а смешанный ангидрид фосфорной и 3-фосфоглицериновой кислот - 3-фосфоглицероилфосфат. Такого типа ангидрид, называемый ацилфосфатом, характеризуется очень высоким значением ∆G0' гидролиза (-11,8 ккал/моль), т.е. относится к категории сверхвысокоэнергетических фосфорилированных соединений (разд. 14.9). Для второй фосфатной группы 3-фосфоглицероилфосфата, т. е. для фосфатной группы в положении 3, стандартная свободная энергия гидролиза составляет всего около 3,2 ккал/моль. Таким образом, значительная часть свободной энергии, высвобождающейся при окислении альдегидной группы глицеральдегид-3-фосфата, сохраняется в высокоэнергетической фосфатной группе ацилфосфата (при С-1).
Роль акцептора водорода в глицеральдегидфосфатдегидрогеназной реакции играет кофермент NAD+(рис. 15-6), представляющий собой окисленную форму никотинамидадениндинуклеотида, содержащего витамин никотинамид (разд. 10.6). При переходе NAD+ в восстановленную форму (обозначается NADH; рис. 15-6) от альдегидной группы глицеральдегид-3-фосфата в положение 4 никотинамидного кольца NAD+ переносится ферментативным путем гидрид-ион (:Н-), результатом чего оказывается восстановление в положениях 1 и 4. Второй водородный атом субстрата переходит при этом в среду в виде H+-иона. Уравнение, описывающее ферментативное восстановление NAD+, отражает это обстоятельство:
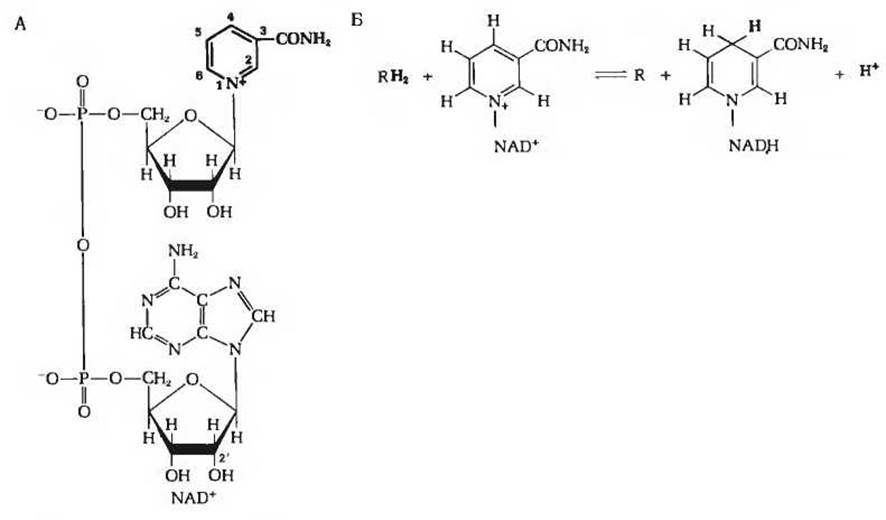
Рис. 15-6. А. Структура никотинамидадениндинуклеотида в окисленной форме (NAD+).
Б. Восстановление NAD+ путем переноса гидрид-иона (:Н-) от субстрата RH2 в положение 4 никотинамидного кольца. См. также рис. 10-7.
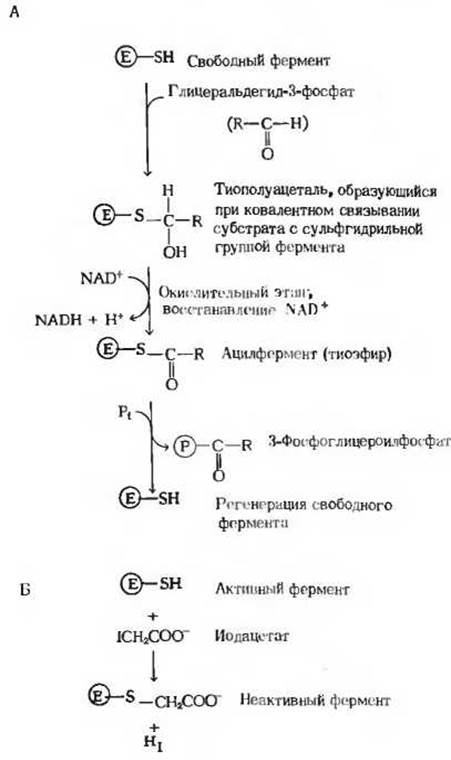
Рис. 15-7. А. Схема, поясняющая механизм действия глицеральдегид-3-фосфатдегидрогеназы. Между субстратом и SH-группой в активном центре фермента возникает ковалентная связь - образуется тиополуацеталь. Этот промежуточный продукт, представляющий собой фермент-субстратный комплекс, окисляется за счет NAD+, который также связан с активным центром фермента; в результате образуется тиоэфир ковалентный промежуточный продукт, называемый ацилферментом. Связь между ацильной группой и тиоловой группой фермента характеризуется очень высокой стандартной свободной энергией гидролиза. На последнем этапе тиоэфирная связь претерпевает фосфоролиз, в результате чего происходит регенерация свободного фермента и образуется ацилфосфат, сохраняющий в себе значительную часть энергии, высвободившейся при окислении альдегидной группы. Б. Иодацетат является мощным ингибитором глицеральдегидфосфатдегидрогеназы, потому что он образует ковалентную связь с важной функциональной SH-группой фермента и таким образом инактивирует фермент.
Механизм действия глицеральдегидфосфатдегидрогеназы довольно сложен (рис. 15.7). Сначала субстрат взаимодействует с SH-группой остатка цистеина, играющего важную роль в активном центре фермента. Затем фермент катализирует перенос гидрид-иона от ковалентно связанного субстрата на NAD+, также прочно связанный с его активным центром. В ходе этого процесса возникает высокоэнергетический ковалентный ацилферментный комплекс. Этот комплекс взаимодействует с неорганическим фосфатом, в результате чего образуется свободный 3-фосфоглицероилфосфат и регенерирует свободный фермент. NADH, образовавшийся в этой реакции, затем снова переходит в окисленную форму (NAD+), так что он может участвовать в расщеплении многих молекул глюкозы до пирувата. Если бы такого реокисления NADH не происходило, то гликолиз быстро прекращался бы из-за исчерпания запаса NAD+, поскольку его количество в клетке невелико.
Глицеральдегидфосфатдегидрогеназа была выделена в кристаллическом виде из скелетных мышц кролика. Ее мол. масса равна 140000. Молекула фермента состоит из четырех идентичных субъединиц. Каждая такая субъединица представляет собой одну полипептидную цепь, содержащую около 330 аминокислотных остатков. Глицеральдегидфосфатдегидрогеназа ингибируется иодацетатом (разд. 9.12), который связывает важную функциональную SH-гpyппy фермента и тем самым лишает его возможности осуществлять катализ (рис. 15-7, Б). Обнаружение того, что иод-ацетат подавляет гликолиз, сыграло важную роль в истории изучения ферментных систем (разд. 13.13).
б. Перенос фосфатной группы от 3-фосфоглицероилфосфата на ADP
Фермент фосфоглицераткиназа катализирует перенос высокоэнергетической фосфатной группы от карбоксильной группы 3-фосфоглицероилфосфата на ADP с образованием АТР и 3-фосфоглицерата:
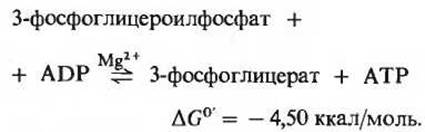
Эта реакция гликолиза вместе с предшествующей реакцией обеспечивает сопряжение энергии. Если написать подряд уравнения этих двух реакций, то сразу видно, что 3-фосфоглицероилфосфат играет здесь роль общего промежуточного продукта. Он образуется в первой реакции, а во второй его высокоэнергетическая фосфатная группа переносится на ADP с образованием АТР:
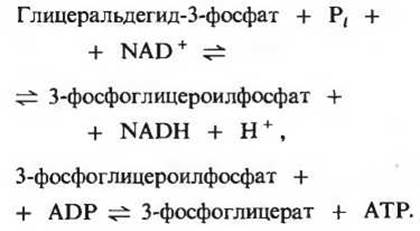
Суммарное уравнение двух этих последовательных реакций, сопряженных друг с другом благодаря наличию общего промежуточного продукта (3-фосфоглицероилфосфата), имеет следующий вид:
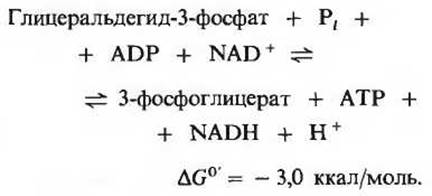
Конечный результат этих двух реакций, обратимых в условиях клетки, заключается в том, что энергия, высвободившаяся при окислении альдегидной группы до карбоксильной, оказывается запасенной благодаря сопряженному образованию АТР из ADP и фосфата. Такое образование АТР, сопряженное с ферментативным превращением одного из «субстратов», т. е. одного из промежуточных продуктов метаболизма, например глицеральдегид-3-фосфата, называют фосфорилированием на уровне субстрата. Ниже мы познакомимся и с другими примерами процессов этого типа.
в. Превращение 3-фосфоглицерата в 2-фосфоглицерат
Фермент фосфоілицератмутаза катализирует обратимую реакцию переноса фосфатной группы из одного положения в другое в пределах молекулы субстрата
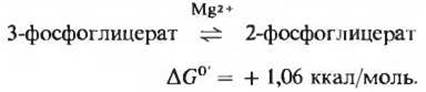
Для этой реакции, в ходе которой фосфатная группа переносится в молекуле глицерата из положения 3 в положение 2 (рис. 15-5), необходим Mg2+. Название мутаза часто используют для обозначения ферментов, катализирующих внутримолекулярные перемещения функциональных групп.
г. Дегидратация 2-фосфоглицерата с образованием фосфоенолпирувата
Это вторая реакция гликолиза, в результате которой образуется высокоэнергетическое фосфорилированное соединение: фермент енолаза катализирует обратимую реакцию отщепления воды от 2-фосфоглицерата с образованием фосфоенолпирувата (рис. 15-5):
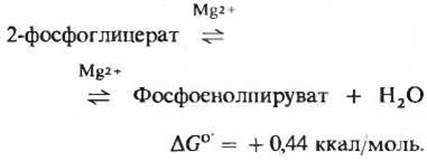
Несмотря на сравнительно небольшое изменение стандартной свободной энергии в ходе данной реакции, величины ∆G0' гидролиза фосфатных групп исходного вещества и продукта различаются очень сильно. Для фосфоглицерата (низкоэнергетического фосфорилированного соединения) эта величина равна приблизительно — 4,2 ккал, а для фосфоенолпирувата (сверхвысокоэнергетического фосфорилированного соединения) она составляет — 14,8 ккал (разд. 14.9). Общее содержание энергии в 2-фосфоглицерате и фосфоенолпирувате почти одинаково, однако отщепление молекулы воды от 2-фосфоглицерата вызывает перераспределение энергии внутри молекулы. Этим перераспределением и объясняется тот факт, что гидролитическое отщепление фосфатной группы от молекулы фосфоенолпирувата сопровождается гораздо большим снижением свободной энергии.
Енолаза (мол. масса 85 000) была получена в кристаллическом виде из нескольких источников. Для проявления ее активности необходимы ионы Mg2+, с которыми фермент образует комплекс, прежде чем присоединить субстрат. Для енолазы характерно ингибирование фторидом (F-) в присутствии фосфата; истинным ингибитором являются при этом ионы фторфосфата, связывающие ионы Mg2+.
д. Перенос фосфатной группы от фосфоенолпирувата на ADP
Последним этапом гликолиза является перенос высокоэнергетической фосфатной группы от фосфоенолпирувата на ADP (рис. 15-5). Эта реакция, катализируемая пируваткиназой, представляет собой еще один пример фосфорилирования на уровне субстрата. Продукт реакции пиру ват образуется в енольной форме:

однако эта енольная форма быстро переходит неферментативным путем в кетоформу, доминирующую при pH 7,0:
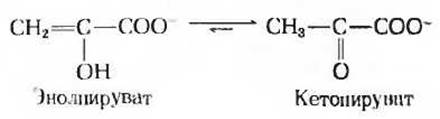
Равновесие этой реакции очень сильно сдвинуто вправо, и это в соответствии с законом действующих масс «тянет» вправо также и предшествующую пиру- ваткиназную реакцию. Суммарное уравнение для пируваткиназной реакции и для неферментативного образования кетопирувата имеет вид

Эта суммарная реакция характеризуется очень большой отрицательной величиной ∆G0', что в значительной мере обусловливается спонтанным превращением енольной формы пирувата в кетоформу. Изменение стандартной свободной энергии при гидролизе фосфоенолпирувата равно — 14,8 ккал/моль. Приблизительно половина этой энергии запасается в форме ATP (∆G0’ = -7,3 ккал/моль), а вторая половина (-7,5 ккал/моль) составляет ту мощную движущую силу, которая резко смещает равновесие реакции вправо. В условиях клетки пируваткиназная реакция практически необратима.
Пируваткиназа была получена в кристаллическом виде (мол. масса 250000). Для проявления ее активности необходимы ионы+, а также Mg2+ или Мn2+. Фермент этот принадлежит к числу важных регуляторных ферментов, и о его действии мы еще будем говорить ниже.
е. Восстановление пирувата до лактата
Важная роль пирувата в катаболизме углеводов определяется тем, что это соединение лежит в точке пересечения различных катаболических путей. При аэробных условиях в животных тканях продуктом гликолиза является пируват, a NADH, образовавшийся в ходе окисления глицеральдегид-3-фосфата, реокисляется (т. е. снова превращается в NAD+) за счет молекулярного кислорода (гл. 17). Иначе обстоит дело в анаэробных условиях, например в напряженно работающих скелетных мышцах или в клетках молочнокислых бактерий. В этих условиях образовавшийся при гликолизе NADH реокисляется не за счет кислорода (который отсутствует), а за счет пирувата восстанавливающегося при этом в лактат. Электроны, перешедшие сначала от глицеральдегид-3-фосфата на NAD+, переносятся в форме NADH на пируват. Восстановление пирувата катализируется ферментом лактатдегидрогеназой, в результате лактатдегидрогеназ- ной реакции образуется L-изомер лактата:
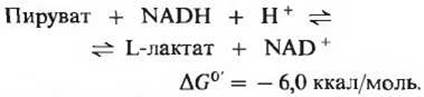
Равновесие этой реакции сильно сдвинуто вправо, о чем свидетельствует большая отрицательная величина ∆G0'. При окислении двух молекул глицеральдегид-3-фосфата, образующихся из каждой молекулы глюкозы, расходуются две молекулы NAD+ и синтезируются две молекулы NADH. Поэтому регенерация двух молекул NAD+ в результате восстановления двух молекул пирувата до лактата означает, что NAD может использоваться в процессе гликолиза многократно.
Мы уже знаем (разд. 9.23), что лактатдегидрогеназа представлена в большей части тканей пятью различными изоформами, отличающимися друг от друга по таким признакам, как величина КМ для пирувата, число оборотов или Vmaх и степень аллостерического ингибирования пируватом. Изофермент, присутствующий в ткани сердца (его обозначают Н4), состоит из четырех идентичных полипептидных цепей, принадлежащих к Н-типу. Он характеризуется низкой величиной КМ для пирувата и сильно выраженной способностью ингибироваться пируватом. Другая изомерная форма этого фермента, содержащаяся в мышечной ткани (ее обозначают М4), характеризуется более высокой величиной КМ для пирувата, не ингибируется пируватом и по своей каталитической активности превосходит изофермент, выделенный из сердца.
Предпринималось немало попыток с целью найти надлежащее объяснение функции и роли изоформ лактатдегидрогеназы в различных тканях, особенно в ткани сердца, скелетных мышцах и печени. Тем не менее в этом вопросе и сейчас еще много противоречий и споров. Роль изоформ лактатдегидрогеназы и двух генов, ответственных за их синтез, остается неясной. Был обнаружен любопытный факт: у одного из обследуемых, 64-летнего мужчины, полностью отсутствовала (вследствие генетического дефекта) лактатдегидрогеназа «сердечного» типа; при этом у него не отмечалось ни нарушений сердечной деятельности, ни каких-либо нарушений метаболизма. Это наводит на мысль, что, быть может, не все клеточные ферменты или не все белки действительно необходимы; возможно, среди них есть и рудиментарные, которые теперь уже не используются.
ж. Полный баланс гликолиза
Мы можем теперь составить полный баланс гликолиза, в котором будут учтены: 1) судьба углеродного скелета глюкозы, 2) путь электронов в окислительновосстановительных реакциях и 3) расход ADP и фосфата в процессе гликолиза и выход АТР в расчете на одну расщепленную молекулу глюкозы. В левой части приведенного ниже уравнения указаны все вещества, используемые в процессе гликолиза, т. е. ATP, Рі, ADP, NAD+, NADH и Н+ (см. рис. 15-4 и 15-5), а в правой части - все продукты гликолиза (напомним, что из каждой молекулы глюкозы образуются две молекулы глицеральдегид-3-фосфата):

Если мы теперь вычеркнем в правой и в левой частях уравнения одни и те же члены, то получим суммарное уравнение анаэробного гликолиза, протекающего в скелетных мышцах в условиях анаэробиоза и при молочнокислом брожении:

В результате этого процесса одна молекула D-глюкозы превращается в две молекулы лактата (путь углерода). Две молекулы ADP и две молекулы фосфата превращаются в две молекулы АТР (путь фосфатных групп). Четыре электрона (в форме двух гидрид-ионов) переносятся с помощью двух молекул NAD+ от двух молекул глицеральдегид-3-фосфата на две молекулы пирувата с образованием двух молекул лактата (путь электронов). Процесс гликолиза включает два окислительно-восстановительных этапа, однако суммарного изменения степени окисления углерода в результате этого процесса не происходит. В этом можно убедиться, сравнив эмпирические формулы глюкозы (С6Н12О6) и молочной кислоты (С3Н6О3). Легко видеть, что соотношение атомов С, Н и О в молекулах двух этих соединений одинаково и, следовательно, превращение глюкозы в молочную кислоту не сопровождается окислением углерода. Тем не менее при анаэробном гликолизе какая-то часть энергии, заключенной в молекуле глюкозы, все же извлекается; этой энергии достаточно для того, чтобы обеспечить суммарный выход двух молекул АТР в расчете на каждую расщепленную молекулу глюкозы.
В аэробных условиях продуктом гликолитического расщепления глюкозы оказывается не лактат, а пируват. В этих условиях NADH, образовавшийся в результате окисления двух молекул глицеральдегид-3-фосфата, вновь окисляется не за счет пирувата. Суммарное уравнение гликолиза в этом случае имеет вид

Две молекулы NADH. образовавшиеся при гликолизе в цитозоле, в аэробных условиях вновь окисляются до NAD+, отдавая свои электроны в цепь переноса электронов, которая в эукариотических клетках находится в митохондриях. Здесь электроны передаются в конечном счете на кислород, восстанавливая его до Н2О:
![]()