Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Окислительное фосфорилирование и транспортные системы митохондрий
Организация дыхательной цепи в митохондриях
Главные компоненты дыхательной цепи (рис. 13.2.) приведены последовательно в порядке возрастания окислительно-восстановительного потенциала в табл. 12.1. Атомы водорода или электроны перемещаются по цепи от более электроотрицательных компонентов к более электроположительному кислороду, изменение окислительно-восстановительного потенциала при переходе от системы NAD+/NADH к системе О2/Н2О составляет 1,1 В.
Главная дыхательная цепь в митохондриях начинается от NAD-зависимых дегидрогеназ, проходит через флавопротеины и цитохромы и заканчивается молекулярным кислородом. Не все субстраты связаны с дыхательной цепью через NAD-зависимые дегидрогеназы; некоторые из них, имеющие относительно высокий окислительно-восстановительный потенциал (например, система фумарат/сукцинат, см. табл. 12.1), связаны с флавопротеиновыми дегидрогеназами, которые в свою очередь связаны с цитохромами дыхательной цепи (рис. 13.3).
В последнее время установлено, что в дыхательной цепи имеется еще один переносчик, связывающий флавопротеины с цитохромом b, обладающим самым низким среди цитохромов окислительно-восстановительным потенциалом. Этот переносчик, названный убихиноном или коферментом Q (рис. 13.4), в аэробных условиях находится в митохондриях в форме окисленного хинона, а в анаэробных условиях — в восстановленной хинольной форме. Кофермент Q является компонентом митохондриальных липидов; среди других липидов преобладают фосфолипиды, являющиеся частью митохондриальной мембраны. Структура кофермента Q сходна со структурой витаминов К и Е. Близкую структуру имеет и пластохинон, находящийся в хлоропластах. Все эти вещества имеют в своей структуре полиизопреноидную боковую цепь. Содержание кофермента Q значительно превосходит содержание других компонентов дыхательной цепи (по параметру стехиометрии); это позволяет предположить, что кофермент Q является подвижным компонентом дыхательной цепи, который получает восстановительные эквиваленты от фиксированных флавопротеиновых комплексов и передает их на цитохромы.
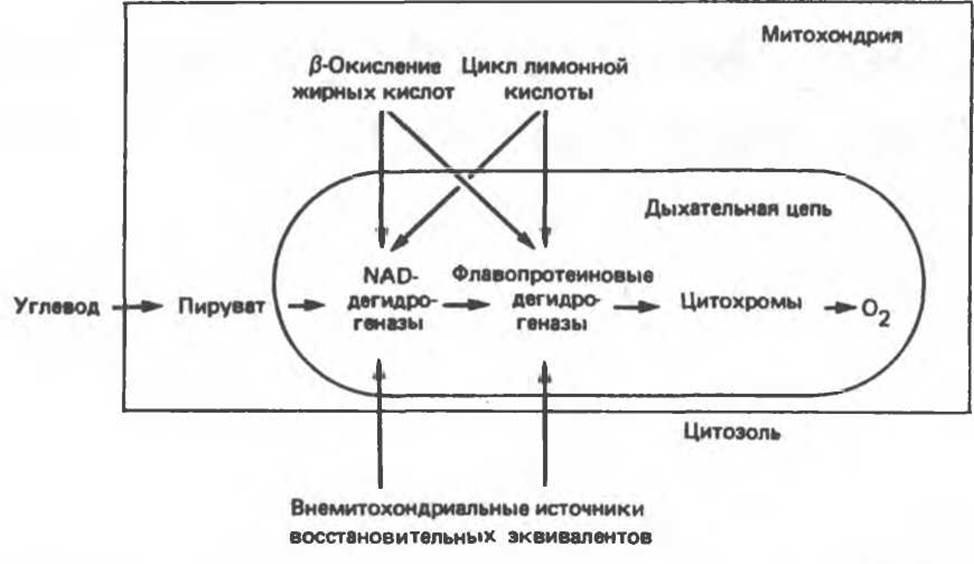
Рис. 13.1. Главные источники восстановительных эквивалентов и их связь с митохондриальной дыхательной цепью. Основным внемитохондриальным источником является NADH, который образуется в ходе гликолиза.
Дополнительным компонентом, находящимся в функционально активных препаратах дыхательной цепи, является железо-серный белок, FeS (негемовое железо). Он ассоциирован с флавопротеинами (металлофлавопротеинами) и с цитохромом b. Железо и сера, как полагают, участвуют в окислительновосстановительном процессе, протекающем по одноэлектронному механизму (рис. 13.5).
Современные представления о последовательности главных компонентов дыхательной цепи отражены на рис. 13.3. На электроотрицательном конце цепи дегидрогеназы катализируют перенос электронов от субстратов на NAD, находящийся в дыхательной цепи. Это происходит по двум путям. В тех случаях, когда субстратами служат а-кетокислоты, пируват и кетоглутарат, в переносе электронов на NAD участвуют сложные дегидрогеназные системы, содержащие липоат и FAD. Перенос электронов другими дегидрогеназами, использующими в качестве субстратов L (+)-3-гидроксиацил-СоA, D(—)-3-гидроксибутират, пролин, глутамат, малат и изоцитрат, происходит прямо на NAD дыхательной цепи.
Восстановленный NADH в дыхательной цепи в свою очередь окисляется металлофлавопротеином NADH-дегидрогеназой. Этот фермент содержит FeS и FMN и прочно связан с дыхательной цепью. Кофермент Q служит коллектором восстановительных эквивалентов, которые поставляются рядом субстратов через флавопротеиновые дегидрогеназы в дыхательную цепь. К числу этих субстратов относятся сукцинат, холин, глицерол-3-фосфат, саркозин, диметилглицин и ацил-СоА (рис. 13.3). Флавиновым компонентом этих дегидрогеназ является, по-видимому, FAD. Поток электронов от кофермента Q далее идет через ряд цитохромов к молекулярному кислороду (рис. 13.3). Цитохромы выстроены в порядке возрастания окислительно-восстановительного потенциала. Терминальный цитохром аа3 (цитохромоксидаза) осуществляет конечную стадию процесса — перенос восстановительных эквивалентов на молекулярный кислород. Как уже упоминалось, эта ферментная система содержит медь — непременный компонент истинных оксидаз. Цитохромоксидаза имеет очень высокое сродство к кислороду, что позволяет дыхательной цепи функционировать с максимальной скоростью до тех пор, пока в ткани не будет практически исчерпан O2. Эта катализируемая цитохромоксидазой реакция является необратимой; она определяет направление движения восстановительных эквивалентов в дыхательной цепи, с которым сопряжено образование АТР.

Рис. 13.2. Транспорт восстановительных эквивалентов по дыхательной цепи.
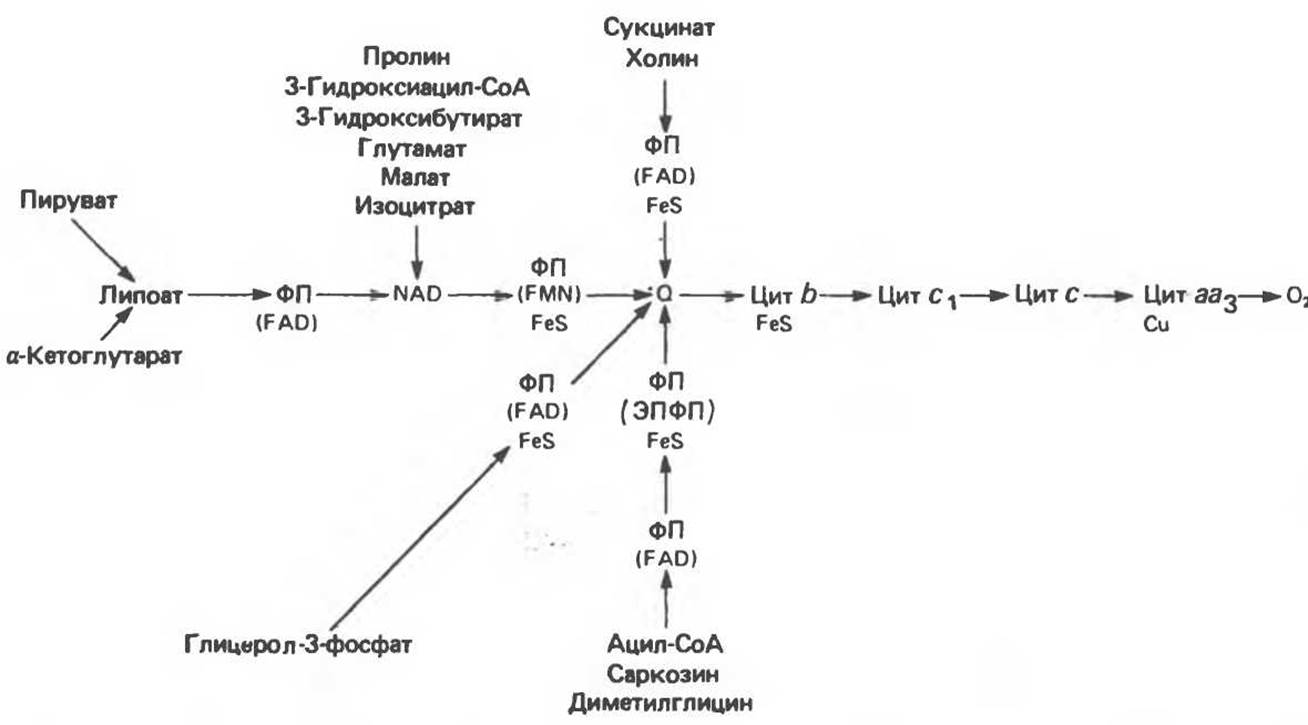
Рис. 13.3. Компоненты дыхательной цепи митохондрий. FeS находится в цепи «на O2-стороне» ФП или Цит b. Цит — цитохром; ЭПФП — электронпереносящий флавопротеин; FeS — железо-серный белок; ФП — флавопротеин; Q — убихинон.
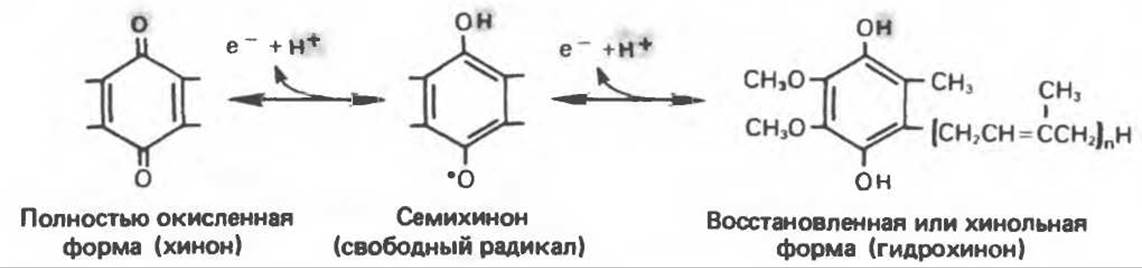
Рис. 13.4. Структура убихинона (Q); п — число изопреноидных звеньев, варьирующее от 6 до 10, т.е. Q
В отношении структурной организации дыхательной цепи был выдвинут ряд предположений. Существенно то, что молярные соотношения между компонентами являются почти постоянными. Функционирующие компоненты дыхательной цепи встроены во внутреннюю митохондриальную мембрану в виде четырех белково-липидных комплексов дыхательной цепи. На этом основании был сделан вывод об определенной пространственной ориентации этих комплексов в мембране. Цитохром с является единственным растворимым цитохромом и наряду с коферментом Q служит относительно мобильным компонентом дыхательной цепи, осуществляющим связь между фиксированными в пространстве комплексами (рис. 13.6).
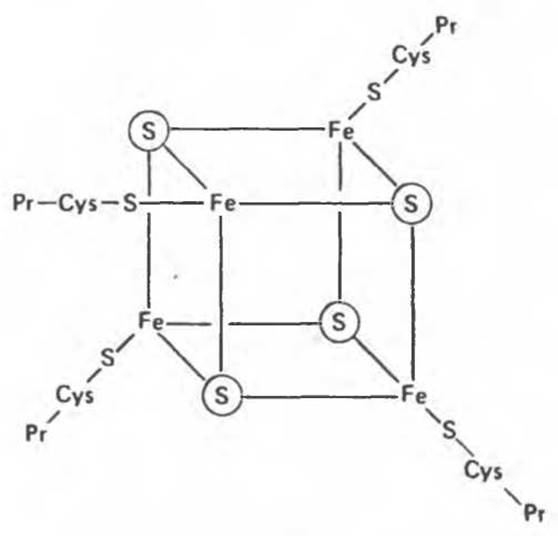
Рис. 13.5. Железо-серный центр (Fe4S4) железо-серного белка. S — кислотолабильная сера; Рr — апобелок; Cys — остаток цистеина. Некоторые железо-серные белки содержат 2 атома железа и 2 атома серы (Fe2S2).

Рис. 13.6. Предполагаемые участки ингибирования (⊝) дыхательной цепи специфическими лекарственными веществами, химическими реагентами и антибиотиками. Указаны участки, где предположительно происходит сопряжение с фосфорилированием. BAL — димеркапрол; TTFA — хелатобразующий реагент на железо. Комплекс I — NADH: убихинон-оксидоредуктаза; комплекс II — сукцинат: убихинон-оксидоредуктаза; комплекс III — убихинол: феррицитохром с-оксидоредуктаза; комплекс IV — ферроцитохром с: кислород-оксидоредуктаза. Другие сокращения — такие же, как и на рис. 13.3.