Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Физиологически важные липиды
Жирные кислоты
Жирные кислоты — это алифатические карбоновые кислоты, получаемые в основном из жиров и масел. В состав природных жиров обычно входят жирные кислоты с четным числом атомов углерода, поскольку они синтезируются из двухуглеродных единиц, образующих неразветвленную цепь углеродных атомов. Цепь может быть насыщенной (не содержащей двойных связей) и ненасыщенной (содержащей одну или более двойных связей).
Номенклатура
Систематическое название жирной кислоты чаще всего образуется путем добавления к названию углеводорода окончания -овая (Женевская номенклатура). Насыщенные кислоты при этом имеют окончание -ановая (например, октановая), а ненасыщенные -еновая (например, октадеценовая — олеиновая кислота). Атомы углерода нумеруются, начиная от карбоксильной группы (содержащей атом углерода 1). Атом углерода, следующий за карбоксильной группой (углерод 2), называют также а-углеродом. Атом углерода 3 — это ß-углерод, а углерод концевой метальной группы (углерод n) — ω-углерод. Для указания числа двойных связей и их положения были приняты различные соглашения, например ∆9 означает, что двойная связь в молекуле жирной кислоты находится между атомами углерода 9 и 10; ω9 — двойная связь между девятым и десятым атомами углерода, если их отсчитывать с ω-конца. Широко используемые названия с указанием числа атомов углерода, числа двойных связей и их положения приведены на рис. 15.1. В жирные кислоты животных организмов в процессе метаболизма могут вводиться дополнительные двойные связи, но всегда между уже имеющейся двойной связью (например ω9, ω6 или ω3) и карбоксильным углеродом; это приводит к разделению жирных кислот на 3 семейства животного происхождения — ω3, ω6 или ω9.
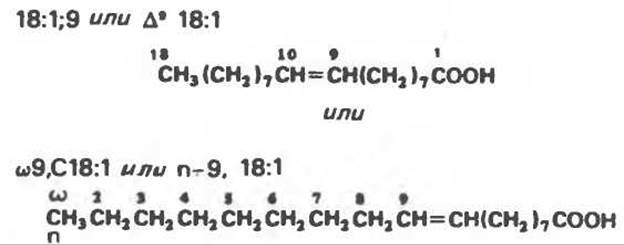
Рис. 15.1. Олеиновая кислота (n — 9; читается: «n минус 9»).
Насыщенные жирные кислоты
Насыщенные жирные кислоты являются членами гомологического ряда, начинающегося с уксусной кислоты. Примеры приведены в табл. 15.1.
Существуют и другие члены ряда, с большим числом углеродных атомов, они встречаются в первую очередь в восках. Было выделено — как из растительных, так и из животных организмов — несколько жирных кислот с разветвленной цепью.
Ненасыщенные жирные кислоты (табл. 15.2)
Их подразделяет в соответствии со степенью ненасыщенности.
A. Мононенасыщенные (моноэтеноидные, моноеновые) кислоты.
Б. Полиненасыщенные (полиэ геноидные, полиеновые) кислоты.
B. Эйкозаноиды. Эти соединения, образующиеся из эйкоза-(20-С)-полиеновых жирных кислот, подразделяются на простаноиды и лейкотриены (ЛТ). Простаноиды включают простагландини (ГІГ), простациклины (ГІГ-І) и тромбоксаны (ТО). Иногда термин простагландини употребляется в менее строгом смысле и означает все простаноиды.
Таблица 15.1. Насыщенные жирные кислоты

1) Строго говоря, не является алкильным производным.
Таблица 15.2. Ненасыщенные жирные кислоты, имеющие физиологическое и пищевое значение
|
Число атомов углерода, число и положение двойных связей |
Ряд |
Название |
Систематическое наименование |
Распространение |
|
Моноеновые кислоты (одна двойная связь) |
||||
|
16 : 1; 9 |
ω 7 |
Пальмитолеиновая |
цис-9-гексадецeновая |
Почти во всех жирах |
|
18 :1; 9 |
ω 9 |
Олеиновая |
цис-9-октадеценовая |
Жирная кислота, которая. по-видимому, наиболее часто встречается в природных жирах |
|
18 : 1; 9 |
ω 9 |
Элаидиновая |
транс-9-октадеценовая |
Жиры жвачных и жиры, подвергнутые гидрогенизации |
|
22 : 1; 13 |
ω 9 |
Эруковая |
цис-13-докозеновая |
Рапсовое и горчичное масло |
|
24: 1; 15 |
ω 9 |
Нервоновая |
цис-15-тетракозеновая |
В цереброзидах |
|
Диеновые кислоты (две двойные связи) |
||||
|
18 : 2; 9, 12 |
ω 6 |
Линолевая |
полностью цис-9, 12-октадекадиеновая |
Пшеница, арахис, семена хлопчатника. соя и многие растительные масла |
|
Триеновые кислоты (три двойные связи) |
||||
|
18 : 3; 6, 9, 12 |
ω 6 |
у-Линоленовая |
полностью цис-6, 9, 12-октадекатриеновая |
Некоторые растения (розовое масло), минорная жирная кислота у животных |
|
18 : 3; 9, 12, 15 |
ω 3 |
а-Линоленовая |
полностью цис-9, 12, 15-октадекатриеновая |
Часто обнаруживается вместе с линолевой кислотой, особенно в льняном масле |
|
Тетраеновые кислоты (четыре двойные связи) |
||||
|
20 : 4; 5, 8, 11, 14 |
ω 6 |
Арахидоновая |
полностью цис-5, 8, 11, 14-эйкозатетраеновая |
Обнаруживается вместе с линолевой кислотой, особенно в арахисовом масле; важный компонент фосфолипидов животных |
|
Пентаеновые кислоты (пять двойных связей) |
||||
|
20 : 5; 5, 8, 11, 14, 17 |
ω 3 |
Тимнодоновая |
полностью цис-5, 8,11, 14, 17-эйкозапентаеновая |
Важный компонент рыбьего жира (из печени трески) |
|
22 : 5; 7, 10, 13, 16, 19 |
ω 3 |
Клупанодоновая |
полностью цис-7, 10, 13, 16, 19-докозапентаеновая |
Рыбий жир, фосфолипиды мозга |
|
Гексаеновые кислоты (шесть двойных связей) |
||||
|
22 : 6; 4, 7, 10, 13, 16, 19 |
ω 3 |
Цервоновая |
полностью цис-4, 7, 10, 13, 16, 19-докозагексаеновая |
Рыбий жир, фосфолипиды мозга |
Простагландини были первоначально обнаружены в семенной жидкости, но затем найдены в составе практически всех тканей млекопитающих; они обладают целым рядом важных физиологических и фармакологических свойств. Они синтезируются in vivo путем циклизации участка в центре углеродной цепи 20-С (эйкозановых) полиненасыщенных жирных кислот (например, арахидоновой кислоты) с образованием циклопентанового кольца (рис. 15.2). Родственная серия соединений, тромбоксаны, обнаруженные в тромбоцитах, содержат циклопентановое кольцо, в которое включен атом кислорода (оксановое кольцо) (рис. 15.3). Три различные эйкозановые жирные кислоты приводят к образованию трех групп эйкозаноидов, различающихся числом двойных связей в боковых цепях — ПГ1, ПГ2 и ПГ3. К кольцу могут быть присоединены различные группы, дающие начало нескольким разным типам простагландинов и тромбоксанов, которые обозначаются А, В и т. д. Например, простагландин Е-типа (ПГ-Е2) содержит кетогруппу в положении 9, тогда как в простагландине F-типа в этом же положении стоит гидроксильная группа. Лейкотриены являются третьей группой эйкозаноидных производных, они образуются не путем циклизации жирных кислот, а в результате действия ферментов липоксигеназного пути (рис. 15.4). Они были впервые найдены в лейкоцитах и характеризуются наличием трех сопряженных двойных связей.

Рис. 15.2. Простагландин Е2 (PG Е2).
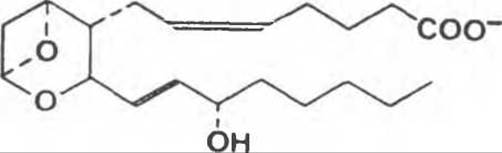
Рис. 15.3. Тромбоксан А2.
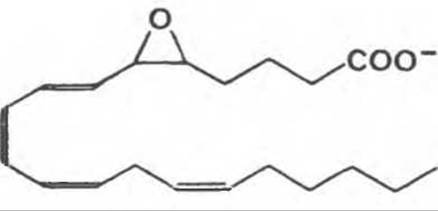
Рис. 15.4. Лейкотриен А4.
Г. Другие ненасыщенные жирные кислоты. В материалах биологического происхождения были найдены и многие другие жирные кислоты, содержащие, в частности, гидроксильные группы (рицинолевая кислота) или циклические группы.
Цис-транс-изомерия ненасыщенных жирных кислот
Углеродные цепи насыщенных жирных кислот имеют форму зигзагообразной линии, когда они вытянуты (как это имеет место при низких температурах). При более высоких температурах происходит поворот вокруг ряда связей, приводящий к укорочению цепей, — именно поэтому при повышении температуры биомембраны становятся тоньше. У ненасыщенных жирных кислот наблюдается геометрическая изомерия, обусловленная различием в ориентации атомов или групп относительно двойной связи. Если ацильные цепи располагаются с одной стороны от двойной связи, образуется циc-конфигурация, характерная, например, для олеиновой кислоты, если же они располагаются по разные стороны, то молекула находится в транс-конфигурации, как в случае элаидиновой кислоты — изомера олеиновой кислоты (рис. 15.5). Природные полиненасыщенные длинноцепочечные жирные кислоты почти все имеют цис-конфигурацию; на участке, где находится двойная связь, молекула «согнута» и образует угол в 120°. Таким образом, олеиновая кислота имеет форму буквы Г, тогда как элаидиновая кислота на участке, содержащем двойную связь, сохраняет «линейную» транс-конфигурацию. Увеличение числа цис-двойных связей в жирных кислотах ведет к увеличению числа возможных пространственных конфигураций молекулы. Это может оказывать большое влияние на упаковку молекул в мембранах, а также на положение молекул жирных кислот в составе более сложных молекул, таких, как фосфолипиды. Наличие двойных связей в транс-конфигурации изменяет эти пространственные соотношения. Жирные кислоты в транс-конфигурации присутствуют в составе некоторых пищевых продуктов. Большинство из них образуется как побочные продукты в процессе гидрогенизации, благодаря которому жирные кислоты переходят в насыщенную форму; таким способом, в частности, добиваются «затвердевания» природных масел при производстве маргарина. Кроме того, еще некоторое небольшое количество транскислот поступает с животным жиром — он содержит транс-кислоты, образовавшиеся под действием микроорганизмов, присутствующих в рубце жвачных животных.
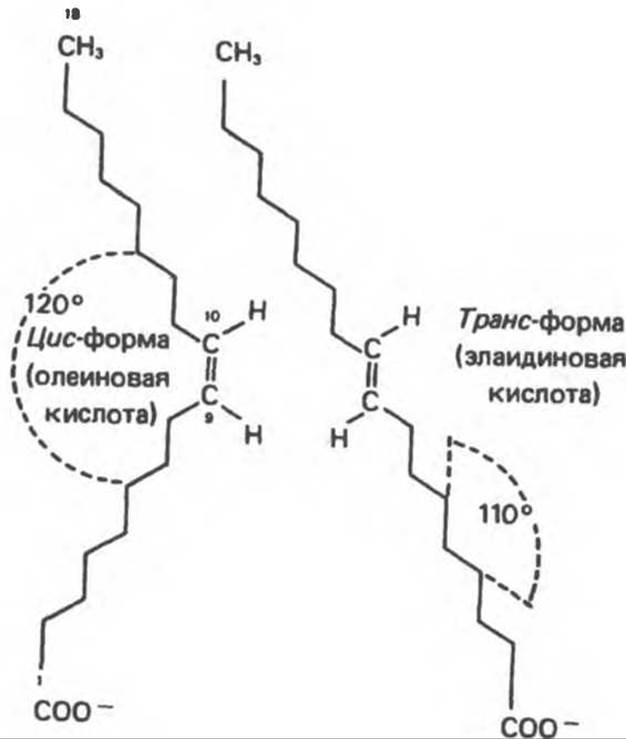
Рис. 15.5. Геометрическая изомерия жирных кислот (∆9, 18:1) (олеиновая и элаидиновая кислоты).
Спирты
К числу спиртов, входящих в состав липидов, относятся глицерол, холестерол и высшие спирты (например, цетиловый спирт С16Н33ОН), которые обычно обнаруживаются в восках, а также полиизопреноидный спирт долихол (рис. 15.27).
Альдегиды жирных кислот
Жирные кислоты могут быть восстановлены в альдегиды. Эти соединения обнаруживаются в природных жирах как в свободном, так и в связанном состоянии.
Физиологически важные свойства жирных кислот
Физические свойства липидов организма в основном зависят от длины углеродных цепей и степени ненасыщенности соответствующих жирных кислот. Так, точка плавления жирных кислот с четным числом атомов углерода повышается с ростом длины цепи и понижается при увеличении степени ненасыщенности. Триацилглицерол, в котором все три цепи являются насыщенными жирными кислотами, содержащими не менее 12 атомов углерода в каждой, является при температуре тела твердым веществом; если же все три остатка жирных кислот относятся к типу 18:2, то соответствующий триацилглицерол остается жидким при температуре ниже 0 °С. На практике природные ацилглицеролы содержат смесь жирных кислот, обеспечивающую выполнение определенной функциональной роли. Мембранные липиды, которые должны находиться в жидком состоянии, являются более ненасыщенными по сравнению с запасными липидами. В тканях, подвергающихся охлаждению — во время зимней спячки или в экстремальных условиях,— липиды оказываются более ненасыщенными.