Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Гликолиз и окисление пирувата
Окисление пирувата в ацетил-СоА
Прежде чем пируват вступает в цикл лимонной кислоты, он должен быть транспортирован в митохондрию; специальный переносчик обеспечивает перенос молекул пирувата через внутреннюю митохондриальную мембрану по механизму симпорта с протоном (см. рис. 13.15). Внутри митохондрии происходит окислительное декарбоксилирование пирувата и образование ацетил-СоА. Эта реакция катализируется несколькими различными ферментами, работающими в определенной последовательности и объединенными в мультиферментный пируватдегидрогеназный комплекс, аналогичный а-кетоглутаратдегидрогеназному комплексу, участвующему в цикле лимонной кислоты (см. с. 174). Пируват декарбоксилируется в присутствии тиаминдифосфата, при этом происходит перенос гидроксиэтильной группы на тиазольное кольцо связанного с ферментом тиаминдифосфата; далее это гидроксиэтильное производное вступает в реакцию с окисленным липоамидом с образованием ацетиллипоамида (рис. 18.5). В присутствии дигидролипоилтрансферазы ацетиллипоамид реагирует с коферментом А, образуя ацетил-СоА и восстановленный липоамид. Завершается цикл реокислением липоамида в реакции с флавопротеином в присутствии дигидролипоилдегидрогеназы. Восстановленный флавопротеин окисляется NAD, который в свою очередь передает восстановительные эквиваленты на дыхательную цепь:
Пируват + NAD+ + СоА → Ацетил-СоА +
NADH + Н+ + СО2.
В пируватдегидрогеназный комплекс входит примерно 29 молекул пируватдегидрогеназы, около 8 молекул флавопротеина (дигидролипоилдегидрогеназы) и 1 молекула трансацетилазы. Перемещение индивидуальных ферментов в комплексе, по-видимому, ограничено, а интермедиаты не диссоциируют, оставаясь связанными с ферментами.
Следует отметить, что пируватдегидрогеназная система характеризуется большим отрицательным окислительно-восстановительным потенциалом, который обеспечивает наряду с восстановлением кофермента (NADH) образование высокоэнергетической тиоэфирной связи в ацетил-СоА.
Клинические аспекты метаболизма пирувата
Арсенат, а также ионы ртути образуют комплексы с —SH-группами липоевой кислоты и ингибируют пируватдегидрогеназу; при недостаточном содержании тиамина в диете активность пируватдегидрогеназы снижается и пируват может накапливаться. Недостаток тиамина возникает у алкоголиков с нарушенным режимом питания; при введении им глюкозы может происходить быстрое накопление пирувата и лактата, приводящее к лактатацидозу, нередко с летальным исходом. У больных с наследственной недостаточностью пируватдегидрогеназы также может развиваться лактатацидоз, особенно после глюкозной нагрузки. Зарегистрированы мутации практически всех ферментов углеводного метаболизма, и в каждом случае их следствием является заболевание человека.
Энергетика окисления углеводов
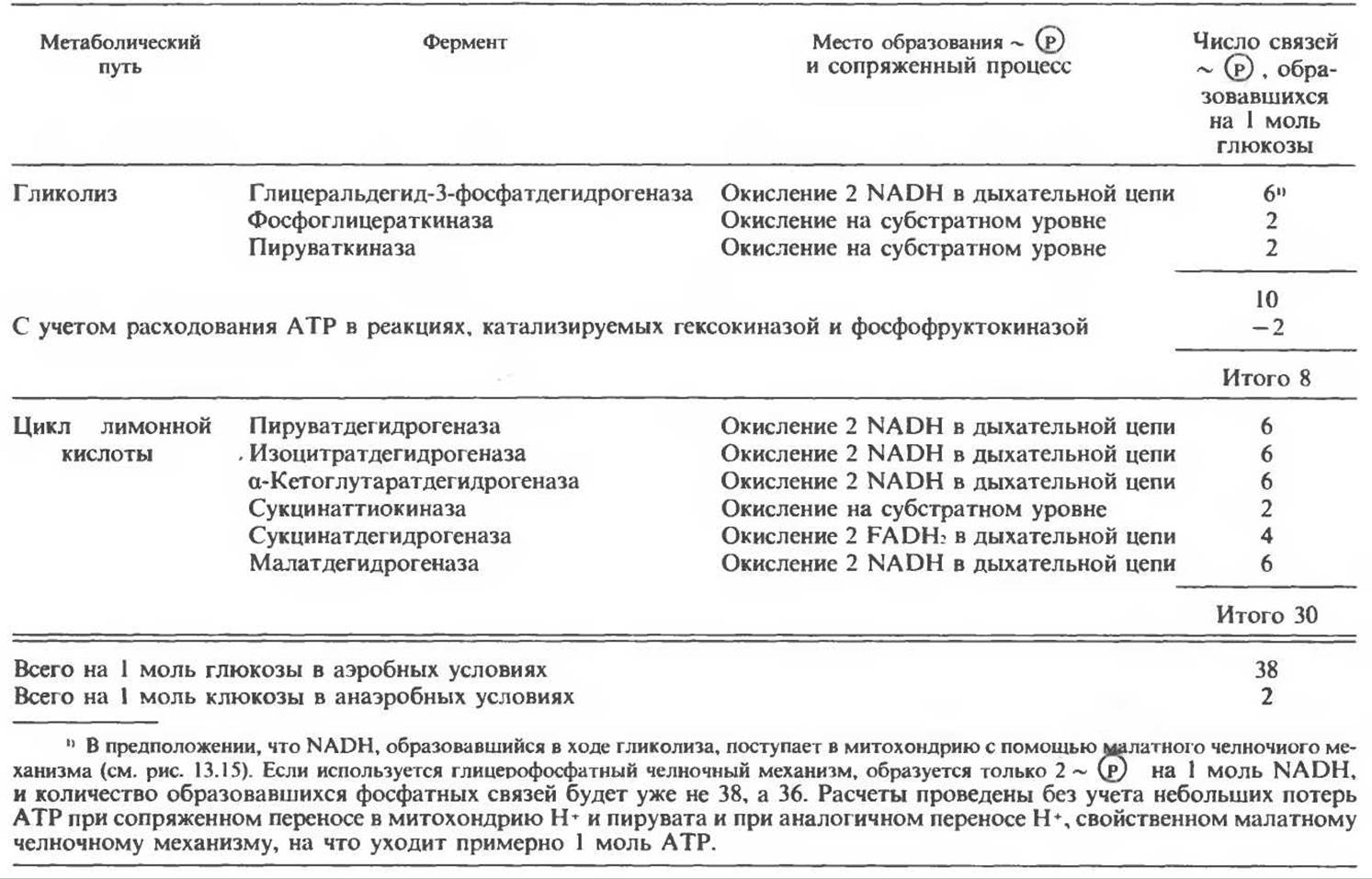
При сжигании в калориметре 1 моль глюкозы с образованием СО2 и Н2О выделяется приблизительно 2780 кДж теплоты. Когда окисление глюкозы происходит в тканях, часть высвобождаемой энергии не теряется в форме теплоты, а «улавливается» в виде высокоэнергетических фосфатных связей. На молекулу глюкозы, окисляющуюся до СО2 и Н2О, образуется примерно 38 высокоэнергетических фосфатных связей. Если принять, что энергия высокоэнергетической связи равна 30,5 кДж, то суммарная энергия, запасаемая в форме АТР, составит 1159 кДж на 1 моль глюкозы (приблизительно 41,7% от энергии сгорания). Большая часть АТР образуется в процессе окислительного фосфорилирования при окислении восстановленных коферментов дыхательной цепью. Другая часть АТР образуется в результате фосфорилирования, происходящего «на субстратном уровне» (см. гл. 13). В табл. 18.1 даны реакции, в которых происходит образование высокоэнергетических фосфатов при катаболизме глюкозы, с указанием эффективности процесса в аэробных и анаэробных условиях.

Рис. 18.5. А — окислительное декарбоксилирование пирувата пируватдегидрогегеназным комплексом. Б — липоевая кислота. Она присоединяется амидной связью к остаткам лизина трансацетилазного компонента комплекса.
Таблица 18.1. Образование высокоэнергетических фосфатных связей в ходе катаболизма глюкозы
Литература
Blass J. Р. Disorders of pyruvate metabolism, Neurology, 1978, 29, 280.
Boyer P. D. (ed.) The Enzymes, 3rd ed., Vols. 5—9, Academic Press, 1972.
Dickens F., Randle P.J., Whelan W. J. (eds) Carbohydrate Metabolism and Its Disorders, 2 vols., Academic Press, 1968.
Greenberg D. M. (ed.) Metabolic Pathways, 3rd ed., Vol. 1. Academic Press, 1967.
Randle P. J., Steiner D.F., Whelan W.J. (eds) Carbohydrate Metabolism and Its Disorders, Vol. 3, Academic Press, 1981.
Veneziale С. M. (ed.) The Regulation of Carbohydrate Formation and Utilization in Mammals, University Park Press, 1981.