Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Гликолиз и окисление пирувата
Последовательные стадии гликолиза
Суммарное уравнение гликолиза, завершающегося образованием лактата, следующее:
Глюкоза + 2ADP + 2Рi → 2b-Лактат + 2АТР + 2Н2O
Все ферменты гликолитического пути (рис. 18.2) находятся во внемитохондриальной растворимой клеточной фракции (цитозоле). Они катализируют реакции превращения глюкозы в пируват и лактат, которые протекают в следующей последовательности.
Гликолитический путь превращения глюкозы начинается с ее фосфорилирования в глюкозо-6-фосфат. Эта реакция катализируется ферментом гексокиназой; в паренхиматозных клетках печени эту функцию выполняет индуцируемый фермент глюкокиназа, активность которого зависит от характера питания. Донором фосфата служит АТР в виде комплекса Mg — АТР, что характерно и для многих других реакций фосфорилирования. При этом расходуется одна высокоэнергетическая фосфатная связь АТР и образуется ADP. Реакция сопровождается значительными потерями свободной энергии в форме теплоты. Поэтому при физиологических условиях эта реакция является необратимой. Продукт реакции глюкозо-6-фосфат является аллостерическим ингибитором гексокиназы:
![]()
Гексокиназа, присутствующая во всех тканях, за исключением паренхимы печени, имеет высокое сродство (низкое Км) к своему субстрату» глюкозе; ее функция состоит в том, чтобы обеспечить захват тканью глюкозы даже при низких концентрациях последней в крови. Фосфорилируя практически всю поступающую в клетку глюкозу, гексокиназа поддерживает значительный градиент концентрации глюкозы между кровью и внутриклеточной средой. Фермент действует как на а-, так и на ß-аномеры глюкозы; он фосфорилирует также и другие гексозы, но со значительно меньшей скоростью.
Функция глюкокиназы состоит в «захватывании» глюкозы из кровотока после приема пищи (когда концентрация глюкозы в крови повышается). В отличие от гексокиназы она имеет высокое значение Км для глюкозы и эффективно функционирует при концентрации глюкозы в крови выше 100 мг/100 мл (см. рис. 22.7). Глюкокиназа специфична к глюкозе.
Глюкозо-6-фосфат занимает важное положение в области стыковки ряда метаболических путей (гликолиз, глюконеогенез, пентозофосфатный путь, гликогенез и гликогенолиз) (рис. 18.2). В ходе гликолиза он превращается во фруктозо-6-фосфат при участии фосфогексозонзомеразы, при этом происходит альдо-кето-изомеризация. Фермент действует только на а-аномер глюкозо-6-фосфата:
a-D-Глюкозо-6-фосфат⇔a-D-Фруктозо-б-фосфат.
Далее следует еще одно фосфорилирование, осуществляемое АТР; оно катализируется фосфофруктокиназой (фосфофруктокиназа-1) с образованием фруктозо-1,6-бисфосфата. Фосфофруктокиназа также является индуцируемым ферментом; считается, что она играет главную роль в регуляции скорости гликолиза. Реакция, катализируемая фосфофруктокиназой, также является необратимой при физиологических условиях:
D-Фруктозо-6-фосфат + АТР → D-Фруктозо-1,6-бисфосфат + ADP.
Фруктозо-1,6-бисфосфат расщепляется альдолазой (фруктозо-1,6-бисфосфат-альдолазой) на два триозофосфата: глицеральдегид-3-фосфат и дигидроксиацетонфосфат:
D-Фруктозо-1,6-бисфосфат↔D-Глицеральдегид-3-фосфат + Дигидроксиацетонфосфат.
Описано несколько различных альдолаз, и все они состоят из четырех субъединиц. В большинстве тканей находится альдолаза А, в печени и почках имеется также альдолаза В. В клетке фруктозофосфаты находятся преимущественно в фуранозной форме, но фосфогексозоизомераза, фосфофруктокиназа и альдолаза действуют на молекулы, имеющие «открытую» линейную конфигурацию.

Рис. 18.2. Последовательность реакций гликолиза. Обозначения:
![]() — ингибирование.
— ингибирование.
Атомы углерода 1—3 в молекуле фруктозобисфосфата участвуют в образовании дигидроксиацетонфосфата, а атомы углерода 4—6 — в образовании глицеральдегид-3-фосфата.
Глицеральдегид-3-фосфат и дигидроксиацетонфосфат превращаются друг в друга при участии фермента фосфотриозоизомеразы:
D-Глицеральдегид-3-фосфат ↔ Дигидроксиацетонфосфат.
Следующей стадией гликолиза является окисление глицеральдегид-3-фосфата с образованием 1,3- бисфосфоглицерата; дигидроксиацетонфосфат при участии фосфотриозоизомеразы также окисляется в 1,3-бисфосфоглицерат, проходя через стадию образования глицеральдегид-3-фосфата:
D-Глицеральдегид-3-фосфат + NAD+ + Рі ↔ 1,3-Бисфосфоглицерат + NADH + Н+ .
Фермент, катализирующий эту реакцию, — NAD-зависимая глицеральдегид-3-фосфатдегидрогеназа. В структурном плане она состоит из четырех идентичных полипептидов, образующих тетрамер. Каждый полипептид содержит по четыре—SH-гpyппы, принадлежащие остаткам цистеина. Одна из них находится в активном центре фермента. Полагают, что она принимает участие в окислении глицеральдегид-3-фосфата. Сначала субстрат соединяется с остатком цистеина дегидрогеназы, образуя тиополуацеталь, который окисляется в тиоловый эфир; атомы водорода, отщепленные при этом окислении, переносятся на связанный с ферментом NAD. Образующийся NADH связан с ферментом менее прочно, чем NAD, и поэтому легко замещается другой молекулой NAD. Реакция завершается фосфоролизом тиоэфирной связи с присоединением неорганического фосфата Рі; при этом образуются 1,3-бисфосфоглицерат и свободный фермент с —SH-группой (рис. 18.3). Потенциальная энергия процесса окисления резервируется сначала в высокоэнергетической тиоэфирной связи, а после фосфоролиза — в высокоэнергетической фосфатной связи 1,3-бисфосфоглицерата, находящейся в положении 1. Высокоэнергетический фосфат переходит далее в состав АТР при участии фермента фосфоглицераткиназы, при этом образуется 3-фосфоглицерат:
1,3-Бисфосфоглицерат + ADP ↔ 3-Фосфоглицерат + АТР.
Поскольку на каждую молекулу глюкозы, участвующую в гликолизе, образуются две молекулы триозы, то на рассмотренной стадии образуются две молекулы АТР на молекулу глюкозы. Здесь мы имеем пример фосфорилирования «на субстратном уровне».
В присутствии арсената, который конкурирует с неорганическим фосфатом (Рi), образуется 1-арсено-3-фосфоглицерат, самопроизвольно гидролизующийся до 3-фосфоглицерата с выделением теплоты, но без образования АТР. Это важный пример способности арсената разобщать процессы окисления и фосфорилирования.
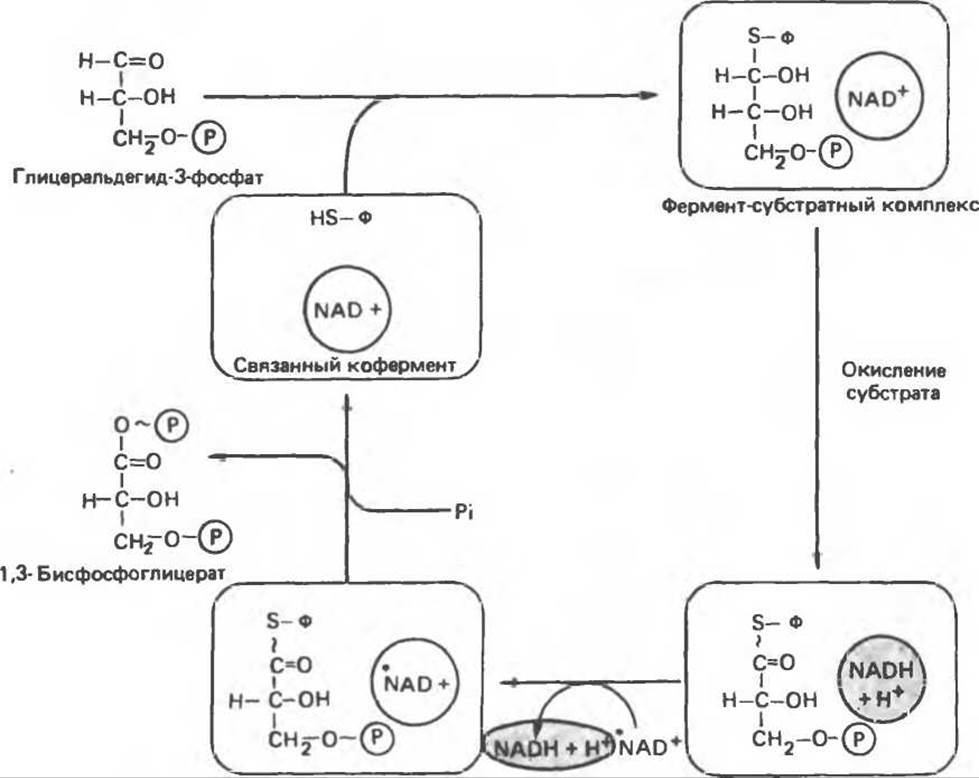
Рис. 183. Окисление глицеральдегид-3-фосфата. Ф — глицеральдегид-3-фосфатдегидрогеназа. Фермент ингибируется реагентом на - SH-группы водацетатом, который, следовательно, способен подавлять гликолиз.
Образовавшийся на предыдущей стадии 3-фосфоглицерат превращается в 2-фосфоглицерат при участии фермента фосфоглицератмутазы. Полагают, что на промежуточной стадии реакции образуется 2,3-бисфосфоглицерат (DPG):
3-Фосфоглицерат ↔ 2-Фосфоглицерат.
На следующей стадии, катализируемой енолазой, происходит отщепление молекулы воды и перераспределение энергии внутри молекулы, при этом фосфат в положении 2 переходит в высокоэнергетическое состояние; продуктом реакции является фосфоенолпируват. Енолаза ингибируется ионами фторида; этим пользуются в тех случаях, когда необходимо остановить гликолиз, например перед определением содержания глюкозы в крови. Енолаза нуждается в ионах Mg2+ или Мn2+:
2-Фосфоглицерат ↔ Фосфоенолпируват + Н2О.
Высокоэнергетический фосфат фосфоенолпирувата переносится на ADP ферментом пируваткиназой; на этой стадии образуются еще две молекулы АТР на молекулу глюкозы. Образующийся в ходе реакции енолпируват самопроизвольно переходит в кетоформу, т. е. пируват. Это — еще одна неравновесная реакция, сопровождающаяся значительной потерей свободной энергии в форме теплоты; она является физиологически необратимой:
Фосфоенолпируват + ADP → Пируват + АТР.
В зависимости от окислительно-восстановительного состояния ткани дальнейший процесс может идти по одному из двух путей. В анаэробных условиях реокисление NADH путем переноса восстановительных эквивалентов на дыхательную цепь и далее на кислород происходить не может. Поэтому NADH восстанавливает пируват в лактат, эта реакция катализируется лактатдегидрогеназой. Описано несколько изозимов этого фермента, определение их имеет клиническое значение.
Пируват + NADH + Н+↔ L-ЛактаТ + NAD+.
Реокисление NADH путем образования лактата обеспечивает возможность протекания гликолиза в отсутствие кислорода, поскольку поставляется NAD+, необходимый для глицеральдегид-3-фосфатдегидрогеназной реакции. Таким образом, в тканях, функционирующих в условиях гипоксии, наблюдается образование лактата (рис. 18.2). Это в особенности справедливо в отношении скелетной мышцы, интенсивность работы которой в определенных пределах не зависит от поступления кислорода. Образующийся лактат может быть обнаружен в тканях, крови и моче. Гликолиз в эритроцитах даже в аэробных условиях всегда завершается образованием лактата, поскольку в этих клетках отсутствуют митохондрии, содержащие ферментные системы аэробного окисления пирувата. Эритроциты млекопитающих уникальны в том отношении, что около 90% их потребностей в энергии обеспечивается гликолизом. Помимо скелетной мышцы и эритроцитов ряд других тканей (мозг, желудочно-кишечный тракт, мозговой слой почек, сетчатка и кожа) в норме частично используют энергию гликолиза и образуют молочную кислоту. Печень, почки и сердце обычно утилизируют лактат, но в условиях гипоксии образуют его.
Хотя большая часть гликолитических реакций обратима, три из них носят ярко выраженный экзергонический характер и поэтому могут рассматриваться как физиологически необратимые. Это реакции, катализируемые гексокиназой (и глюкокиназой), фосфофруктокиназой и пируваткиназой; они служат главными участками, на которых происходит регуляция гликолиза. Клетки, способные направить движение метаболитов гликолитического пути в направлении синтеза (глюконеогенез), используют различные ферментные системы, обеспечивающие протекание процесса в обход упомянутых выше необратимых стадий. Об этом будет подробнее сказано ниже, когда будут обсуждаться процессы глюконеогенеза.
2,3-Бисфосфоглицератный цикл
В эритроцитах многих млекопитающих имеется фермент, позволяющий направить процесс в обход стадии, катализируемой фосфоглицераткиназой; при этом свободная энергия, обусловленная присутствием высокоэнергетического фосфата в молекуле 1,3-бисфосфоглицерата, рассеивается в форме теплоты (рис. 18.4). Дополнительный фермент бисфосфоглицератмутаза катализирует превращение 1,3-бисфосфоглицерата в 2,3-бисфосфоглицерат, последний далее превращается в 3-фосфоглицерат при участии 2,3-бисфосфоглицератфосфатазы (принято считать, что этой активностью обладает фосфоглицератмутаза). Потеря на этой стадии высокоэнергетического фосфата означает, что процесс гликолиза более не сопровождается производством АТР. В этом может заключаться определенное преимущество, поскольку даже в тех случаях, когда потребности в АТР минимальны, гликолиз может продолжаться. Образующийся 2,3-бисфосфоглицерат связывается с гемоглобином, понижая сродство последнего к кислороду, т.е. сдвигает кривую диссоциации оксигемоглобина вправо. Таким образом, присутствие 2,3-дифосфоглицерата в эритроцитах способствует диссоциации кислорода из оксигемоглобина и переходу его в ткани (см. гл. 6).
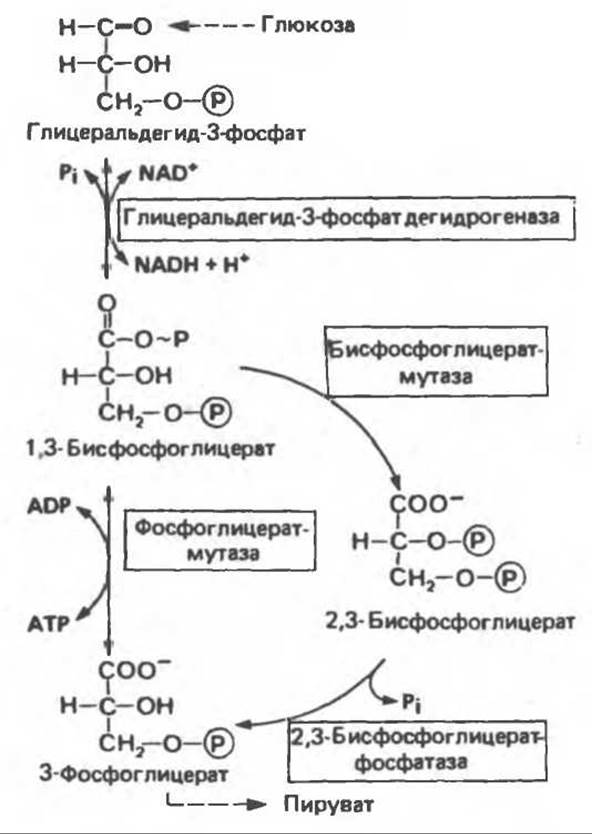
Рис. 18.4. 2,3-Бисфосфоглицератный цикл в эритроцитах.