Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Окисление и биосинтез жирных кислот
Окисление жирных кислот
Свободные жирные кислоты
«Свободными жирными кислотами» (СЖК) называют жирные кислоты, находящиеся в неэстерифицированной форме; иногда их называют неэстерифицированными жирными кислотами (НЖК). В плазме крови длинноцепочечные СЖК образуют комплекс с альбумином, а в клетке — с белком, связывающим жирные кислоты, который называют Z-белком; фактически они никогда не бывают свободными. Короткоцепочечные жирные кислоты лучше растворяются в воде и находятся либо в виде неионизированной кислоты, либо в виде аниона жирной кислоты.
Активация жирных кислот
Так же как и в случае метаболизма глюкозы, жирная кислота прежде всего должна превратиться в активное производное в результате реакции, протекающей с участием АТР, и только после этого она способна взаимодействовать с ферментами, катализирующими дальнейшее превращение. В процессе окисления жирных кислот эта стадия является единственной, требующей энергии в виде АТР. В присутствии АТР и кофермента А фермент ацил-СоА-синтетаза (тиокиназа) катализирует превращение свободной жирной кислоты в «активную жирную кислоту» или ацил-СоА, которое осуществляется за счет расщепления одной богатой энергией фосфатной связи.

Присутствие неорганической пирофосфатазы, которая расщепляет богатую энергией фосфатную связь в пирофосфате, обеспечивает полноту протекания процесса активации. Таким образом, для активации одной молекулы жирной кислоты в итоге расходуются две богатые энергией фосфатные связи.

Ацил-СоА-синтетазы находятся в эндоплазматическом ретикулуме, а также внутри митохондрий и на их наружной мембране. В литературе описан ряд ацил-СоА-синтетаз; они специфичны к жирным кислотам с определенной длиной цепи.
Роль карнитина в окислении жирных кислот
Карнитин (у-триметиламино-β-гидроксибутират)—(CH3)3N+—СН2—СН(ОН)—СН2-СОО- — является широко распространенным соединением,
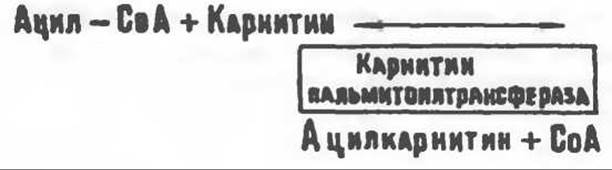
особенно много его в мышцах. Он образуется из лизина и метионина в печени и почках. Активация низших жирных кислот и их окисление могут происходить в митохондриях независимо от карнитина, однако длинноцепочечные ацил-СоА-производные (или СЖК) не могут проникать в митохондрии и окисляться, если предварительно не образуют ацилкарнитин-производных. На наружной стороне внутренней мембраны митохондрий имеется фермент карнитин-пальмитоилтрансфераза I, который переносит длинноцепочечные ацильные группы на карнитин с образованием ацилкарнитина; последний способен проникать в митохондрии, где находятся ферменты, катализирующие процесс ß-окисления.
Возможный механизм, объясняющий участие карнитина в окислении жирных кислот в митохондриях, приведен на рис. 23.1. Кроме того, в митохондриях находится другой фермент — карнитин-ацетилтрансфераза, который катализирует перенос короткоцепочечных ацильных групп между СоА и карнитином. Функция этого фермента пока не ясна. Возможно, он облегчает транспорт ацетильных групп через мембрану митохондрий.
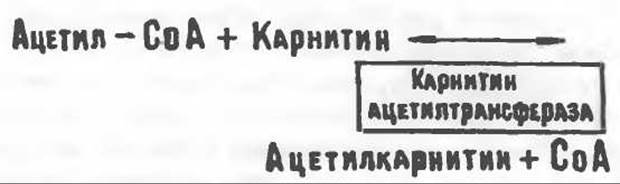

Рис. 23.1. Роль карнитина в переносе длинноцепочечных жирных кислот через внутреннюю мембрану митохондрий. Длинноцепочечный ацил-СоА не способен проходить через внутреннюю мембрану митохондрий, в то время как такой способностью обладает ацилкарнитин, образующийся при действии карнитин-пальмитоилтрансферазы I. Карнитин- ацилкарнитин-транслоказа является транспортной системой. осуществляющей перенос молекулы ацилкарнитина через внутреннюю мембрану митохондрии, сопряженный с выходом молекулы свободного карнитина. Затем при действии карнитин-пальмитоилтрансферазы II, локализованной на внутренней поверхности внутренней мембраны митохондрии, ацилкарнитин взаимодействует с СоА. В результате в митохондриальном матриксе вновь образуется ацил-СоА. а карнитин высвобождается.
ß-Окисление жирных кислот
Общее представление дает рис. 23.2. При ß- окислении жирных кислот 2 атома углерода одновременно отщепляются от карбоксильного конца молекулы ацил-СоА. Углеродная цепь разрывается между атомами углерода в положениях а(2) и ß(3), откуда и возникло название ß-окисление. Образующиеся двухуглеродные фрагменты представляют собой ацетил-СоА. Так, в случае пальмитоил-СоА образуется 8 молекул ацетил-СоА.
Последовательность реакций
Ряд ферментов, известных под общим названием «оксидазы жирных кислот», находятся в митохондриальном матриксе в непосредственной близости от дыхательной цепи, локализованной во внутренней мембране митохондрий. Эта система катализирует окисление ацил-СоА до ацетил-СоА, которое сопряжено с фосфорилированием ADP до АТР (рис. 23.3).
После проникновения ацильною фрагмента через мембрану митохондрий при участии карнитиновой транспортной системы и переноса ацильной группы от карнитина на СоА происходит отщепление двух атомов водорода от углеродных атомов в положениях 2(a) и 3(ß), катализируемое ацил-СоА-дегидрогеназой. Продуктом этой реакции является ∆2-транс-еноил-СоА. Фермент представляет собой флавопротеин, его простетической группой служит FAD. Окисление последнего в дыхательной цепи митохондрий происходит при участии другого флавопротеина, названного электронпереносящим флавопротеином (см. с. 123). Далее происходит гидратация двойной связи, в результате чего образуется 3-гидроксиацил-СоА. Эта реакция катализируется ферментом ∆2-еноил-СоА-гидратазой. Затем 3-гидроксиацил-СоА дегидрируется по 3-му атому углерода с образованием 3-кетоацил-СоА; эта реакция катализируется 3-гидроксиацил-СоА-дегидрогеназой при участии в качестве кофермента NAD. 3-Кетоацил-СоА расщепляется между вторым и третьим атомами углерода 3-кетотиолазой или ацетил-СоА-ацилтрансферазой с образованием ацетил-СоА- и ацил-СоА-производного, которое на 2 атома углерода короче исходной молекулы ацил-СоА. Это тиолитическое расщепление требует участия еще одной молекулы СоА. Образующийся укороченный ацил-СоА вновь вступает в цикл ß-окисления, начиная с реакции 2 (рис. 23.3). Таким путем длинноцепочечные жирные кислоты могут полностью расщепляться до ацетил-СоА (С2-фрагментов); последние в цикле лимонной кислоты, который протекает в митохондриях, окисляются до СО2 и Н2О.
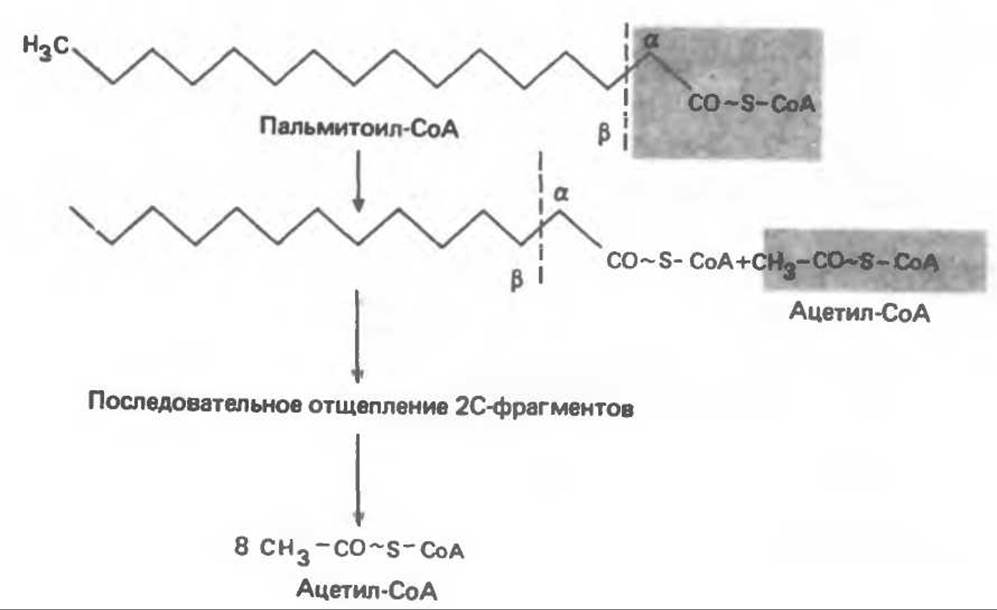
Рис. 23.2. Схема ß-окисления жирных кислот.
Окисление жирных кислот с нечетным числом атомов углерода
ß-Окисление жирных кислот с нечетным числом атомов углерода заканчивается на стадии образования трехуглеродного фрагмента — пропионил-СоА, который затем превращается в сукцинил-СоА, являющийся интермедиатом цикла лимонной кислоты (см. также рис. 20.2).
Энергетика процесса окисления жирных кислот
В результате переноса электронов по дыхательной цепи от восстановленного флавопротеина и NAD синтезируется по 5 богатых энергией фосфатных связей (см. гл. 13) на каждые 7 (из 8) молекул ацетил-СоА, образующихся при ß-окислении пальмитиновой кислоты (7 х 5 = 35). Всего образуется 8 молекул ацетил-СоА, и каждая из них, проходя через цикл лимонной кислоты, обеспечивает синтез 12 богатых энергией связей. Всего в расчете на молекулу пальмитата по этому пути генерируется 8 х 12 = 96 богатых энергией фосфатных связей. Если учесть две связи, необходимые для активации жирной кислоты, то в общей сложности получим 129 богатых энергией связей на 1 моль или 129 х 30,5 = 3935 кДж. Поскольку свободная энергия сгорания пальмитиновой кислоты составляет 9791 кДж/моль, то на долю энергии, запасаемой в виде фосфатных связей при окислении жирной кислоты, приходится около 40%.
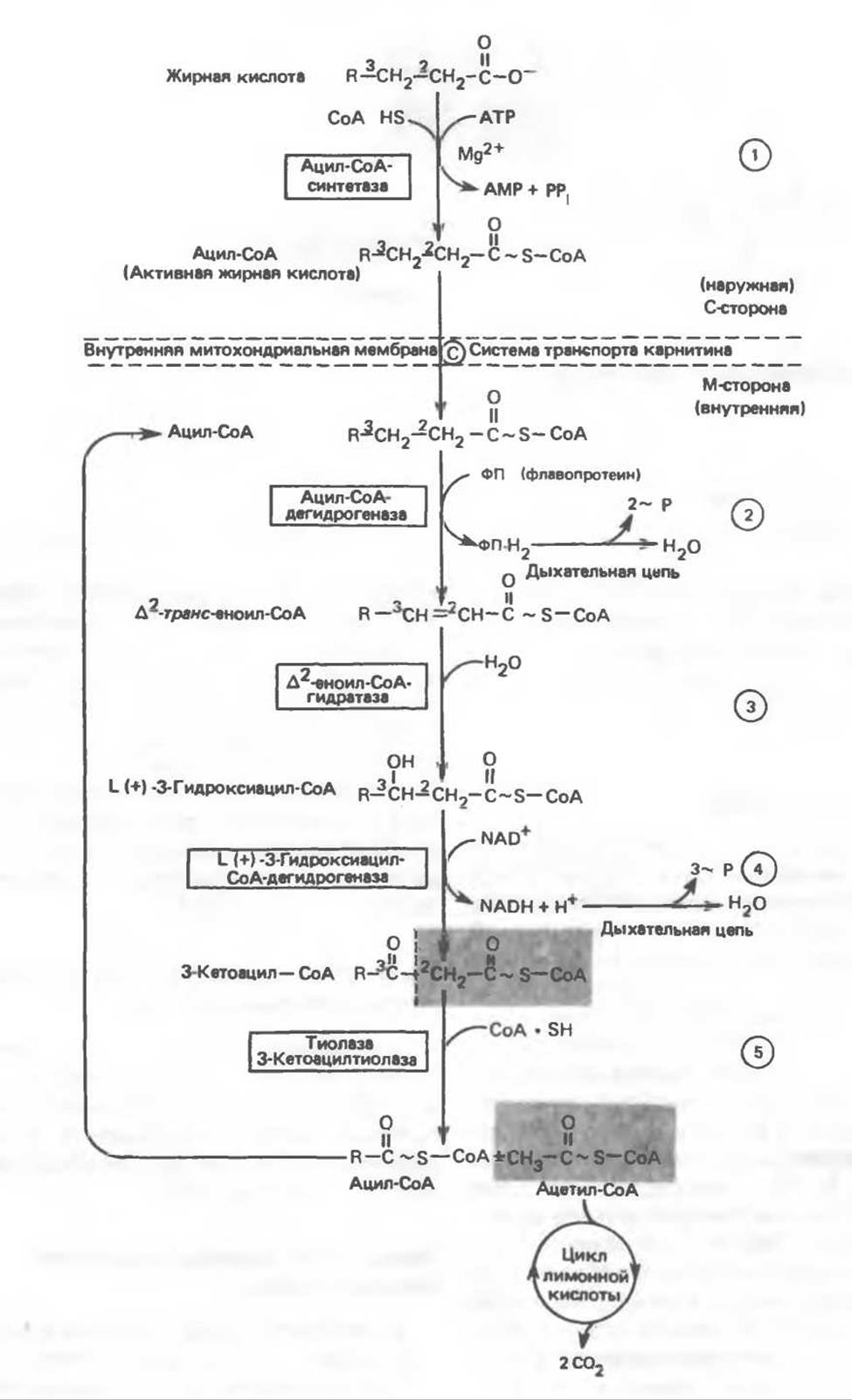
Рис. 23.3. ß-Окисление жирных кислот. Длинноцепочечный ацил-СоА последовательно укорачивается, проходя цикл за циклом ферментативные реакции 2—5; в результате каждого цикла происходит отщепление ацетил-СоА, катализируемое тиолазой (реакция 5). Когда остается четырехуглеродный ацильный радикал, то из него в результате реакции 5 образуются две молекулы ацетил-СоА.
Окисление жирных кислот в пероксисомах
В пероксисомах ß-окисление жирных кислот происходит в модифицированном виде. Продуктами окисления в данном случае являются ацетил-СоА и Н2О2, последняя образуется на стадии, катализируемой связанной с флавопротеином дегидрогеназой. Этот путь окисления непосредственно не сопряжен с фосфорилированием и образованием АТР, но он обеспечивает расщепление жирных кислот с очень длинной цепью (например, С20, С22); он включается при диете, богатой жирами, или приеме гиполипидемических лекарственных препаратов, таких, как клофибрат. Ферменты пероксисом не атакуют жирные кислоты с короткими цепями, и процесс ß-окисления останавливается при образовании октаноил-СоА. Октаноильные и ацетильные группы удаляются затем из пероксисом в виде октаноилкарнитина и ацетилкарнитина и окисляются в митохондриях.
а- и ω-Окисление жирных кислот
ß-Окисление является основным путем катаболизма жирных кислот. Однако недавно было обнаружено, что в тканях мозга происходит а-окисление жирных кислот, т. е. последовательное отщепление одноуглеродных фрагментов от карбоксильного конца молекулы. В этом процессе участвуют интермедиаты, содержащие СоА; он не сопровождается образованием богатых энергией фосфатных связей.
ω-Окисление жирных кислот в норме весьма незначительно. Этот тип окисления, катализируемый гидроксилазами при участии цитохрома Р-450 (см. с. 123), протекает в эндоплазматическом ретикулуме. —СН3-Группа превращается в —СН2ОН-группу, которая затем окисляется до —СООН; в результате образуется дикарбоновая кислота. Последняя расщепляется путем ß-окисления обычно до адипиновой (С6) и субериновой (С8) кислот, которые затем удаляются с мочой.
Клинические аспекты
Кетоз развивается при высокой скорости окисления жирных кислот в печени, особенно в тех случаях, когда оно происходит на фоне недостатка углеводов (см. с. 292). Подобное состояние возникает при приеме пищи, богатой жирами, голодании, сахарном диабете, кетозе у лактирующих коров и токсикозе беременности (кетозе) у овец. Ниже приводятся причины, вызывающие нарушение процесса окисления жирных кислот.
Недостаток карнитина встречается у новорожденных, чаще всего недоношенных детей; он обусловлен либо нарушением биосинтеза карнитина; либо его «утечкой» в почках. Потери карнитина могут происходить при гемодиализе; больные, страдающие органической ацидурией, теряют большое количество карнитина, который экскретируется из организма в форме конъюгатов с органическими кислотами. Для восполнения потерь этого соединения некоторые пациенты нуждаются в особой диете, включающей продукты, содержащие карнитин. Признаками и симптомами недостатка карнитина являются приступы гипогликемии, возникающие из-за снижения глюконеогенеза в результате нарушения процесса окисления жирных кислот, уменьшение образования кетоновых тел, сопровождающееся повышением содержания СЖК в плазме крови, мышечная слабость (миастения), а также накопление липидов. При лечении внутрь принимают препарат карнитина. Симптомы недостатка карнитина очень сходны с симптомами синдрома Рейе (Reye), при котором, однако, содержание карнитина является нормальным. Причина синдрома Рейе пока неизвестна.
Снижение активности карнитин-пальмитоилтрансферазы печени приводит к гипогликемии и понижению содержания кетоновых тел в плазме крови, а снижение активности карнитин-пальмитоилтрансферазы мышц — к нарушению процесса окисления жирных кислот, в результате чего периодически возникает мышечная слабость и развивается миоглобинурия.
Ямайская рвотная болезнь возникает у людей после употребления в пищу незрелых плодов аки (Blighia sapida), которые содержат токсин гипоглицин, инактивирующий ацил-СоА-дегидрогеназу, в результате чего ингибируется процесс ß-окисления.
При дикарбоновой ацидурии происходит экскреция С6—С10—дикарбоновых кислот и развивается гипогликемия, не связанная с повышением содержания кетоновых тел. Причиной данного заболевания является отсутствие в митохондриях ацил-СоА-дегидрогеназы среднецепочечных жирных кислот. При этом нарушается ß-окисление и усиливается ω-окисление длинноцепочечных жирных кислот, которые укорачиваются до среднецепочечных дикарбоновых кислот, выводимых из организма.
Болезнь Рефсума является редким неврологическим заболеванием, которое вызывается накоплением в тканях фитановой кислоты, образующейся из фитола; последний входит в состав хлорофилла, поступающего в организм с продуктами растительного происхождения. Фитановая кислота содержит метальную группу у третьего атома углерода, это блокирует ее ß-окисление. В норме эта метильная группа удаляется при а-окислении, но у людей, страдающих болезнью Рефсума, имеется врожденное нарушение системы а-окисления, что приводит к накоплению фитановой кислоты в тканях.
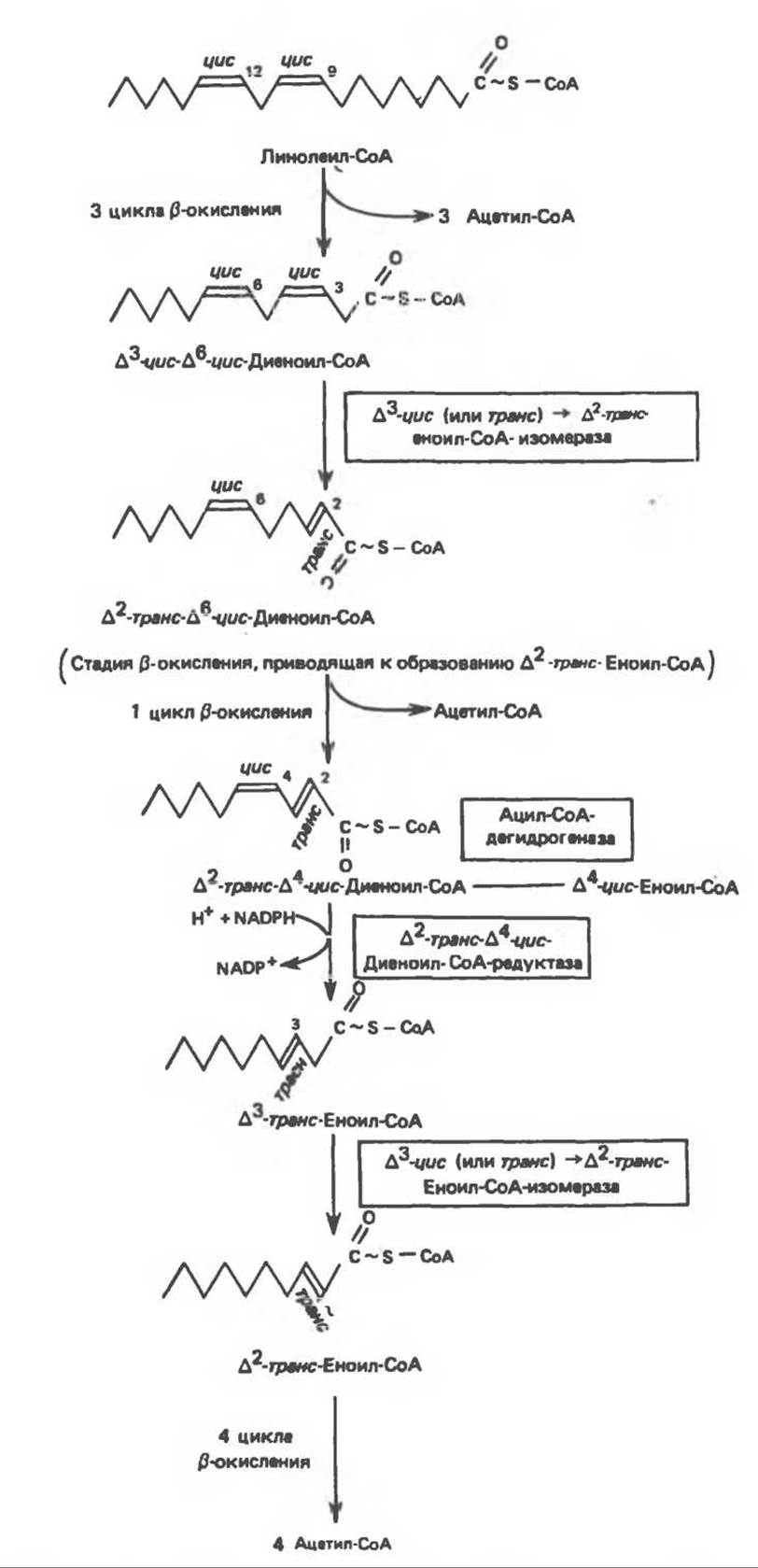
Рис. 23.4. Последовательность реакций окисления ненасыщенных жирных кислот на примере, линолевой кислоты. ∆4-циc-жирные кислоты либо жирные кислоты, образующие ∆4-цис-еноил-СоА. вступают на данный путь на стадии, указан ной на схеме.
Синдром Цельвегера (Zellweger) или цереброгепаторенальный синдром является редким наследственным заболеванием, при котором во всех тканях отсутствуют пероксисомы. У больных, страдающих синдромом Цельвегера, в мозгу накапливаются С26—С38—полиеновые кислоты, поскольку из-за отсутствия пероксисом у них не происходит процесс окисления длинноцепочечных жирных кислот.
Окисление ненасыщенных жирных кислот
СоА-производные ненасыщенных жирных кислот атакуются ферментами, катализирующими ß-окисление до стадии, на которой в зависимости от локализации двойных связей образуется либо ∆3-цис-ацил-СоА-, либо ∆4-цис-ацил-СоА-производное (рис. 23.4); затем ∆3-цис-ацил-СоА изомеризуется под действием ∆3-цис → ∆2-транс-еноил-СоА-изомеразы с образованием ∆2-транс-еноил-СоА. Последний вступает далее в обычную последовательность реакций ß-окисления. Любое ∆4-цис-ацил- СоА-производное, либо образовавшееся в ходе окисления из линолевой кислоты (рис. 23.4), либо вступившее в цикл на этой стадии, превращается под действием ацил-Соа-дегидрогеназы в ∆2-транс-∆4-цис-диеноил-СоА; последний затем превращается в ∆3-транс-еноил-СоА под действием NADP-зависимого фермента ∆2-транс-∆4-цис-диеноил-СоА- редуктазы. Далее ∆3-цис → ∆2-транс-еноил-СоА-изомераза атакует ∆3-транс-двойную связь; в результате образуется ∆2-транс-еноил-СоА, являющийся промежуточным соединением при ß-окислении.
Перекисное окисление полиненасьщенных жирных кислот в микросомах
NADPH-зависимое перекисное окисление ненасыщенных жирных кислот катализируется ферментами, локализованными в микросомах (см. с. 124). Антиоксиданты, например БГТ (бутилированный гидрокситолуол) и а-токоферол (витамин Е), ингибируют перекисное окисление липидов в микросомах.