Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Окисление и биосинтез жирных кислот
Биосинтез насыщенных жирных кислот
Ранее предполагали, что процессы расщепления являются обращением процессов синтеза (например, гликогенолиз и гликогенез), а синтез жирных кислот рассматривали как процесс, обратный их окислению.
В настоящее время установлено, что митохондриальная система биосинтеза жирных кислот, включающая несколько модифицированную последовательность реакции ß-окисления, осуществляет только удлинение уже существующих в организме среднецепочечных жирных кислот, в то время как полный биосинтез пальмитиновой кислоты из ацетил-СоА активно протекает вне митохондрий по совершенно другому пути. Активная система, обеспечивающая удлинение цепей жирных кислот, имеется в эндоплазматическом ретикулуме.
Внемитохондриальная система биосинтеза de novo жирных кислот (липогенез)
Эта система находится в растворимой (цитозольной) фракции клеток многих органов, в частности печени, почек, мозга, легких, молочной железы, а также в жировой ткани. Биосинтез жирных кислот протекает с участием NADPH, АТР, Мn2+ и НСО-3 (в качестве источника СO2); субстратом является ацетил-СоА, конечным продуктом — пальмитиновая кислота. Потребности в кофакторах процессов биосинтеза и ß-окисления значительно различаются.
Образование малонил-СоА
Первой реакцией биосинтеза жирных кислот, катализируемой ацетил-СоA-карбоксилазой и осуществляемой за счет энергии АТР, является карбоксилирование ацетил-СоА; источником СO2 является бикарбонат. Для функционирования фермента необходим витамин биотин (рис. 23.5). Этот фермент состоит из переменного числа одинаковых субъединиц, каждая из которых содержит биотин, биотинкарбоксилазу, карбоксибиотин-переносящий белок, транс-карбоксилазу, а также регуляторный аллостерический центр, т. е. представляет собой полиферментный комплекс. Реакция протекает в две стадии: (1) карбоксилирование биотина с участием АТР (рис. 20.4) и (2) перенос карбоксильной группы на ацетил-СоА, в результате чего образуется малонил-СоА. Ацетил-СоА-карбоксилаза активируется цитратом и ингибируется длинноцепочечными ацил-СоА-производными. Активированная форма фермента легко полимеризуется с образованием нитей, состоящих из 10—20 протомеров.
Синтазный комплекс, катализирующий образование жирных кислот
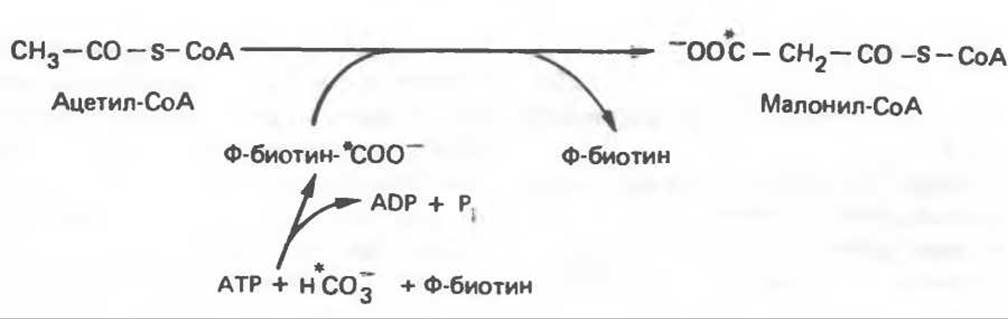
Рис. 23.5. Биосинтез малонил-СоА. Ф ацетил-СоА-карбоксилаза.
Имеются два типа синтазных комплексов, катализирующих биосинтез жирных кислот; оба находятся в растворимой части клетки. У бактерий, растений и низших форм животных, таких, как эвглена, все индивидуальные ферменты синтазной системы находятся в виде автономных полипептидов; ацильные радикалы связаны с одним из них, получившим название ацилпереносящий белок (АПБ). У дрожжей, млекопитающих и птиц синтазная система представляет собой полиферментный комплекс, который нельзя разделить на компоненты, не нарушив его активности, а АПБ является частью этого комплекса. Как АПБ бактерий, так и АПБ полиферментного комплекса содержат витамин пантотеновую кислоту в виде 4'-фосфопантетеина (см. рис. 17.6). В синтазной системе АПБ выполняет роль СоА. Синтазный комплекс, катализирующий образование жирных кислот, является димером (рис. 23.6). У животных мономеры идентичны и образованы одной полипептидной цепью, включающей 6 ферментов, катализирующих биосинтез жирных кислот, и АПБ с реакционноспособной SH-группой, принадлежащей 4'-фосфопантетеину. В непосредственной близости от этой группы расположена другая сульфгидрильная группа, принадлежащая остатку цистеина, входящего в состав 3-кетоацил-синтазы (конденсирующего фермента), которая входит в состав другого мономера (рис. 23.6). Поскольку для проявления синтазной активности необходимо участие обеих сульфгидрильных групп, синтазный комплекс активен только в виде димера.
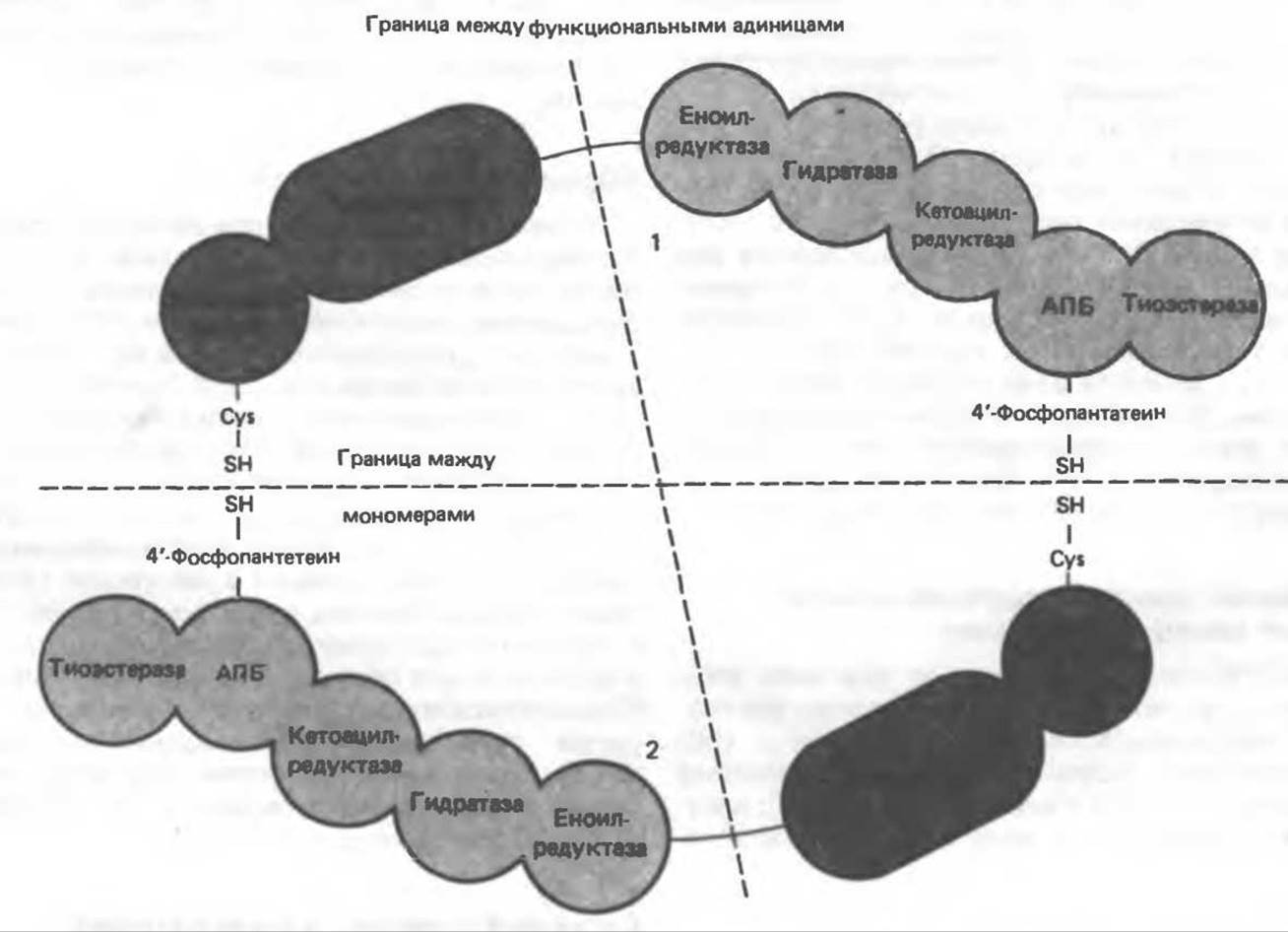
Рис. 23.6. Полиферментный комплекс, катализирующий синтез жирных кислот. Комплекс представляет собой димер, состоящий из двух идентичных полипептидных мономеров 1 и 2. Каждый мономер включает 6 индивидуальных ферментов и ацилпереносящий белок (АПБ). Cys—SH—тиоловая группа цистеина. Сульфгидрильная группа 4'-фосфопантетеина одного мономера расположена в непосредственной близости от такой же группы остатка цистеина кетоацил-синтетазы, входящей в состав другого мономера; это указывает на расположение мономеров по типу «голова к хвосту». Последовательность расположения ферментов в мономерах окончательно не уточнена и здесь приводится по данным Цукамото (Tsukamoto). Каждый из мономеров включает все ферменты, катализирующие биосинтез жирных кислот; он не является, однако, функциональной единицей (в состав последней входят фрагменты обоих мономеров, при этом половина одного мономера взаимодействует с «комплементарной» половиной другого). Синтазный комплекс одновременно синтезирует две молекулы жирных кислот.
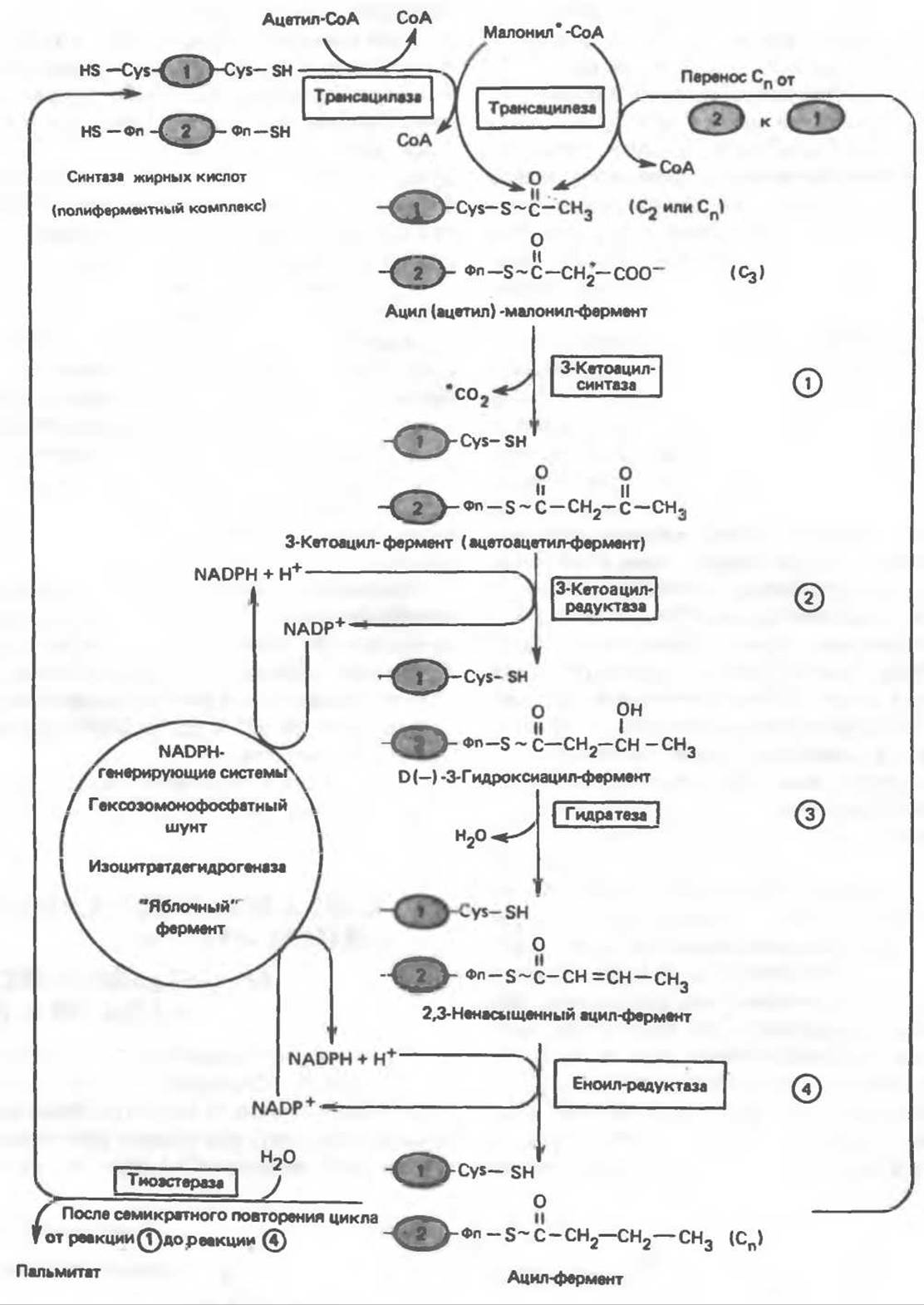
Рис. 23.7. Биосинтез длинноцепочечных жирных кислот. Показано, как присоединение одної о малонильного остатка приводит к удлинению ацильной цепи на 2 углеродных агома. Cys — остаток цистеина; Фп — 4 фосфопантетеин. Строение синтазы жирных кислот показано на рис. 23.6. ① и ②- индивидуальные мономеры синтазы жирных кислот. На одном димере одновременно синтезируются 2 ацильные цепи, при этом используется 2 пары — SH-групп; в каждой паре одна из групп принадлежит Фп, а другая - Cys.
На первом этапе процесса инициирующая молекула ацетил-СоА при участии трансацилазы взаимодействует с —SH-группой цистеина (рис. 23.7). Малонил-СоА под действием того же фермента (трансацилазы) взаимодействует с соседней —SH-группой, принадлежащей 4'-фосфопантетеину, локализованному в АПБ другого мономера. В результате этой реакции образуется ацетил (ацил) малонил-фермент. 3-Кетоацнлсинтаза катализирует взаимодействие ацетильной группы фермента с метиленовой группой малонила и высвобождение СО2, в результате образуется 3-кетоацил-фермент (ацетоацетил-фермент); при этом освобождается сульфгидрильная группа цистеина, ранее занятая ацетильной группой. Декарбоксилирование позволяет реакции пройти до конца и является движущей силой биосинтеза. 3-Кетоацильная группа восстанавливается, затем дегидратируется и вновь восстанавливается, в результате образуется соответствующий насыщенный ацил-S-фермент. Эти реакции сходны с соответствующими реакциями ß-окисления; отличие заключается, в частности, в том, что при биосинтезе образуется D(—)-изомер 3-гидроксикислоты, а не L(+)-изомер, кроме того, NADPH, а не NADH является донором водорода в реакциях восстановления. Далее новая молекула малонил-СоА взаимодействует с —SH-группой фосфопантетеина, при этом насыщенный ацильный остаток перемещается на свободную —SH-группу цистеина. Цикл реакций повторяется еще 6 раз, и каждый новый остаток малоната встраивается в углеродную цепь, до тех пор пока не образуется насыщенный 16-углеродный ацилрадикал (пальмитоил). Последний высвобождается из полиферментного комплекса под действием шестого фермента, входящего в состав комплекса,—тиоэстеразы (деацилазы). Свободная пальмитиновая кислота, прежде чем вступить в другой метаболический путь, должна перейти в активную форму ацил-СоА-производного. Затем активированный пальмитат обычно подвергается эстерификации с образованием ацилглицеролов (рис. 23.8).
В молочной железе имеется особая тиоэстераза, специфичная к ацильным остаткам С8-, С10- или С12-жирных кислот, входящих в состав липидов молока. В молочной железе жвачных животных этот фермент входит в состав синтазного комплекса, катализирующего образование жирных кислот.
По-видимому, в одном димерном синтазном комплексе имеются 2 активных центра, функционирующие независимо друг от друга, в результате одновременно образуются 2 молекулы пальмитиновой кислоты.
Объединение всех ферментов рассматриваемого метаболического пути в единый полиферментный комплекс обеспечивает его высокую эффективность и устраняет конкуренцию других процессов, в результате достигается эффект компартментации данного пути в клетке без участия дополнительных барьеров проницаемости.
Ниже приводится суммарная реакция биосинтеза пальмитиновой кислоты из ацетил-СоА и малонил-СоА:
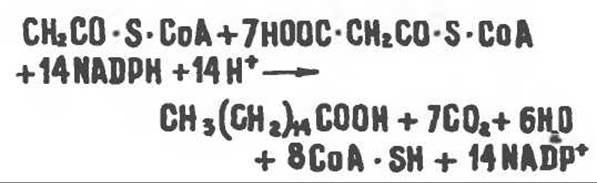
Из молекулы ацетил-СоА, выступающей в качестве затравки, образуются 15-й и 16-й углеродные атомы пальмитиновой кислоты. Присоединение всех последующих двухуглеродных фрагментов происходит за счет малонил-СоА-производного. В печени и молочной железе млекопитающих в качестве затравки может служить бутирил-СоА. Если в качестве затравки выступает пропионил-СоА, то синтезируются длинноцепочечные жирные кислоты с нечетным числом атомов углерода. Такие жирные кислоты характерны в первую очередь для жвачных животных, у которых пропионовая кислота образуется в рубце под действием микроорганизмов.

Рис. 23.8. Судьба пальмитата.
Источники восстановительных эквивалентов и ацетил-СоА. В реакции восстановления как 3-кетоацил-, так и 2,3-ненасыщенных ацил-произодных в качестве кофермента используется NADPH. Водород, необходимый для восстановительного биосинтеза жирных кислот, образуется в ходе окислительных реакций пентозофосфатного пути. Важно отметить, что ткани, в которых активно функционирует пентозофосфатный путь, способны эффективно осуществлять липогенез (например, печень, жировая ткань и молочная железа в период лактации). Кроме того, оба метаболических пути протекают в клетке вне митохондрий, поэтому переходу NADPH/NADP от одного метаболического пути к другому не препятствуют мембраны или другие барьеры. Другими источниками NADPH являются реакция превращения малата в пируват, катализируемая «яблочным» ферментом (NADP-малатдегидрогеназой) (рис. 23.9), а также внемитохондриальная реакция, катализируемая изоцитратдегидрогеназой (вероятно, роль ее незначительна).
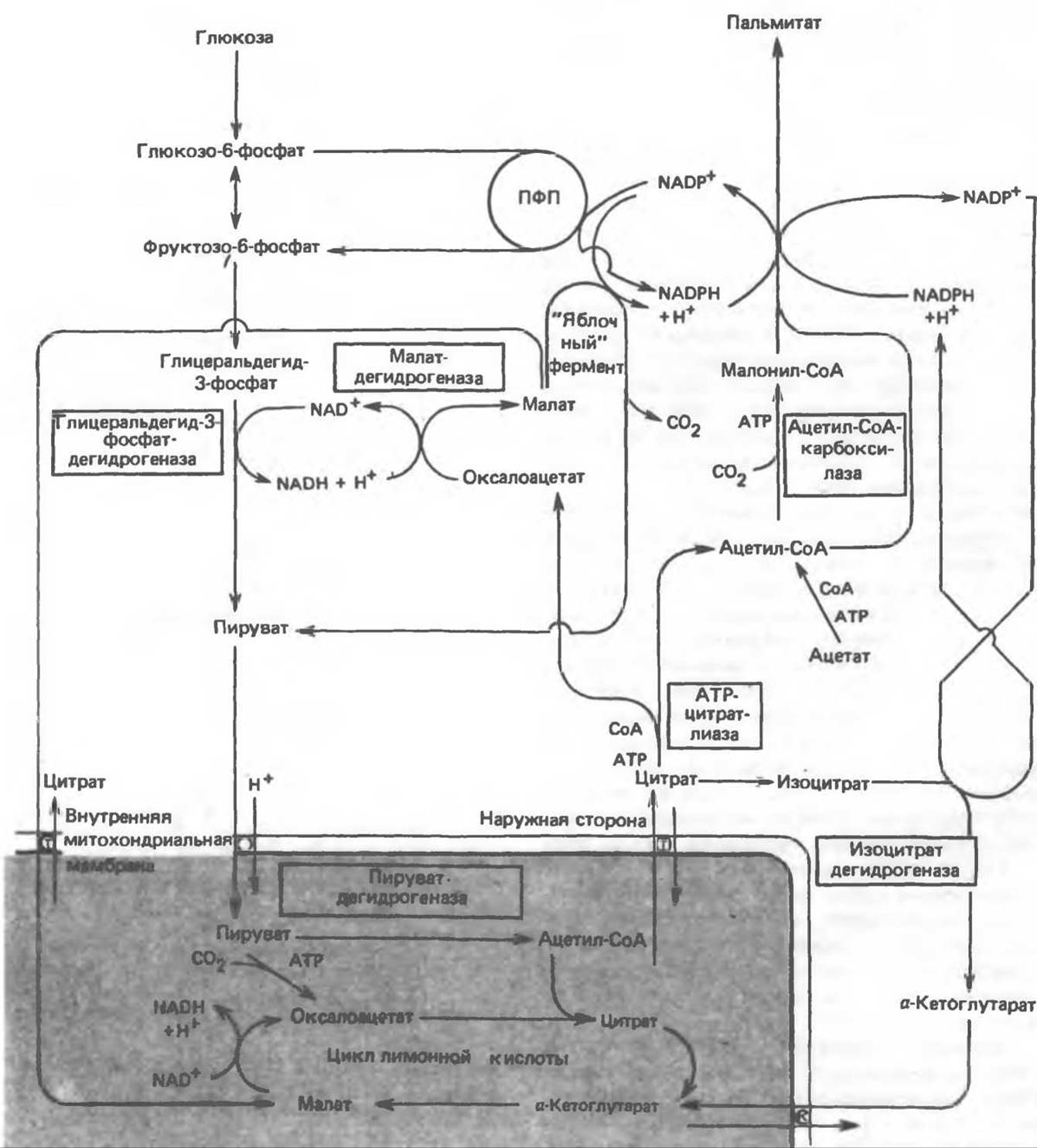
Рис. 23.9. Источники ацетил-СоА и NADPH для липогенеза. ПФП — пентозофосфатный путь: Т трикарбоксилат-переносящая система; К а-кетоглутарат-переносящая система
Ацетил-СоА, являющийся строительным блоком для синтеза жирных кислот, образуется в митохондриях из углеводов в результате окисления пирувата. Однако ацетил-СоА не может свободно проникать во внемитохондриальный компартмент — главное место биосинтеза жирных кислот. Активности внемитохондриальной АТР-цитрат-лиазы и «яблочного» фермента при хорошем питании увеличиваются параллельно активностям ферментов, участвующих в биосинтезе жирных кислот. В настоящее время полагают, что путь использования пирувата в процессе липогенеза проходит через стадию образования цитрата. Этот метаболический путь включает гликолиз, затем окислительное декарбоксилирование пирувата до ацетил-СоА в митохондриях и последующую реакцию конденсации с оксалоацетатом с образованием цитрата, который является компонентом цикла лимонной кислоты. Далее цитрат перемещается во внемитохондриальный компартмент, где АТР-цитрат-лиаза в присутствии СоА и АТР катализирует его расщепление на ацетил-СоА и оксалоацетат. Ацетил-СоА превращается в малонил-СоА (рис. 23.5) и включается в биосинтез пальмитиновой кислоты (рис. 23.9). Оксалоацетат под действием NADH-зависимой малатдегидрогеназы может превращаться в малат, затем в результате реакции, катализируемой «яблочным» ферментом, происходит образование NADPH, который поставляет водород для пути липогенеза. Данный метаболический процесс обеспечивает перенос восстановительных эквивалентов от внемитохондриального NADH к NADP. В альтернативном случае малат может транспортироваться в митохондрии, где превращается в оксалоацетат. Следует подчеркнуть, что для работы цитрат(трикарбоксилат)-транспортирующей системы митохондрий необходим малат, который обменивается на цитрат (см. рис. 13.16).
У жвачных содержание АТР-цитрат-лиазы и «яблочного» фермента в тканях, осуществляющих липогенез, незначительно. Это связано, по-видимому, с тем, что у этих животных основным источником ацетил-СоА является ацетат, образующийся в рубце. Поскольку ацетат активируется до ацетил-СоА внемитохондриально, ему не нужно проникать в митохондрии и превращаться в цитрат, прежде чем включиться в путь биосинтеза длинноцепочечных жирных кислот. У жвачных животных из-за низкой активности «яблочного» фермента особое значение приобретает образование NADPH, катализируемое внемитохондриальной изоцитратдегидрогеназой.

Рис. 23.10. Микросомальная система удлинения цепи жирной кислоты (элонгазная система).
Микросомальная система удлинения цепей жирных кислот (элонгаза)
Микросомы, по-видимому, являются основным местом, где происходит удлинение, длинноцепочечных жирных кислот. Ацил-СоА-производные жирных кислот превращаются в соединения, содержащие на 2 атома углерода больше; малонил-СоА является донором ацетильной группы, a NADPH — восстановителем. Промежуточными соединениями рассматриваемого пути являются тиоэфиры СоА. Затравочными молекулами могут служить насыщенные (С10 и выше) и ненасыщенные жирные кислоты. При голодании процесс удлинения цепей жирных кислот затормаживается. При образовании миелиновых оболочек нервных клеток в мозгу резко усиливается процесс удлинения стеарил-СоА, в результате образуются С22- и С24-жирные кислоты, входящие в состав сфинголипидов (рис. 23.10).
Литература
Boyer Р. D. (ed.). The Enzymes, 3rd ed., Vol. 16 of Lipid Enzymology, Academic Press, 1983.
Debeer L. J., Mannaerts G. P. The mitochondrial and peroxisomal pathways of fatty acid oxidation in rat liver, Diabete Metab. (Paris), 1983, 9, 134.
Goodridge A.G. Fatty acid synthesis in eukaryotes, Page 143. In: Biochemistry of Lipids and Membranes, Vance D. E., Vance J. E. (eds.), Benjamin/Cummings, 1985.
Gurr M.I., James A. I. Lipid Biochemistry: An Introduction, 3rd ed., Wiley, 1980.
Pandе S. V., Parvin R. Page 143. In: Carnitine Biosynthesis, Metabolism, and Functions, Frenkel R. A., McGarry J. D. (eds.), Academic Press, 1980.
Schulz H. Oxidation of fatty acids, Page 116. In: Biochemistry of Lipids and Membranes, Vance D. E., Vance J. E. (eds.), Benjamin/Cummings, 1985.
Singh N.. Wakil S.J., Stoops J.K. On the question of halfor fullsite reactivity of animal fatty acid synthetase, J. Biol. Chem., 1984, 259, 3605.
Tsukamoto Y. et al. The architecture of the animal fatty acid synthetase complex, J. Biol. Chem., 1983, 258, 15312.
Various authors. Disorders characterized by evidence of abnormal lipid metabolism. In: The Metabolic Basis of Inherited Disease, 5th ed., Stanbury J. B. et al. (eds.), McGraw-Hill, 1983.