Биохимия человека Том 1 - Марри Р. 1993
Биоэнергетика и метаболизм углеводов и липидов
Метаболизм ацилглицеролов и сфинголипидов
Метаболизм ацилглицеролов
Катаболизм триацилглицеролов
Путь катаболизма триацилглицеролов начинается с их гидролиза до жирных кислот и глицерола под действием липазы; в основном этот процесс происходит в жировой ткани. Высвободившиеся жирные кислоты поступают в плазму крови, где связываются сывороточным альбумином. Затем свободные жирные кислоты переходят в ткани, где они либо окисляются, либо вновь подвергаются эстерификации. Ткани многих органов (печени, сердца, почек, мышц, легких, семенников, мозга), а также жировая ткань способны окислять длинноцепочечные жирные кислоты. Однако поступление этих кислот в клетки мозга затруднено. Что касается судьбы глицерола, то она зависит от того, присутствует ли в данной ткани необходимый активирующий фермент — глицеролкиназа (рис. 25.1). Значительное количество этого фермента обнаружено в печени, почках, кишечнике, бурой жировой ткани и в молочных железах в период лактации.
Биосинтез ацилглицеролов
Хотя в лабораторных условиях можно осуществить реакции, обратные реакциям расщепления триацилглицеролов, в организме биосинтез ацилглицеролов протекает иным путем. Перед образованием ацилглицеролов глицерол и жирные кислоты должны быть активированы при участии АТР. Глицеролкиназа катализирует фосфорилирование глицерола, в результате образуется sn-глицерол-3-фосфат. При отсутствии данного фермента или при его низкой активности, как это имеет место в мышцах и жировой ткани, большая часть глицерол-3-фосфата должна образовываться из промежуточного соединения гликолитического пути — дигидроксиацетонфосфата, восстановление которого за счет NADH до глицерол-3-фосфата катализируется глицерол-3-фосфатдегидрогеназой (рис. 25.1).
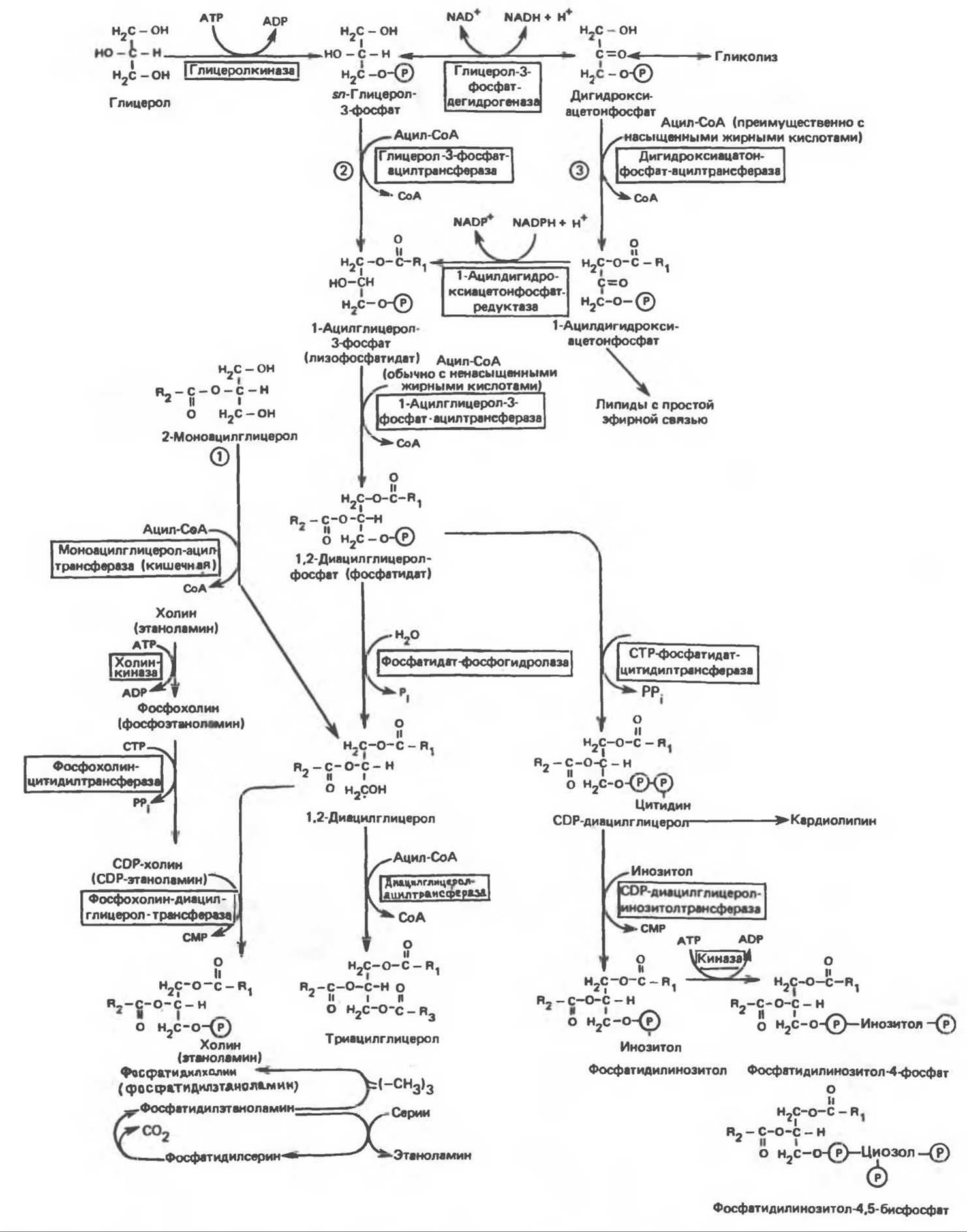
Рис. 25.1. Биосинтез триацилглицеролов и фосфолипидов. 1 — моноацилглицeроловый путь; 2— глицеролфосфатный путь; 3 — диоксиацетонфосфатный путь. Фосфоэтаноламин-диацилглицерол-трансфераза отсутствует в печени.
А. Триацилглицерол. Жирные кислоты активируются в результате взаимодействия с СоА с образованием ацил-СоА; реакция катализируется ацил-СоА-синтетазой и протекает с участием АТР. Две молекулы ацил-СоА взаимодействуют с глицерол-3-фосфатом, в результате образуется 1,2-диацилглицеролфосфат (фосфатидат). Этот процесс протекает в две стадии. Сначала глицерол-3-фосфат — ацилтрансфераза катализирует образование лизофосфатидата, а затем 1-ацилглицерол-3-фосфат — ацилтрансфераза (лизофосфатидат — ацилтрансфераза) катализирует образование фосфатидата. Далее фосфатидат гидролизуется фосфатидат — фосфогидролазой до 1,2-диацилглицерола. В слизистой оболочке кишечника функционирует путь образования 1,2-диацилглицерола из моноацилглицерола, реакция катализируется моноацилглицерол-ацилтрансферазой. Далее 1,2-диацилглицерол ацилируется третьей молекулой ацил-СоА и превращается в триацилглицерол (эта реакция катализируется диацилглицерол-ацилтрансферазой). Большинство ферментов данного пути находятся в эндоплазматическом ретикулуме, и только некоторые, например глицерод-3-фосфат — ацилтрансфераза, в митохондриях. Фосфатидатфосфогидролазная активность обнаруживается главным образом в супернатантной фракции, часть ее связана с мембранами.
Дигидроксиацетонфосфат может ацилироваться и превращаться в лизофосфатидат путем востановления с участием NADPH. Относительно значения этого пути еще нет единого мнения. По-видимому, он играет важную роль в пероксисомах, где участвует в биосинтезе липидов с простой эфирной связью.
Б. Фосфоглицеролы. Эти фосфолипиды образуются либо из фосфатидата (например, фосфатидилинозитол), либо из 1,2-диацилглицерола (например, фосфатидилхолин и фосфатидилэтаноламин). При синтезе фосфатидилинозитола цитидинтрифосфат (СТР) взаимодействует с фосфатидатом с образованием цитидиндифосфатдиацилглицерола (CDP- диацилглицерол), который при участии фермента CDP-диацилглицерол — инозитолтрансферазы реагирует с инозитолом, в результате чего образуется фосфатидилинозитол (рис. 25.1). Последовательное фосфорилирование фосфатидилинозитола приводит к образованию сначала фосфатидилинозитол-4-фосфата, а затем фосфатидилинозитол-4,5-бисфосфата. Последний гидролизуется с образованием диациглицерола и инозитолтрифосфата (процесс запускается гормонами, в частности вазопрессином, которые повышают концентрацию Са2+). Эти два продукта действуют как вторые посредники при действии гормонов (рис. 44.5).
В процессе биосинтеза фосфатидилхолина и фосфатидилэтаноламина (лецитина и кефалина) холин и этаноламин должны сначала перейти в активную форму. На первой стадии процесса в результате реакции с АТР образуется соответствующий монофосфат, который затем реагирует с СТР, в результате чего образуется либо цитидиндифосфохолин (CDP- холин), либо цитидиндифосфоэтаноламин (CDP-этаноламин). В такой активной форме холин (или этаноламин) вступает в реакцию с 1,2-диацилглицеролом; происходит перенос фосфорилированного основания (фосфохолина или фосфоэтаноламина) на диацилглицерол и образуется либо фосфатидилхолин, либо фосфатидилэтаноламин. Регуляторным ферментом на пути образования фосфатидилхолина является, по-видимому, цитидилтрансфераза.
Фосфатидилсерин синтезируется путем прямого взаимодействия фосфатидилэтаноламина и серина. Фосфатидилсерин может декарбоксилироваться, в результате образуется фосфатидилэтаноламин. В печени существует альтернативный путь, по которому фосфатидилхолин синтезируется из фосфатидилэтаноламина путем последовательного метилирования остатка этаноламина с участием S-аденозилметионина в качестве донора метильных групп.
В митохондриях присутствует фосфолипид кардиолипин (дифосфатидилглицерол). Он образуется из фосфатидилглицерола, который в свою очередь синтезируется из CDP-диацилглицерола (рис. 25.1) и глицерол-3-фосфата, как показано на схеме, приведенной на рис. 25.2.

Рис. 25.2. Биосинтез кардиолипина.
Сурфактант (поверхностно-активное вещество) легких представляет собой секрет, обладающий высокими поверхностно-активными свойствами, который препятствует спадению легочных альвеол. Эти свойства сурфактанта объясняются главным образом присутствием в нем фосфолипида дипальмитоилфосфатидилхолина, который образуется в легких доношенного плода непосредственно перед родами. Недостаток этого соединения в легких недоношенных детей является причиной расстройства у них дыхания.
В. Глицерофосфолипиды с простой эфирной связью и плазмалогены. Предшественниками плазмалогенов являются диацилглицеролы, содержащие в положении 1 (или 2) алкенильный остаток, образующий альдегидогенную эфирную связь. Предшественником глицеролового фрагмента является дигидроксиацетонфосфат (рис. 25.3); взаимодействуя с ацил-СоА, он превращается в 1-ацилдигидроксиацетон-фосфат. Затем происходит замещение ацильной группы на алкоксигруппу длинноцепочечного спирта с образованием 1-алкилдигидроксиацетонфосфата, содержащего простую эфирную связь; последний в присутствии NADPH превращается в 1- алкилглицерол-3-фосфат. Последующее ацилирование в положении 2 приводит к образованию 1-алкил, 2-ацилглицерол-3-фосфата (аналог фосфатидата, рис. 25.1), который гидролизуется до 1-алкил, 2- ацилглицерола (рис. 25.3). Плазмалогены образуются путем дегидрирования соответствующего производного 3-фосфоэтаноламина (рис. 25.3). В митохондриях большинство фосфолипидов представлено плазмалогенами. Тромбоцит-активирующий фактор (ТАФ) синтезируется из соответствующего производного 3-фосфохолина и идентифицирован как 1-алкил-2-ацетил-sn-глицерол-3-фосфохолин. Он образуется в большинстве клеток крови, а также ряда тканей и при концентрации порядка 10-1 моль∙л-1 вызывает агрегацию тромбоцитов. ТАФ вызывает также снижение кровяного давления.
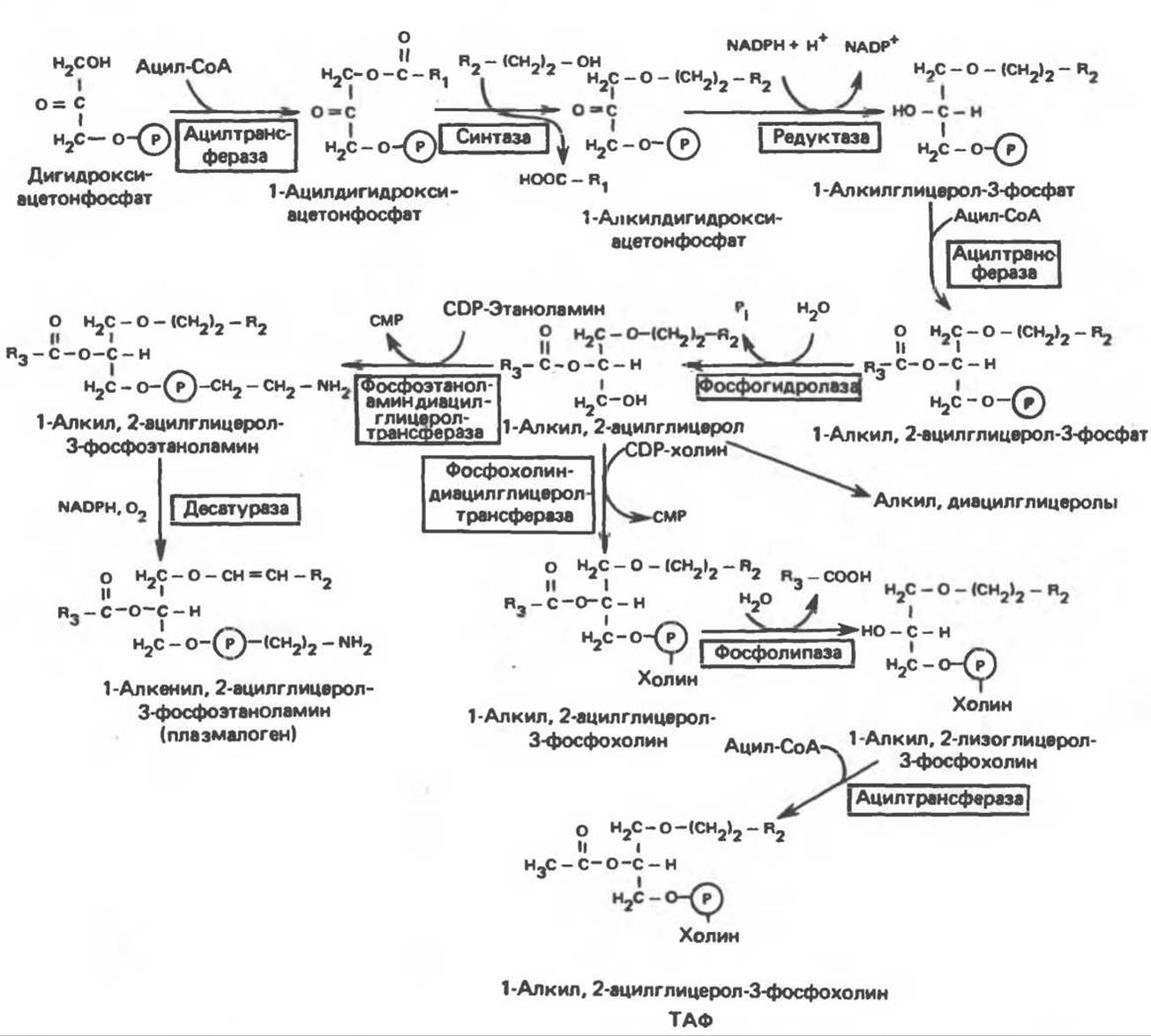
Рис. 25.3. Биосинтез липидов с простой эфирной связью, плазмалогенов и тромбоцит-активирующего фактора (ТАФ).
Распад и обновление глицерофосфолипидов
Многие сложные молекулы, например молекулы белков, расщепляются в тканях полностью. Поэтому для них можно определить время обновления. Фосфолипиды также активно распадаются, но в этом случае для каждой части молекулы время обновления различно. Например, время обновления фосфатной группы отличается от времени обновления 1-ацильной группы; это обусловлено наличием ферментов, вызывающих частичный гидролиз фосфолипидов, вслед за которым может снова происходить их синтез (рис. 25.4). Фосфолипаза А2 катализирует гидролиз эфирной связи в положении 2 глицерофосфолипидов, в результате чего образуются свободная жирная кислота и лизофосфолипид, который в свою очередь реацилируется ацил-СоА при участии ацилтрансферазы. В альтернативном варианте лизофосфолипид (например, лизолецитин) атакуется лизофосфолипазой (фосфолипазой В), при этом отщепляется оставшаяся 1-ацильная группа и образуется соответствующее глицеролфосфорильное основание. Последнее в свою очередь может расщепляться гидролазой до глицерол-3-фосфата и основания. Фосфолипаза А, атакует эфирную связь фосфолипидов в положении 1 (рис. 25.5), а фосфолипаза С — в положении 3 (в последнем случае образуется 1,2-диацилглицерол и фосфорильное основание). Фосфолипаза С является одним из главных бактериальных токсинов. Фосфолипаза D, встречающаяся главным образом у растений, катализирует отщепление от фосфолипида азотистого основания.

Рис. 25.4. Метаболизм фосфатидилхолина (лецитина).

Рис. 25.5. Эфирные связи фосфолипидного субстрата, гидролизуемые фосфолипазами.
Лизолецитин может синтезироваться по альтернативному пути с участием лецитин: холестерол ацилтрансферазы (ЛXTА). Этот фермент, находящийся в плазме крови и образующийся в печени, катализирует перенос остатка жирной кислоты из положения 2 молекулы лецитина на холестерол, в результате образуется сложный эфир холестерола. Считается, что именно под действием ЛХТА синтезируется большая часть сложных эфиров холестерола — компонентов липопротеинов плазмы крови. Последствия недостатка ЛХАТ обсуждаются на с. 281.

В фосфолипидах длинноцепочечные насыщенные жирные кислоты находятся главным образом в положении 1, в то время как полиненасыщенные жирные кислоты (например, предшественники простагландинов) — чаще всего в положении 2. Включение жирных кислот в молекулу лецитина происходит при полном синтезе фосфолипида, при трансацилировании между эфиром холестерола и лизолецитином, а также при прямом ацилировании лизолецитина ацил-СоА. Таким образом может происходить постоянное обновление жирных кислот, особенно важным является включение в молекулы фосфолипидов незаменимых жирных кислот.