Биохимия человека Том 1 - Марри Р. 1993
Метаболизм белков и аминокислот
Катаболизм азота аминокислот
Транспорт аммиака
Хотя аммиак может экскретироваться из организма в виде аммонийных солеи — особенно при метаболическом ацидозе, — большая его часть выделяется в составе мочевины, главного азотистого компонента мочи. Аммиак постоянно продуцируется в тканях, однако содержится в периферической крови лишь в следовых количествах (10—20 мкг/100 мл); он быстро удаляется из кровеносной системы печенью, где входит в состав глутамата, глутамина или мочевины.
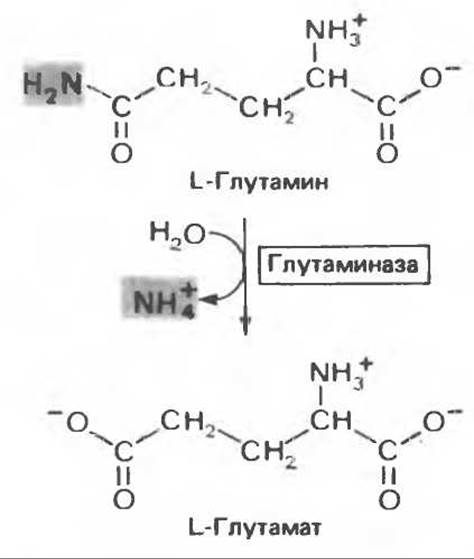
Рис. 30.7. Реакция, катализируемая глутаминазой, практически необратима и протекает в направлении образования глутамата и NH+4. Следует подчеркнуть, что из глутамина удаляется амидный азот, а не азот а-аминогруппы.

Рис. 30.8. Реакция, катализируемая глутаминсинтетазой. Равновесие реакции благоприятно для синтеза глутамина.
Об удалении аммиака с помощью глутаматдегидрогеназы уже упоминалось. Образование глутамина катализируется глутаминсинтетазой (рис. 30.8) — митохондриальным ферментом, присутствующим в больших количествах в ткани почек. Синтез амидной связи глутамина осуществляется за счет гидролиза одного эквивалента АТР с образованием ADP и Pi. Равновесие этой реакции смещено в направлении синтеза глутамина (см. также гл. 29).
Освобождение амидного азота глутамина в виде аммиака происходит путем гидролитического отщепления аммиака, катализируемого глутаминазой (рис. 30.7). Глутаминазная реакция в отличие от реакции, катализируемой глутаминсинтетазой, протекает без участия адениновых нуклеотидов и сильно сдвинута в сторону образования глутамата; в направлении синтеза глутамина она не осуществляется. Таким образом, глутаминсинтетаза и глутаминаза катализируют взаимопревращение свободного аммонийного иона и глутамина (рис. 30.9); это напоминает взаимопревращение глюкозы и глюкозо-6-фосфата с помощью глюкокиназы и глюкозоб-фосфатазы (см. гл. 17).
Реакция, аналогичная той, которая катализируется глутаминазой, происходит при участии L-аспарагиназы, присутствующей в тканях животных, растениях и микроорганизмах. Исследовалась возможность применения аспарагиназы и глутаминазы в качестве противоопухолевых агентов, поскольку некоторые опухоли проявляют аномально высокую потребность в глутамине и аспарагине.
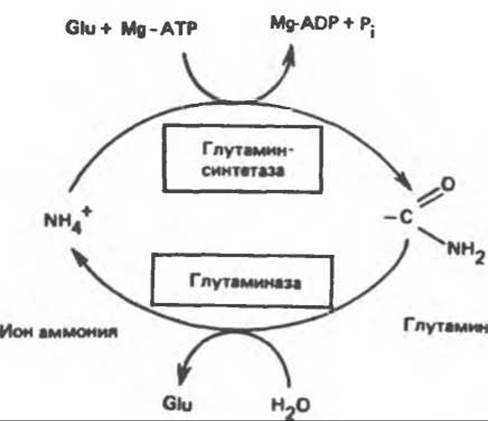
Рис. 30.9. Взаимопревращение аммиака и глутамина, катализируемое глутаминсинтетазой и глутаминазой. Обе реакции идут преимущественно в направлении, указанном стрелками. Таким образом, глутаминаза служит только для дезамидирования глутамина, а глутаминсинтетаза — только для синтеза глутамина из глутамата. Glu - глутамат.
Если в ткани мозга основной путь удаления аммиака состоит в образовании глутамина, то в печени наиболее важным путем является образование мочевины. В ткани мозга тоже может идти образование мочевины, но существенной роли в удалении аммиака этот процесс не играет. Образованию глутамина в мозгу должен предшествовать синтез глутамата, поскольку поступающего с током крови глутамата оказывается недостаточно при высокой концентрации в крови аммиака. Непосредственным предшественником глутамата является а-кетоглутарат. Образование глутамина из аммиака может привести к быстрому снижению концентраций интермедиатов цикла лимонной кислоты, если они не будут пополняться за счет превращения пирувата в оксалоацетат, сопровождающегося фиксацией СО2 (см. гл. 17). В ткани мозга действительно наблюдается существенное включение в состав аминокислот СO2, вероятно, после вступления последнего в цикл лимонной кислоты; после введения аммиака дополнительное количество оксалоацетата направляется на синтез глутамина (через стадию а-кетоглутарата).