Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Аминокислоты
Методы разделения аминокислот
Хроматография
При всех хроматографических методах разделения молекулы распределяются между стационарной и подвижной фазами (табл. 3.6). Разделение зависит от относительной способности содержащихся в смеси молекул к более прочной ассоциации с одной или другой фазой.
Здесь мы рассмотрим в основном методы разделения аминокислот, однако применение этих методов ни в коей мере не ограничивается данными молекулами.
Хроматография на бумаге
Сейчас этот метод в значительной мере вытеснен более совершенными методами, однако он все же применяется для разделения аминокислот. Образцы наносят на бумагу в заранее отмеченную точку, отступив примерно 5 см от верхнего края полоски фильтровальной бумаги. Затем полоску подвешивают в закрытом сосуде, на дно которого налита смесь растворителей (рис. 3.9).
Для разделения аминокислот используют полярные растворители в виде бинарных, тройных и более сложных смесей воды, спиртов, кислот и оснований. Более полярные компоненты растворителя ассоциируются с целлюлозой и образуют стационарную фазу, а менее полярные составляют подвижную фазу. Это — нормальная распределительная хроматография. В распределительной хроматографии с обращенной фазой полярная и неполярная фазы меняются местами (для этого, например, бумагу предварительно погружают в раствор силикона). Распределительная хроматография с обращенной фазой используется для разделения неполярных пептидов или липидов; для таких полярных соединений, как аминокислоты, она непригодна. Растворитель перемещается по бумаге вверх или вниз (восходящая или нисходящая хроматография). Когда он доходит почти до конца, полоску вынимают из сосуда, высушивают и обрабатывают определенным образом, чтобы на ней проявились интересующие исследователя соединения (при разделении аминокислот используют обработку 0,5%-ным нингидрином в ацетоне с последующим прогреванием в течение нескольких минут при 90—110˚). Аминокислоты с объемными неполярными боковыми цепями (Leu, Ile, Phe, Trp, Val, Met, Tyr) перемещаются быстрее, чем аминокислоты с более короткими неполярными боковыми цепями (Pro, Ala, Gly) или с полярными боковыми цепями (Thr, Glu, Ser, Arg, Asp, His, Lys, Cys) (рис. 3.10). Это обусловлено большей растворимостью полярных молекул в гидрофильной стационарной фазе и неполярных — в органических растворителях. Отметим, что в ряду неполярных аминокислот (Gly, Ala, Val, Leu) при увеличении длины неполярной боковой цепи, сопровождающемся усилением ее неполярного характера, увеличивается и подвижность аминокислоты.
Таблица 3.6. Физическое состояние фаз в хроматографических системах, используемых в биохимии
|
Хроматографическая система |
Стационарная фаза |
Подвижная фаза |
|
Распределительная хроматография на бумаге, в тонком слое порошка целлюлозы, на колонке с инертным носителем, покрытым тонким слоем жидкости; гель-фильтрация |
Жидкая |
Жидкая |
|
Ионообменная хроматография: адсорбция на тонких слоях или частицах, заполняющих колонку |
Твердая |
|
|
Распределительная хроматография (между тонким слоем жидкости на носителе и подвижным газом) |
Жидкая |
Газообразная |

Рис. 3.9. Устройство для хроматографии на бумаге (в нисходящем варианте).
Отношение расстояния, на которое перемещается данная аминокислота, к расстоянию, пройденному фронтом растворителя (оба они отсчитываются от точки нанесения смеси аминокислот), обозначают через Rf (подвижность по отношению к фронту растворителя). Значение Rf для данной аминокислоты зависит от условий эксперимента, например от типа растворителя. Хотя предварительную идентификацию аминокислоты можно провести исходя лишь из ее значения Rf, рекомендуется одновременно с неизвестной смесью проводить хроматографирование известной стандартной смеси аминокислот. В этом случае подвижность исследуемой аминокислоты можно отнести к подвижности стандарта (например, не Rf, а RАlа). Подвижности, выраженные относительно стандарта, меняются от эксперимента к эксперименту в меньшей степени, чем Rf.
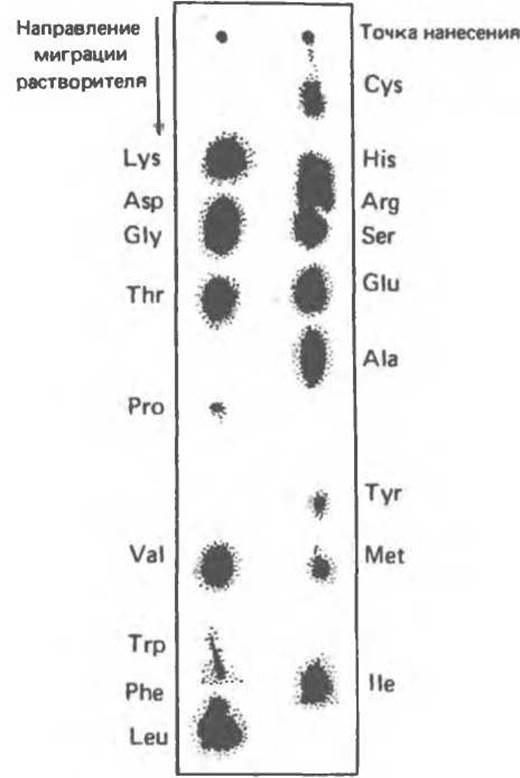
Рис. 3.10. Идентификация аминокислот, входящих в состав белков. После хроматографического разделения на бумаге с использованием в качестве растворителя системы бутанол/уксусная кислота (нисходящий вариант) аминокислоты окрашивают нингидрином.
Для количественного анализа аминокислот каждое пятно вырезают и элюируют (вымывают) вещество подходящим растворителем; затем проводят количественный колориметрический (нингидриновый) анализ. В другом варианте бумагу опрыскивают нингидрином и измеряют с помощью фотометра интенсивность окрашивания пятна в проходящем или отраженном свете.
При двумерной хроматографии на бумаге образец наносят на один из углов квадратного листа бумаги и проводят разделение в одной системе растворителей. Затем лист вынимают, высушивают, поворачивают его на 90° и хроматографируют в другом растворителе (рис. 3.11).
Тонкослойная хроматография
Имеются два четко различающихся варианта тонкослойной хроматографии. Распределительная тонкослойная хроматография (РТСХ) сходна с распределительной хроматографией на бумаге, а адсорбционная тонкослойная хроматография (АТСХ) основана на совершенно иных принципах.

Рис. 3.11. Двумерная хроматограмма аминокислот, входящих в состав белка (воспроизведена с некоторыми модификациями из работы Anal. Chem. 1953:25:396).
При проведении РТСХ на порошке целлюлозы или на других сравнительно инертных носителях можно использовать такие же системы растворителей и такие же проявляющие реагенты, как и при хроматографии на бумаге. Возможна и РТСХ с обращенной фазой.
Разделение с помощью АТСХ определяется способностью растворителя (этот растворитель не обязательно является бинарной или более сложной смесью) элюировать компоненты образца с места его адсорбции на активированном сорбенте, например на нагретом силикагеле. АТСХ применима для разделения таких неполярных соединений, как липиды, но не для разделения аминокислот и большинства пептидов.
Автоматическая ионообменная хроматография
Разделение аминокислот можно проводить разными методами, но для анализа аминокислотного состава полипептида после его гидролиза обычно используют автоматическую ионообменную хроматографию. Полное разделение аминокислот, их идентификация и количественная оценка занимают менее трех часов. В методе Мура и Штейна используют короткую и длинную колонки, заполненные смолой из сульфонированного полистирола в Na+-форме. Когда кислотный гидролизат при pH 2 наносят на колонку, аминокислоты связываются в результате катионного обмена с Na+. Далее колонку элюируют раствором цитрата натрия при заранее запрограммированных значениях pH и температуры. Короткую колонку элюируют одним буфером, длинную — двумя. Элюат обрабатывают нингидрином, измеряя интенсивность окраски с помощью проточного колориметра. Данные автоматически регистрируются на ленте самописца и могут передаваться в компьютер для вычисления площади под пиком (рис. 3.12).

Рис. 3.12. Автоматический анализ кислотного гидролизата эндосперма пшеницы по Муру и Штейну на колонках днуэкс-50 (при 55°С). А. Для идентификации основных аминокислот используется короткая колонка (5 х 0,9 см); элюирование проводят при pH 5,28, продолжительность опыта 60 мин. Б. Для разделения нейтральных и кислых аминокислот используется более длинная колонка (55 х 0,9 см); элюирование проводят сначала буфером с pH 3,25, а затем буфером с pH 4,25. В качестве внутреннего стандарта добавлен норлейцин. Основные аминокислоты остаются на колонке. Продолжительность опыта 180 мин. Элюируемые фракции автоматически обрабатывают нингидрином, после чего измеряют их оптическую плотность при 570 и 440 нм. Регистрация при длине волны 440 нм используется исключительно для идентификации пролика и гидроксипролина (в эндосперме пшеницы они отсутствуют). (С любезного разрешения Є. Т. Mertz, Purdue University.)
Высоковольтный электрофорез на инертных носителях
В биохимии широкое применение нашло разделение аминокислот, полипептидов и других амфолитов (молекул, суммарный заряд которых зависит от pH среды) под действием наложенного постоянного электрического поля. При разделении аминокислот в качестве инертных носителей чаще всего используют полоски бумаги или тонкие слои целлюлозного порошка. Разделение проводят в течение 0,5—2 ч при напряжении 2000—5000 В в зависимости от суммарных зарядов амфолитов и их молекулярных масс. Среди молекул, несущих одинаковый заряд, более легкие мигрируют быстрее. Но более важным параметром при разделении является суммарный заряд. Метод применяется для разделения аминокислот, низкомолекулярных пептидов, некоторых белков, нуклеотидов и сахарофосфатов. Образец помещают на носитель, смачивают буфером при соответствующем pH и соединяют с буферным резервуаром полоской фильтровальной бумаги. Бумагу прикрывают стеклянной пластинкой или погружают в углеводородный растворитель для охлаждения. В электрическом поле молекулы, несущие при данном pH отрицательный заряд, мигрируют к аноду, а те, которые несут положительный заряд, —к катоду. Далее высушенную электрофореграмму «проявляют» нингидрином (при работе с аминокислотами, пептидами) или измеряют поглощение в Уф-свете (при работе с нуклеотидами).
Выбор pH определяется значениями рК диссоциирующих групп, входящих в состав молекул смеси. При pH 6,4 глутамат и аспартат несут заряд — 1 и движутся к аноду; разделение их осуществляется благодаря различию в молекулярной массе. Лизин, аргинин и гистидин движутся в противоположном направлении, а все другие аминокислоты, входящие в состав белка, остаются вблизи места нанесения. При разделении пептидов, образовавшихся в результате ферментативного расщепления, уменьшение pH до 3,5 приводит к увеличению заряда катионных групп и обеспечивает лучшее разделение.
Литература
Barrett G. С. Chemistry and Biochemistry of the Amino Acids, Chapman and Hall, 1985.
Cooper T.G. The Tools of Biochemistry, Wiley, 1977.
Friedman M. The Chemistry and Biochemisrty of the Sulfhydryl Group in Amino Acids, Peptides, and Proteins, Pergamon Press, 1973.
Greenstein J.P., Winitz M. Chemictry of the Amino Acids, 3 vols, Wiley, 1961.
Heftman E. Chromatography: A Laboratory Handbook of Chromatographic and Electrophoretic Methods, 3rd ed., Van Nostrand, 1975.
Touchstone J. C. Practice of Thin Layer Chromatography, Wiley-Interscience, 1978.
Zweig G., Sherma J. Handbook of Chromatography, 2 vols, CRC Press, 1972.