Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: кинетика
Образование и распад переходных состояний
Рассмотрим реакцию замещения, в которой приходящая группа Y замещает уходящую группу X:
Y + R — X ⇄ Y — R + X.
Эта реакция состоит из двух полуреакций: 1) образование переходного состояния, в котором к группе R присоединен и Y, и X; 2) распад переходного состояния с образованием продуктов:
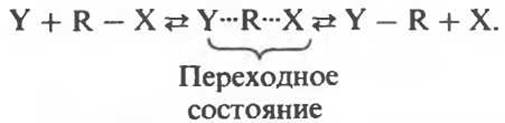
Каждая из полуреакций, как и любая другая химическая реакция, характеризуется определенным изменением свободной энергии. Обозначим через ∆GF изменение свободной энергии, связанное с образованием переходного состояния, а через ∆GD изменение свободной энергии, связанное с его распадом и образованием продуктов:
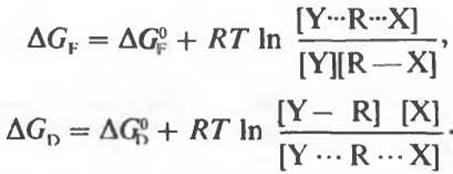
Суммарное изменение свободной энергии полной реакции, ∆С, равно сумме изменений свободной энергии каждой из полуреакций:
∆С = ∆СF + ∆CD.
Как и в любом уравнении, где есть два слагаемых, невозможно лишь по алгебраическому знаку и величине ∆С установить знак или величину ∆GF и ∆GD. Иначе говоря, мы не можем, зная изменение свободной энергии полной реакции ∆С, сказать что-либо об изменениях свободной энергии, связанных с образованием и распадом переходных состояний. Поскольку катализ теснейшим образом связан со значениями ∆GF и ∆GD, ясно, что термодинамические параметры полной реакции (∆G) ничего не говорят нам о пути реакции (т.е. о ее механизме). Этот вопрос и является предметом кинетики.