Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: кинетика
Теория столкновений
Кинетическая теория, или теория столкновений. основывается на двух ключевых положениях.
1. Для протекания реакции молекулы должны сталкиваться друг с другом, т.е. сближаться на расстояния, достаточные для образования связей.
2. Чтобы столкновение было продуктивным (т.е. приводило к протеканию реакции), реагирующие молекулы должны обладать энергией, достаточной для преодоления энергетического барьера.
Отсюда следует, что при наличии у реагирующих молекул достаточной энергии все факторы, повышающие частоту их столкновений, будут повышать скорость реакции. И наоборот, факторы, понижающие частоту столкновений молекул или их кинетическую энергию, снижают скорость реакции.
Если не все молекулы в популяции обладают энергией, достаточной для осуществления реакции, то повышение температуры, сопровождающееся увеличением кинетической энергии молекул, приведет к повышению скорости реакции. Эти положения схематически иллюстрирует рис. 8.4. В случае А ни одна из молекул, в случае Б — часть, а в случае В — все молекулы обладают кинетической энергией, достаточной для преодоления энергетического барьера.
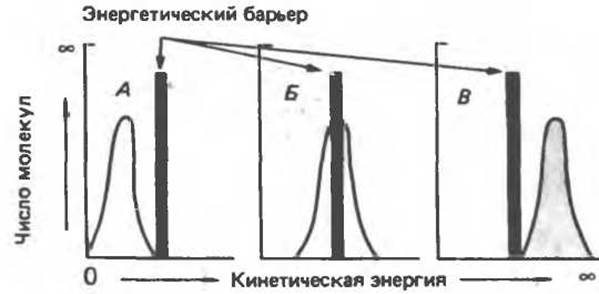
Рис. 8.4. Концепция энергетического барьера химической реакции.
В отсутствие ферментов многие химические реакции при температуре, характерной для живых клеток, идут исключительно медленно. Однако даже и при этой температуре молекулы находятся в движении и сталкиваются друг с другом. Правда, они не могут реагировать быстро, поскольку большинство из них не обладает достаточной кинетической энергией для преодоления энергетического барьера. При достаточно большом повышении температуры (т. е. при повышении кинетической энергии) реакция пойдет быстрее. То, что реакция вообще идет (т. е. протекает самопроизвольно), следует из условия ∆G < 0, но при низких температурах она идет медленно. Ферменты ускоряют реакции, протекающие самопроизвольно при условиях, преобладающих в живых клетках.