Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: кинетика
Роль катализаторов в образовании продуктивных переходных состояний
Рассмотрим профили реакций, различающихся только образованием двух разных переходных состояний (рис. 8.3).
В обоих случаях величина свободной энергии образования переходного состояния характеризует энергетический барьер полной реакции. Но энергетический барьер реакции, проходящей через переходное состояние [Y...R...X]b, ниже, чем энергетический барьер реакции, проходящей через переходное состояние [Y...R...X]a. В приведенном выше примере [Y...R...X]a представляет собой переходное состояние некатализируемой реакции, тогда как [Y...R...Х]b — это переходное состояние катализируемой реакции. Все катализаторы, включая и ферменты, уменьшают свободную энергию образования переходного состояния ∆GF. Заметим далее, что на величину ∆G катализатор не влияет: изменение свободной энергии полной реакции не зависит от присутствия катализаторов. Константа равновесия химической реакции является функцией изменения стандартной свободной энергии этой реакции:
∆G0 = —RT In Keq
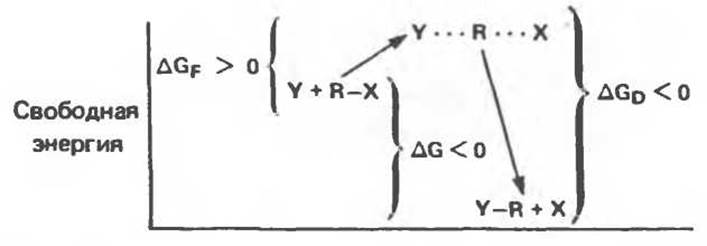
Рис. 8.1. Энергетический профиль реакции замещения, для которой характерно отрицательное изменение свободной энергии (∆G < 0).
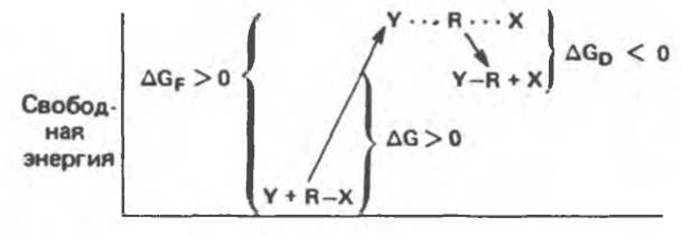
Рис. 8.2. Энергетический профиль реакции замещения, для которой характерно положительное изменение свободной энергии (∆G > 0).

Рис. 8.3. Энергетические профили реакции, в ходе которых могут образовываться два разных переходных состояния. [Y...R...Х]а и [Y...R...X]b ∆GaF и ∆GFb — свободная энергия образования указанных комплексов.
Отсюда следует, что ферменты и другие катализаторы не влияют на константу равновесия реакции.