Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Количественная оценка прочности связывания
Микроскопические константы связывания
Микроскопическая константа относится к определенному центру связывания. Рассмотрим, например, связывание протона с карбоксилат-ионом:
![]()
Константа ассоциации2 Kf ≈ 6∙104(lgKf = 4,8). Поскольку карбоксилат-ион обладает только одним центром связывания, наблюдаемая величина Kfи является микроскопической константой связывания.
Рассмотрим теперь анион пиридоксина, обладающий двумя основными центрами связывания, а именно —О- и N3).
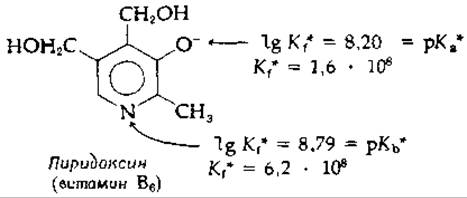
Протон может присоединиться к каждому из этих двух центров, однако микроскопические константы связывания К*f для этих центров сильно различаются. Атом азота обладает большим сродством к протону, т. е. более сильной основностью. Так, например, при 25°С 80% молекул нейтральной (монопротонированной) формы несут протон на атоме азота, а остальные 20% протонированы по менее основному кислороду —O-.
1 Микроскопические константы иногда называют «истинными» константами, однако последний термин используется в этой книге в более узком смысле. Микроскопические константы обозначаются звездочкой.
2 В химии обычно пользуются константой диссоциацией протона Кd (в случае кислот ее обозначают через Kа), которая для R—СООН составляет 1,7∙10-5; величина рКа равна 4,8 Однако, чтобы не нарушать единообразия, мы будем пользоваться только константой ассоциации (связывания).
3 Индексы а и b используются здесь, а также часто и в других учебниках все для того, чтобы указать, что соответствующие константы относятся к кислоте или основанию, а просто для обозначения отдельных стадий ассоциации в соответствии с уравнением (4-21).