Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Количественная оценка прочности связывания
Таутомерия и связывание протона
Две монопротонированные формы пиридоксина представляют собой таутомерную пару [см. уравнение (2-3)]. Таутомерное отношение
![]()
представляет собой pH-независимую константу равновесия, равную при 25 °С 0,796/0,204 = 3,9 [7]. Следует отметить, что для оценки микроскопических констант, характеризующих связывание протонов с молекулами, содержащими неодинаковые группы, необходимо знать таутомерное отношение (или отношения, если речь идет о более чем двух центрах связывания). В случае пиридоксина величина R была определена спектрофотометрически.
Используя уравнение (4-20), в котором [РХ]А и [РХ] в представляют собой концентрации двух таутомерных форм пиридоксина, можно рассчитать значение микроскопических констант.
![]()
Видно, что величина K1представляет собой просто сумму двух микроскопических констант для процессов присоединения протона, приводящих к образованию двух таутомерных форм РХ(А) и РХ(В). Аналогичным образом можно показать, что величина К2 прямо связана с микроскопическими константами, характеризующими присоединение второй молекулы X [уравнения (4-21) и (4-22) ]1):

Поскольку таутомерное отношение R равно [РХ]А/[РХ]В, уравнения (4-20) и (4-22) можно записать в следующем виде:
![]()
Спектрофотометрические измерения показали, что в случае пиридоксина lg К1= 8,89, а lg К2 = 4,94. Эти значения в сочетании с экспериментально определенной величиной таутомерного отношения R позволили определить микроскопические константы.
1 В химической литературе чаще всего используют константы диссоциации, а не константы связывания (ассоциации). Так, например, если X — это протон, то в уравнении (4-21) стрелки имеют обратное направление. При этом микроскопические коистаиты диссоциации РН2 обозначают Ка и Кb, а константу диссоциации, характеризующую стадию отщепления первого протона, — K1.
Поскольку определить таутомерные отношения обычно довольна трудно, микроскопические константы аппроксимируют константами связывания, измеренными для соответствующих соединений, у которых одна из основных групп метилирована, этерифицирована или блокирована каким-нибудь иным способом. Рассмотрим протонирование двух таутомерных форм очень слабого основания 1-метилурацила:
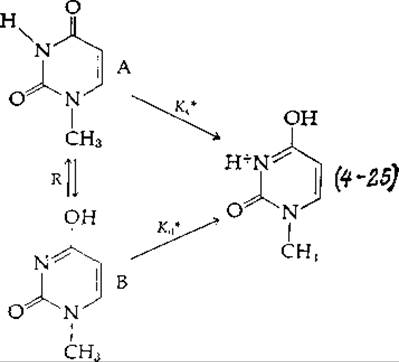
Были измерены кажущиеся константы (lg Ki) протонирования двух приведенных ниже диметилированных производных [8]. В обоих случаях получаются катионы, аналогичные приведенным в уравнении (4-25).
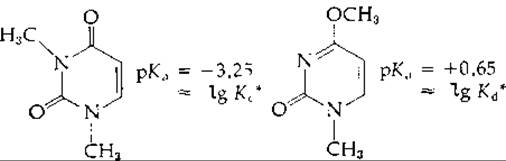
С полным основанием можно считать, что полученные значения рKа примерно равны lg K*cи lg K*d(что и указано выше). Отсюда, используя уравнение (4-24), получаем, что lg R ≈ 0,65 + 3,25 = 3,9. Это значит, что большая часть молекул 1-метилурацила [уравнение (4-25)] находится в таутомерной форме А1.
Наряду с таутомерией, сопровождающей связывание протонов и других небольших лигандов с белками [10, 11], внимание биохимиков всегда привлекал вопрос о таутомерии монопротонированных форм цистеина, глутатиона и других аминокислот и пептидов [9, 9а].
1 Этот результат позволяет предположить, что в пределах ошибки измерения величина рKа (lgK2) для 1-метилурацила равна lgK*c, а именно —3,25. Хотя она действительно оказалась близкой к этому значению (—3,40), однако не настолько, чтобы можно было уверенно использовать ее для точной количественной оценки R. Авторы работы [8] определили значение R также и независимым способом.