Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Количественная оценка прочности связывания
Связывание ионов металлов
Состояние равновесия при образовании комплексных ионов с металлами описывается точно так же, как и при связывании малых молекул и ионов с макромолекулами [26—28]. Для образования комплексов, содержащих один, два или большее число лигандов X, связанных с центральным ионом металла, определяются соответствующие константы. При этом вместо буквы Р, которой мы пользовались в предыдущих уравнениях, обычно употребляют букву М (металл), вместо X — L (лиганд), а вместо ψ — ß. Таким образом,
ß1 = К1; ßn = К1К2...Кn. (4-37)
Таблица 4-2 Логарифмы констант связывания для некоторых комплексов металлов при 25 °Са
|
Лиганд |
н+ |
Mg2+ |
Са2+ |
Мn2+ |
Сn2+ |
Zn2+ |
|
Гидроксил-ион, ОН- |
14,0 |
2,5 |
1,4 |
6,5 |
4,4 |
|
|
Ацетат- |
4,7 |
~0,65 |
0,5 |
—1,0 |
2,0 |
1,5 |
|
Лактат- |
3,8 |
1 ,0 |
~1,2 |
1,3 |
3,0 |
2,2 |
|
Сукцинат2- |
5,2 |
1,2 |
1,2 |
3,3 |
2 |
|
|
NH3 |
9,3 |
∼0 |
-0,2 |
0,8 |
4,0 |
2,4 |
|
Этилендиамин |
10,2 |
0,4 |
2,8 |
10,8 |
6,0 |
|
|
Глицин- |
9,6 |
2,2 |
1,4* |
2,8 |
8,2 |
5,0 |
|
Глицинамид |
8,1 |
—1,5 |
5,3 |
3,3 |
||
|
Аланин- |
9,7 |
2,0* |
1 ,2* |
3,0* |
8,1 |
4,6 |
|
Аспартат2- |
9,6 |
2,4 |
1 ,6 |
8,6 |
5,8 |
|
|
Глицилглицни- |
8,1 |
1 2* |
2,2* |
5,5 |
3,4 |
|
|
Пиридин |
5,2 |
0,1 |
2,5 |
1 |
||
|
Имидазол |
7,5 |
1,6 |
4,6 |
2,6 |
||
|
Гистидин |
9,1 |
3,3 |
10,2 |
6,6 |
||
|
Адении |
9,8 |
8,9 |
6,4 |
|||
|
Цитрат3- |
5,6 |
3,2 |
4,8 |
3,5 |
~4 |
4,7 |
|
ЭДТА4- 6 |
10,2 |
8,8 |
10,6 |
13,8 |
18,7 |
16,4 |
|
ЭГТА4- в |
9,4 |
5,3 |
10,9 |
12,2 |
17,6 |
12,6 |
|
АТР4- |
6,5 |
4,2 |
3,8 |
4,8 |
6,1 |
4,9 |
a Все значения относятся к lg K1. Для протонов приведены максимальные значения. Данные для аминокислот взяты из работы [28], остальные данные — из работы [28а]. Большая часть констант для аминокислот относится к растворам с ионной силой 0,1, а некоторые, отмеченные звездочкой, — к растворам с ионной силой, равной 0. Значения, приведенные для других лигандов, отобраны из большого числа имеющихся в литературе значений без указания первоисточника.
б Этилендиаминтетрауксусная кислота (ЭДТА)
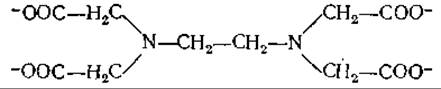
— комплексообразующий агент, широко используемый биохимиками для предотвращения нежелательного влияния ионов двухвалентных металлов. Благодаря высоким константам связывания ионов металлов этим агентом большинство из них в растворе связывается с ЭДТА.
в ЭГТА — соединение, аналогичное ЭДТА; но в молекуле ЭГТА атомы азота связаны через —СН2—СН2—О—СН2—СН2—О—СН2—СН2-группу, а не через —СН2—СН2-группу. Обратите внимание, что ЭГТА обладает большей избирательностью по отношению к ионам Са2+ по сравнению с ионами Mg2+, чем ЭДТА.
Многие важные вопросы, касающиеся связывания ионов металлов в живых клетках, до сих пор остаются неясными. Например, какая доля ионов данного металла, присутствующего в клетке, находится в свободном виде, а какая связана с органическими молекулами? С какими лигандами связывается металл? Поскольку многие металлы токсичны в больших количествах, ясно, что должны существовать какие-то механизмы гомеостаза. На чем может быть основана чувствительность этих механизмов к изменению концентрации свободных ионов металла в клетке? Каким образом организму удается избавиться от ненужных ионов металлов? Чтобы ответить на все эти вопросы, необходимо понять количественные закономерности, определяющие связывание ионов с потенциальными центрами связывания в молекулах различных веществ, содержащихся в клетке.
В табл. 4-2 приведены значения логарифмов констант образования комплексов между нонами некоторых металлов и органическими и неорганическими лигандами при соотношении 1 : 1 [28, 28а]. Когда известно несколько констант, соответствующих последовательным стадиям связывания, приводится только значение lg К1. Во многих случаях, однако, с одним ионом может связываться два или большее число лигандов. Так, например, известно, что взаимодействие между ионом двухвалентной меди и аммиаком характеризуется четырьмя константами
Cu2+ + NH3,
lgКі = 4,0; 3,3; 2,7; 2,0.
Следует отметить, что различия между последовательными значениями логарифмов констант превышают те различия, которые можно было бы ожидать, учитывая статистический эффект для случая эквивалентных центров. Как отмечалось выше, для двух таких центров это различие равно 0,6, а в данном случае оно должно быть еще меньше. Таким образом, при последовательном присоединении лигандов в рассматриваемом примере, как и во многих других, имеет место антикооперативный эффект.
Большинство ионов металлов может последовательно связываться с двумя или тремя аминокислотами. С ионом меди, для которого координационное число чаще всего равно 4, могут связываться два лиганда. В этом случае имеет место четко выраженная антикооперативность, которая проявляется в большом различии между значениями первой и второй констант связывания.
Сu2+ + Аланин,
lg = 8,1; 6,8.
а. Факторы, влияющие на прочность связывания металла в комплексе
Важным фактором, влияющим на связывание металла, является основность лиганда. Чем выше основность, тем легче лиганд связывает ионы металла, совершенно аналогично тому, как при связывании протонов. Однако в случае ионов металлов прочность связывания пропорциональна не основности, а нуклеофильности лиганда, лишь частично определяемой основностью (гл. 7, разд. В.1).
Сильное влияние на связывание металлов оказывает pH среды. Конкуренция металла с протоном приводит к тому, что стабильность комплексов металлов уменьшается по мере понижения pH. Например, анионы карбоновых кислот при рН < 4 практически полностью протонированы, и ионы металла могут связываться с ними, лишь вытесняя протоны, а при рН≥7 конкуренция с протонами отсутствует. В случае же этилендиамина, для которого рКа равны 10,7 и 7,5 (табл. 4-2), протоны при этих значениях pH весьма успешно конкурируют даже с таким сильным комплексообразующим ионом, как Сu2+. При высоких значениях pH в качестве конкурента лиганда начинает выступать гидроксильная группа. Так, например, при pH 7 приблизительно половина находящихся в растворе ионов Сu2+ оказывается в форме комплекса СuОН+.
Одним из основных факторов, определяющих сродство органических молекул к ионам металла, является хелатный эффект1. Под этим термином понимается четко выраженная способность органической молекулы связывать ионы металлов при наличии в ней двух или большего числа групп, способных к комплексообразованию. Природа с успехом использовала хелатный эффект при создании таких важных металлсодержащих молекул, как порфирины (рис. 10-1), хлорофилл (рис. 13-19), энтеробактин (рис. 2-44), кальций-связывающие белки (разд. В, 8, в) и т. д. Данные, приведенные в табл. 4-2, показывают, что прочные хелатные комплексы образуют также многие относительно простые соединения, такие, как а-аминокислоты или лимонная кислота.
б. Влияние природы иона металла на образование хелатных комплексов
Константы образования хелатных комплексов зависят от заряда, радиуса (табл. 4-3), степени гидратации иона металла и формы его электронных орбиталей, участвующих в образовании ковалентной связи с хелатной группой. Многозарядные ионы образуют, как правило, «более прочные комплексы, чем однозарядные ионы, обладающие меньшей плотностью заряда. Чем меньше радиус иона, тем при данной величине заряда (например, Na+ и К+; Mg2+ и Са2+) сильнее гидратирован этот ион по сравнению с более крупными ионами, в которых заряд распределен по большей поверхности.
Таблица 4-3 Ионные радиусы некеторых ионов металлов и неметаллова, нм
|
Мn2+ |
0,080 |
||||
|
Li+ |
0,060 |
Fe2+ |
0,076 |
H- |
0,21 |
|
Na+ |
0,095 |
Со2+ |
0,074 |
F- |
0,136 |
|
К+ |
0,133 |
Ni2+ |
0,069 |
Вr- |
0,195 |
|
Rb+ |
0,148 |
Сu2+ |
0,0726 |
I- |
0,216 |
|
Zn2+ |
0,074 |
||||
|
Cd2+ |
0,097 |
||||
|
Ве2+ |
0,031 |
||||
|
Mg2+ |
0,065 |
Al3+ |
0,050 |
||
|
Са2+ |
0,099 |
Fe3+ |
0,064 |
||
|
Sr2+ |
0,113 |
Мо4+ |
0,070 |
||
|
Ва2+ |
0,135 |
Мо6+ |
0,062 |
a Приведенные значения ионных радиусов рассчитаны по методу Полинга и взяты из книги Cotton F. A., Wilkinson G., Advanced Inorganic Chemistry, 3rd ed. Wiley (Inlerscience), New York, 1972.
б По данным Ahrens L.; из Sienko M. J., Plane R. A., Physical Inorganic Chemistry, pp. 68—69, Benjamin, New York, 1963.
1 Слово «хелат» греческого происхождения и в переводе означает «клешня краба».
Большинство катионов, за исключением самых крупных, имеет первичную гидратную оболочку, образованную примерно шестью молекулами воды. Четыре из них располагаются в одной плоскости вокруг иона, как это показано для случая иона Mg2+ на приведенном ниже рисунке [29].

Сверху и снизу с помощью координационных связей присоединяются еще две молекулы воды, в результате чего образуется октаэдрическая структура. Далее формируется менее плотная вторичная сферическая оболочка. В опытах по электрохимическому переносу было показано, что вокруг иона Na+ находится в сумме ~16 молекул воды, а вокруг иона К+ ~ 10 молекул.
Для образования хелатного комплекса ион металла должен, как правило, потерять большую часть своей гидратной оболочки.
По этой причине крупные и менее гидратированные ионы металлов часто связываются с лигандами прочнее, чем небольшие, сильно гидратированные ионы. Так, например, ионы Са2+ связываются с ЭДТА прочнее, чем ионы Mg2+ (табл. 4-2). Однако иногда наблюдается и обратная картина, особенно когда имеются отрицательно заряженные лиганды (например, ОН-), обладающие более высокой плотностью заряда. Заметим, что ионы Mg2+ связываются с АТР4- (табл. 4-2; гл. 3, разд. Б. 5) более прочно, чем ионы Са2+. Такого типа особенности лежат в основе очень важных различий биологического поведения разных ионов.
Ниже приведен хорошо известный ряд металлов первой переходной группы
![]()
На основании законов электростатики, учитывая потенциалы ионизации или электроотрицательность ионов, можно было бы ожидать, что стабильность хелатных комплексов при переходе от марганца к цинку будет монотонно возрастать. В действительности же самые прочные комплексы с азотсодержащими лигандами образуют ионы Сu2+ (табл. 4-2). Ионы кобальта, никеля и железа также образуют весьма прочные комплексы с такими лигандами, что объясняется, по-видимому, способностью переходных металлов предоставлять свои d-орбитали для образования координационных связей за счет акцептирования электронов лигандов. Весьма важным представляется тот факт, что ионы железа, меди и кобальта часто располагаются в центрах специфических азотсодержащих структур, например гема (рис. 10-1) и витамина B12 (дополнение 8-Л).
С какими лигандами преимущественно связываются ионы в клетках? Ионы щелочных металлов (Na+ и К+) присутствуют в основном в свободном виде, однако часть из них связана со специфическими участками в белках. Аналогично Са2+ и Mg2+ существуют как в свободном виде, так и в виде комплексов с присутствующими в клетках многочисленными фосфатными и карбоксилатными ионами. Что же касается ионов более тяжелых металлов (таких, как цинк, медь, железо и другие переходные металлы), то они лучше всего связываются с атомами азота и серы, часто в таких специфических молекулах, как, например, порфирины.
в. Центры связывания металлов в белках
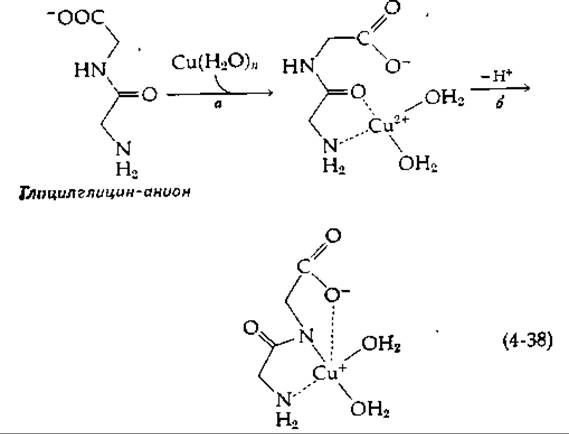
Многие металлопротеиды содержат особые металл-связывающие простетические группы, примером которых может служить порфириновая группа в гемоглобине (рис. 10-1). Иногда специфический центр связывания создается кластерами из карбоксильных, имидазольных или других групп. В качестве одного из лигандов в некоторых белках может выступать NH-группа пептидной связи, которая утратила протон. Небольшие пептиды реагируют с ионами Сu2+, образуя комплексы [30, 31]; в некоторых из них ион меди ковалентно связан с азотом амидной группы [уравнение (4-38), стадия б].
В специальных кальций-связывающих белках, или «парвальбуминах», ион Са2+ связан как с амидной группой, так и с кластером карбоксилат-ионов. Установлена трехмерная структура такого белка из мышцы карпа (рис. 4-5). В этом белке имеется два центра связывания для кальция. В одном из них (рис. 4-5, А, слева) ион Са2+ связан с четырьмя карбоксильными группами боковых цепей остатков аспарагиновой и глутаминовой кислот, с гидроксильной группой остатка серина, а также с карбонильным кислородом 57-го остатка пептидной цепи. Заметим, что эта же самая пептидная группа связана водородной связью с карбонильной группой другого сегмента полипептидной цепи, расположенного рядом со вторым центром связывания иона Са2+ (рис. 4-5, А, справа). Этот центр содержит четыре карбоксилат-иона (один из которых осуществляет координационное связывание иона Са2+ обоими атомами кислорода) и карбонильную пептидную группу. Значение данной структуры не совсем ясно, однако анализ схемы, представленной на рис. 4-5, приводит к выводу, что образование хелатных комплексов может обусловливать значительные конформационные изменения в структуре белка за счет сближения некоторых основных групп. Образование таких комплексов делает также структуру молекулы более жесткой, что может иметь большое значение для ее биологической активности.
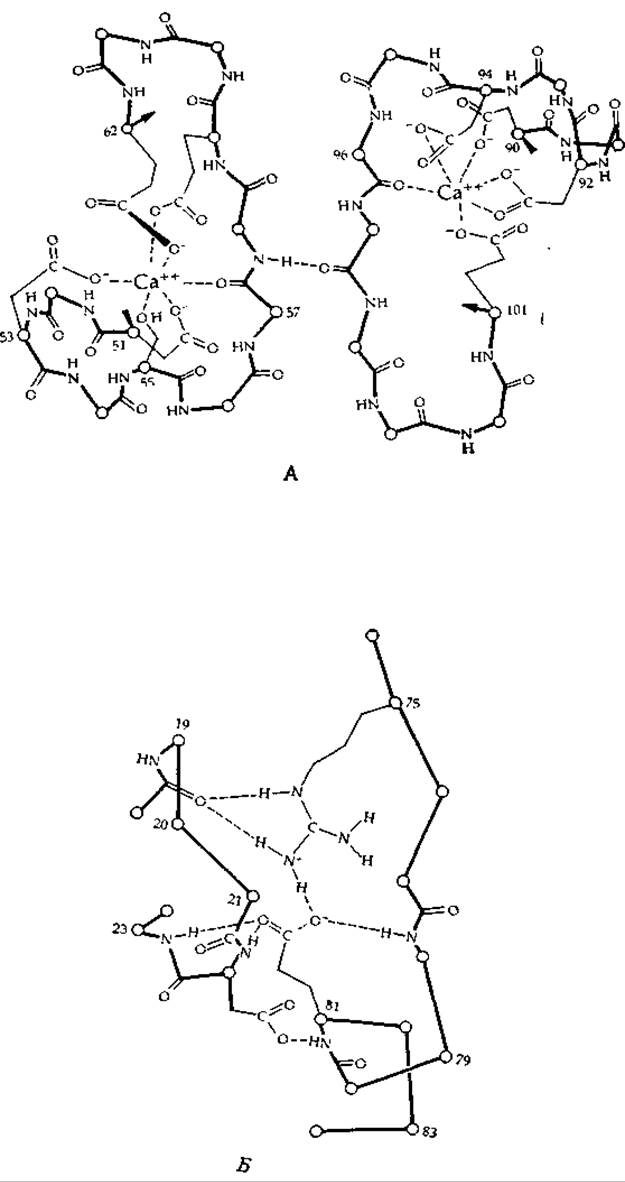
РИС. 4-5. А. Часть полипептидной цепи кальций-связывающего белка мышцы карпа, содержащей 108 аминокислотных остатков. Показаны две петли, связывающие ионы кальция, и водородная связь между ними. Б. Система водородных связей, связывающих два сегмента полипептидной цепи внутри молекулы. Обратите внимание на связь между гуанидиновой группой остатка аргинина (75) и карбоксилатом остатка глутаминовой кислоты (81), а также карбонильной группой пептидной связи 18-го остатка. Обратите внимание и на то, что карбоксилат взаимодействует также с двумя пептидными NH-группами [32, 32а].
Хорошо известно, что ионы кальция поступают в цитоплазму в ответ на нервную стимуляцию и что именно они вызывают различные ответные реакции в организме, такие, например, как мышечное сокращение. Весьма вероятно, что в результате присоединения ионов Са2+ к специфическим центрам связывания (как это имеет место, например, в кальций-связывающем белке карпа) в молекуле происходят конформационные изменения, инициирующие биологические ответные реакции. Кальций-связывающий белок содержит интересную систему внутренних полярных групп, связанных между собой специфическим образом с помощью водородных связей (рис. 4-5, Б). Присоединение ионов кальция может вызывать перестройку этих внутренних связей (гл. 2, разд. Б.7) и изменять тем самым характер взаимодействия этого белка (функция которого точно не известна) с другим белком (ср., например, с действием тропонина С, разд. Е.1). В других кальций-связывающих центрах в белках содержатся остатки укарбоксиглутаминовой кислоты, способной образовывать хелатные комплексы (дополнение 10-Г).