Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Количественная оценка прочности связывания
Кооперативные процессы
Может ли взаимодействие между группами приводить к увеличению значений констант, характеризующих последовательные этапы присоединения лигандов? С первого взгляда это кажется невозможным, поскольку означает, что истинная константа связывания для второго протона больше, чем для первого, а здравый смысл подсказывает нам, что первый протон будет соединяться с тем центром, для которого константа связывания больше, а не меньше. Посмотрим, однако, на экспериментальную кривую связывания протонов с анионом тиамина (рис. 4-4). По сравнению с аналогичной кривой для ацетат-иона она не только не растягивается, а, напротив, становится вдвое более крутой. Это явление объясняется некоторыми удивительными особенностями химического строения тиамина (витамина BI). При определенных условиях этот витамин может кристаллизоваться в виде натриевой соли желтого цвета; структура соответствующего аниона показана ниже. Слабое связывание протона с одним из атомов азота [уравнение (4-31)] приводит к уменьшению электронной плотности на соседнем атоме углерода, к которому присоединяется отрицательно заряженный атом серы, замыкая кольцо неустойчивой трициклической формы тиамина1.
1 Подробнее этот вопрос рассмотрен в гл. 8, разд. Г, а также в работах [19] и [20]
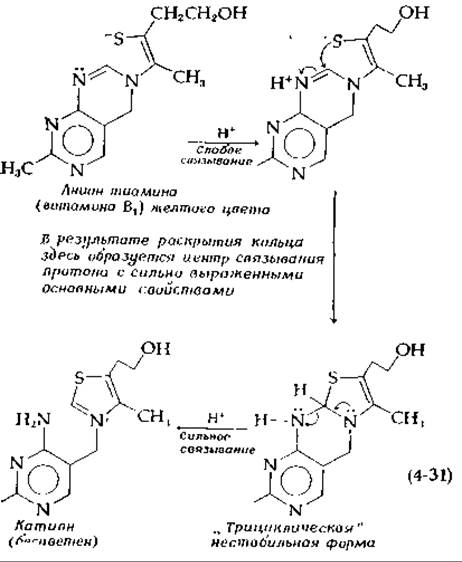
Эта циклическая форма устойчива в метаноле и может быть выделена в кристаллическом виде. В воде же она очень неустойчива, поскольку центральное кольцо в этом растворителе может раскрываться; последующее смещение электронов (как это показано маленькими стрелками) к атому азота сильно повышает его основность. Затем с этим основным атомом азота очень прочно связывается второй протон, в результате чего образуется катион. Таким образом, причиной обратного порядка изменения констант связывания является внутримолекулярная перегруппировка, происходящая в период между связыванием первого и второго протонов. В данном конкретном случае мы, по существу, не можем измерить константы последовательного связывания К1 и К2, поскольку К2 намного больше К1 (вероятно, на один или более порядков). Вследствие этого наклон средней части кривой связывания (рис. 4-4) в пределах ошибки измерения увеличивается в два раза (2∙0,576) по сравнению с соответствующей кривой для ацетат-аниона. Эта кривая точно описывается уравнением (4-32), где ![]() Сравнение уравнений (4-32) и (4-15) показывает, насколько проще первое из них. Связано это с тем, что при наличии кооперативности концентрация продукта, образующегося при присоединении первого лиганда, РХ, пренебрежимо мала.
Сравнение уравнений (4-32) и (4-15) показывает, насколько проще первое из них. Связано это с тем, что при наличии кооперативности концентрация продукта, образующегося при присоединении первого лиганда, РХ, пренебрежимо мала.
![]()
Связывание протона анионом тиамина — это пример кооперативного процесса, названного так потому, что присоединение первого протона облегчает присоединение второго. При связывании небольших молекул кооперативные процессы встречаются сравнительно редко, однако в биохимии они распространены чрезвычайно широко и играют большую роль. Кривую кооперативного связывания называют сигмоидной (S-образной), поскольку график зависимости ![]() от [X] (изотерма связывания) имеет S-образную форму. Процесс связывания называется полностью кооперативным, если возможная степень кооперативности максимальна. Это значит, что n-й центр связывания с лигандом X практически не обладает сродством к X до тех пор, пока не заняты остальные (n—1) центров. Однако после того как эти центры будут заняты, сродство n-го центра к X возрастает настолько сильно, что в любой равновесной смеси присутствуют в значительных количествах только Р и РХ.
от [X] (изотерма связывания) имеет S-образную форму. Процесс связывания называется полностью кооперативным, если возможная степень кооперативности максимальна. Это значит, что n-й центр связывания с лигандом X практически не обладает сродством к X до тех пор, пока не заняты остальные (n—1) центров. Однако после того как эти центры будут заняты, сродство n-го центра к X возрастает настолько сильно, что в любой равновесной смеси присутствуют в значительных количествах только Р и РХ.
Легко показать, что степень насыщения ![]() для случая полностью кооперативного связывания на n центрах есть
для случая полностью кооперативного связывания на n центрах есть
![]()
Где ![]()
Тангенс угла наклона в средней части кривой, построенной в координатах ![]() равен 0,576 n, а изменение lg[X] при изменении
равен 0,576 n, а изменение lg[X] при изменении ![]() от 0,1 до 0,9 составляет 1,81/n.
от 0,1 до 0,9 составляет 1,81/n.
Уравнение (4-33) можно переписать в следующем виде:
![]()
Прологарифмировав его, получаем
![]()
Прямая, являющаяся графическим представлением зависимости ![]() от lg [X], называется графиком Хилла; ее наклон равен n.
от lg [X], называется графиком Хилла; ее наклон равен n.
Напомним, что уравнение (4-34) было вывезено для идеального случая полной кооперативности связывания лиганда всеми п центрами. Тем не менее биохимики часто пользуются графиками Хилла для анализа процессов, кооперативность которых не является полной. В этих случаях экспериментально получаемый тангенс угла наклона прямой Хилла («Хилла) будет меньше числа центров связывания.
Отличие nXилла от n часто используют в качестве показателя степени кооперативности. Для полностью кооперативных процессов отношение «хилла/n равно 1,00, а для случаев неполной кооперативности оно меньше 1. Чтобы определить nXилла, не обязательно строить график Хилла. Для этого достаточно точно измерить тангенс угла наклона в средней
части обычной кривой связывания, построенной в координатах ![]() (или ∆A)}.
(или ∆A)}.
Помимо этого, можно определить ∆lg [X], соответствующее изменению ![]() от 0,1 до 0,9, и далее из уравнения (4-36) рассчитать nХилла:
от 0,1 до 0,9, и далее из уравнения (4-36) рассчитать nХилла:
![]()
Отметим, что иногда графики Хилла не имеют форму прямых и не могут использоваться для определения степени кооперативности.
Вторым примером кооперативного процесса служит обратимая денатурация свернутых полипептидных цепей. Значение pH среды растворов некоторых белков можно довести приблизительно до 4 добавлением кислоты без протонирования при этом групп, «упрятанных» внутрь белковой глобулы, для которых рК>4. При дальнейшем добавлении небольшого количества кислоты происходит протонирование какой-то менее основной группы, что вызывает разворачивание полипептидной цепи и делает доступными для протонирования ранее упрятанные в структуре более основные группы. Таким образом, связывание протона в данном случае является кооперативным процессом, причем, как и для тиамина, причиной кооперативности служит конформационное изменение, вызываемое протонированием определенной группы.
Другой тип кооперативности в молекуле белка обнаруживается при обратимом конформационном переходе между а-спиралью и беспорядочным клубком. Если создать условия, при которых более устойчивой является спиральная конформация, то все молекулы, которые находятся в состоянии беспорядочного клубка, быстро примут форму спирали. Аналогичным образом в условиях, при которых более устойчивой конформацией является беспорядочный клубок, все спирали расплетутся и произойдет полное их превращение в клубки. Плавление ДНК (гл. 2, разд. 10), как и любого кристалла, происходит кооперативно [21]. Формирование новой полинуклеотидной цепи на комплементарной матрице, приводящее к возникновению стэкинг-взаимодействий, также может быть кооперативным процессом. Так, например, формирование цепи полиадениловой кислоты на двух цепях полиуридиловой кислоты приводит к кооперативному образованию комплекса, представляющего собой тройную спираль (гл. 2, разд. Г.6). Наличие стэкинг-взаимодействия делает рост спирали энергетически более выгодным, чем инициацию новых спиральных участков [22]. Проблеме кооперативности посвящена обширная литература, в частности работы [23—25].