Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Количественная оценка прочности связывания
Электростатическое отталкивание. Антикооперативность
Как уже говорилось выше, гипотетическая дикарбоновая кислота с бесконечно удаленными друг от друга карбоксильными группами, для которой lg К* = 4,8, характеризуется двумя константами связывания; различия между ними (см. первую строчку табл. 4-1) обусловлены статистическим фактором (lg 4 = 0,6). Наблюдаемые значения констант связывания протонов дианионами кислот, содержащих 7, 4, 2 и 1 СН2-группу, приведены в табл. 4-1. Для кислоты с самой длинной цепью (азелаиновая кислота) значения lg К близки к таковым для гипотетической кислоты с бесконечно длинной цепью. Однако, чем ближе друг к другу расположены карбоксильные группы, тем сильнее отличается их поведение от предсказанного на основании гипотетической модели. Первая константа связывания заметно возрастает из-за дополнительного электростатического притяжения, а вторая уменьшается1. Взаимодействие между центрами связывания приводит к тому, что разница между двумя значениями lg К возрастает от 0,6 до 2,9. Таким образом, присоединение первого протона затрудняет присоединение второго. Такое отрицательное взаимное влияние, или антикооперативность, во взаимодействиях между центрами связывания встречается очень часто; оно всегда приводит к увеличению разницы между константами образования, что проявляется в «растягивании» кривой, характеризующей зависимость у от lgX. На рис. 4-4 в качестве примера сопоставлены кривые связывания протона ацетат-анионом и сукцинат-дианионом.
Таблица 4-1 Константы связывания протонов дикарбоновыми кислотами3
|
Дианион кислоты |
Число СН2-групп |
lg K1 |
lg К2 |
|
Гипотетический диаииои с lg К* = 4,8 |
∞ |
5,1 |
4,5 |
|
Дианион азелаиновой кислоты |
7 |
5,41 |
4,55 |
|
Дианион адипиновой кислоты |
4 |
5,41 |
4,42 |
|
Дианион янтарной кислоты |
2 |
5,48 |
4,19 |
|
Дианион малоновой кислоты |
1 |
5,69 |
2,83 |
а Из Bell R. Р., The Proton in Chemistry, 2nd ed., p. 96. Cornell Univ. Press., Ithaca, New York, 1973.
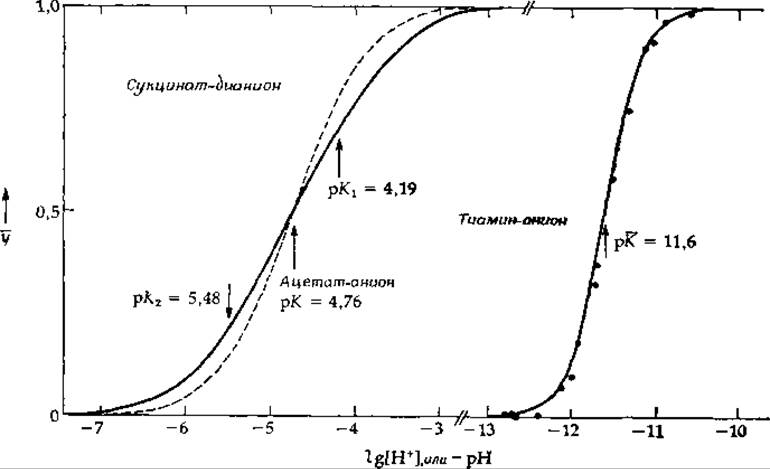
РИС. 4-4 Связывание протонов с ацетат-анионом, сукцинат-дианноиом и тиамии-анионом. Кривая, относящаяся к связыванию одного протона ацетат-анионом (пунктир), имеет обычный для таких процессов наклон. Связывание двух протонов сукцинат-дианионом является антикооперативным процессом, поэтому кривая становится более растянутой. Связывание двух протонов тиамин-анионом [уравнение (4-31)] — это полностью кооперативный процесс; кривая более крутая.
Антикооперативность при связывании протонов естественно вытекает из элементарных соображений электростатики. Соответствующие расчеты можно провести, исходя из уравнения (4-7), если известно значение константы диэлектрической проницаемости среды. Разность между значениями логарифмов двух последовательных констант lg К за вычетом 0,6 (статистический фактор) может служить мерой влияния электростатических сил. Для малоновой кислоты величина ∆рK составляет 2,25, а для янтарной — 0,69 (табл. 4-1). В 1923 г. Н. Бьерум предположил, что ∆рК можно прямо связать с работой, затрачиваемой на сближение двух отрицательных зарядов до расстояния между зарядами в дианионе малоната:

1 Заметим, что в случае малоновой и янтарной кислот первый присоединившийся протон может оказаться общим для обеих карбоксильных групп из-за образования водородной связи. В случае же щавелевой кислоты, где карбоксильные группы непосредственно примыкают друг к другу, действуют дополнительные факторы, в связи с чем значения рК для нее равны 4,19 и 1,23.
Из уравнения (3-30) получаем, что ∆G для аниона малоновой кислоты равно 5,708∙∆рК кДж∙моль-1 = 12,84 кДж∙моль-1. Приравняв это значение работе W [уравнение (4-7)] и приняв диэлектрическую постоянную равной 78,5 (диэлектрическая постоянная для воды), получим, что расстояние между зарядами r составляет 0,138 нм. Поскольку это значительно меньше реального расстояния между зарядами, Вестхаймер и Кирквуд внесли поправку в расчет, предположив, что диэлектрическая постоянная внутри молекулы равна 2. Приняв, что молекула имеет форму эллипсоида вращения, им удалось достаточно точно рассчитать влияние электростатических сил на рКа [15]. Так, например, для дианиона малоновой кислоты в работе [16] получено значение r = 0,41 нм.
Законы электростатики были с успехом использованы также при интерпретации кривых титрования белков, суммарный отрицательный или положительный заряд поверхности которых непрерывно меняется по мере роста числа присоединившихся протонов при переходе от высоких значений pH к низким [17].
Электростатические эффекты могут передаваться с высокой эффективностью через систему ароматических колец. Это обстоятельство, несомненно, очень важно для функционирования биологически активных молекул, содержащих гетероциклические ароматические системы. Рассмотрим влияние степени протонирования азота пиридинового кольца на величину микроскопической константы связывания протона фенолят-анионом пиридоксина:
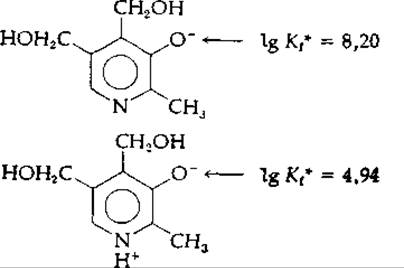
Мы видим, что ∆рK = 3,26; это превышает даже значение ∆рK для малоновой кислоты.
Электростатические эффекты в таких ароматических системах, как правило, удовлетворительно описываются уравнением Гаммета. В качестве упражнения можно сначала рассчитать четыре микроскопические константы диссоциации для 3-оксипиридина, используя значения констант, соответствующих разным стадиям, рКа = 4,91 и 9,62, а также значение таутомерного отношения [7]
![]()
а затем вычислить те же константы на основании уравнения Гаммета [уравнение (3-66)] и сравнить полученные результаты [18].