Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Упаковка макромолекул
Изологические связи: парные взаимодействия
Пару субъединиц, которые удерживаются вместе за счет контактов типа aj и связаны осью симметрии второго порядка (рис. 4-9, А), мы будем называть изологическим димером. Каждая точка одной субъединицы (например, а) может быть совмещена с такой же точкой другой субъединицы при повороте вокруг оси симметрии на 180°. Точки с я с' одной субъединицы (см. рис. 4-9, А) расположены точно напротив соответствующих точек другой субъединицы. В центре структуры, изображенной на рис. 4-9, А, имеется полость, поэтому группы с и с' в действительности не соприкасаются и основной вклад в связывание между субъединицами вносят парные взаимодействия типа aj между группами, удаленными от оси симметрии. Однако реальный белковый димер может и не иметь такой полости. Пара идентичных связей в изологическом димере называется обычно одиночной изологической связью. Такого рода связь включает парные взаимодействия между комплементарными группами (aj) и образуется за счет наличия пар идентичных групп, расположенных вдоль оси1. Изологическое связывание играет исключительно большую роль в олигомерных ферментах, причем высказывалось даже предположение, что оно возникло на самых ранних стадиях эволюции ферментов. Вполне возможно, что сначала практически никакой комплементарности между взаимодействующими субъединицами не существовало и они соединялись за счет неспецифических взаимодействий в результате контактирования двух гидрофобных участков [42], однако в дальнейшем эволюция привела к появлению более специфических парных взаимодействий.
Изологические димеры могут выступать в роли субъединиц при образовании более крупных замкнутых олигомеров и спиралей, например в том случае, если изологическая пара типа изображенной на рис. 4-9, А наложится на другую аналогичную пару (рис. 4-9, Б и В).
1 Чтобы парные взаимодействия назывались нзологическими, они не обязательно должны быть высокоспецифичными и осуществляться между комплементарными поверхностями.
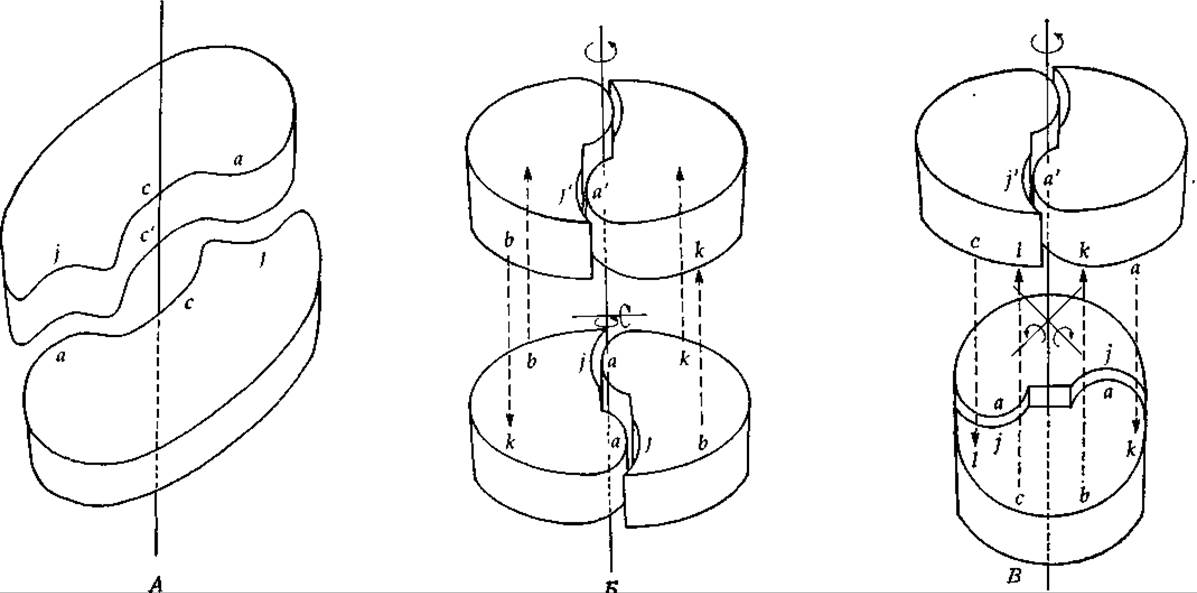
РИС. 4-9. А. Изологическое связывание между парами субъединиц. Б. Расположение субъединиц по типу «изологического квадрата». В. «Тетраэдрическое» расположение субъединиц. Обратите внимание на наличие трех осей симметрии 2-го порядка.
И опять если поверхности димеров окажутся в достаточной степени комплементарными, то между ними образуются связи (bk на рис. 4,9, Б и bk и cl на рис. 4-9, В). Обе изображенные структуры обладают диэдрической симметрией (D2) [43]. Из рисунков видно, что, кроме оси второго порядка, перпендикулярной плоскостям обоих колец, есть еще две оси симметрии второго порядка. Обратите внимание, что и в этом случае взаимодействия оказываются парными, т. е. каждая пара субъединиц связана двумя контактами типа bk и двумя— типа cl. Таким образом, новые контакты также являются изологическими. Всего для каждой комбинации двух субъединиц имеется: шесть пар контактов. На рис. 4-9, В все это видно более четко, чем на рис. 4-9, Б, поскольку в последнем случае конфигурация субъединиц в структуре более или менее близка к квадратной. Тем не менее изологические взаимодействия между левой субъединицей верхнего кольца и правой субъединицей нижнего имеют место; они могут носить чисто электростатический характер, если субъединицы находятся друг от друга на некотором расстоянии.
Примером тетрамерного фермента, т. е. фермента, состоящего из четырех субъединиц, с показанной на рис. 4-9, Б ярко выраженной диэдрической симметрией может служить лактатдегидрогеназа (гл. 8, разд. 3.2). Структура же растительного агглютинина конканавалина А напоминает структуру, изображенную на рис. 4-9, В [44, 45].
Дополнение 4-Б
Жгутики бактерий
Одной из нерешенных проблем биологии является механизм превращения химической энергии в механическую работу. Самыми маленькими движущимися органами являются жгутики бактерий, и можно думать, что исследования данного объекта помогут хотя бы отчасти проникнуть в эту тайну. Жгутики прокариот построены из белка одного типа — флагеллина. Молекулы флагеллина совсем не содержат остатков цистеина и триптофана, а остатки фенилаланина, пролина и гистидина присутствуют в них лишь в небольших количествах. Этот белок характеризуется высоким содержанием гидрофобных аминокислот и имеет один остаток необычной аминокислоты — ε-N-метиллизина. Субъединицы жгутиков образуют спиральную структуру (рис. 4-7), формируя в ней также 11 почти параллельных оси опирали рядов — «надспиралей» с шагом 2,3 мкма-д. Эта последняя особенность жгутиков очень важна для понимания механизма их функционирования. Мутантные бактерии, жгутики которых имеют линейную структуру, неподвижны.
Предполагается, что образование «надспиральной» структуры обусловлено конформационными различиями субъединиц, расположенных в одном продольном рядуг. Здесь, как к в случае вирусов с икосаэдрической оболочкой, квазиэквивалентность позволяет образоваться структуре, неосуществимой при полной идентичности субъединиц.

Микрофотография концевой части бактериального жгутика внутри чехла (негативное контрастирование фосфовольфрамовой кислотой). Жгутик принадлежит неидентифицированной бактерии, обнаруженной в пруду. Назначение неплотно прилегающего чехла неясно. (С любезного разрешения F. D. Williams.)
Как движется бактериальный жгутик? Отдельные жгутики, к сожалению, слишком малы, чтобы за ними можно было наблюдать при помощи светового микроскопа; получить электронно-микроскопическую фотографию функционирующего жгутика также пока не удалось никому. Однако наличие «надспиральной» структуры дает возможность высказать некоторые предположения о механизме движения этого органа. Поскольку субъединицы жгутика идентичны, в нем может индуцироваться периодическое последовательное сокращение «продольных» рядов (сначала одного, потом другого и т. д.)е. Энергия, необходимая для этого процесса, может поставляться конформационным изменением, индуцируемым в бактериальной клетке у основания жгутика.
Эта идея весьма привлекательна, однако самые разные экспериментальные данные указывают на то, что жгутик напоминает жесткий «пропеллер», который вращается при помощи некоего «мотора», находящегося у основанияж. Об этом, в частности, свидетельствует тот факт, что бактерия, искусственно связанная (при помощи антител) с коротким выступом жгутика другой бактерии, может вращаться с помощью этой второй бактерии. Интересные результаты были получены при изучении мутантного штамма Salmonella, обладающего как бы «завитыми» жгутиками с вдвое меньшим шагом «надспирали», чем у нормального штамма. Оказалось также, что к появлению «завитых» жгутиков приводит наличие в инкубационной среде n-фторфенилаланина, а нормальные жгутики превращаются в «завитые» соответствующим изменением pH.
Увидеть отдельные жгутики на живой бактерии невозможно, однако в темном поле светового микроскопа удается наблюдать пучки жгутиков. Если нормальные жгутики имеют, по-видимому, форму левых спиралей, то для «завитых» жгутиков характерны правые опирализ. Нормальные бактерии плывут по прямой, но периодически как бы спотыкаются, после чего меняют случайным образом направление своего движения. (Это поведение бактерий является частью системы хемотаксиса, при помощи которого организм движется в направлении источника пищи; гл. 16, разд. Б.7). «Завитые» мутанты «спотыкаются» непрерывно. Предполагается, что когда бактерия «спотыкается», ее жгутик из нормального превращается в «завитой». При этом «надопираль» меняет свое направление, а ее шаг уменьшается. Возможное объяснение механизма изменения шага «надспирали» основано на предположении о распространении конформационных изменений на смежные ряды субъединиц жгутиковг.
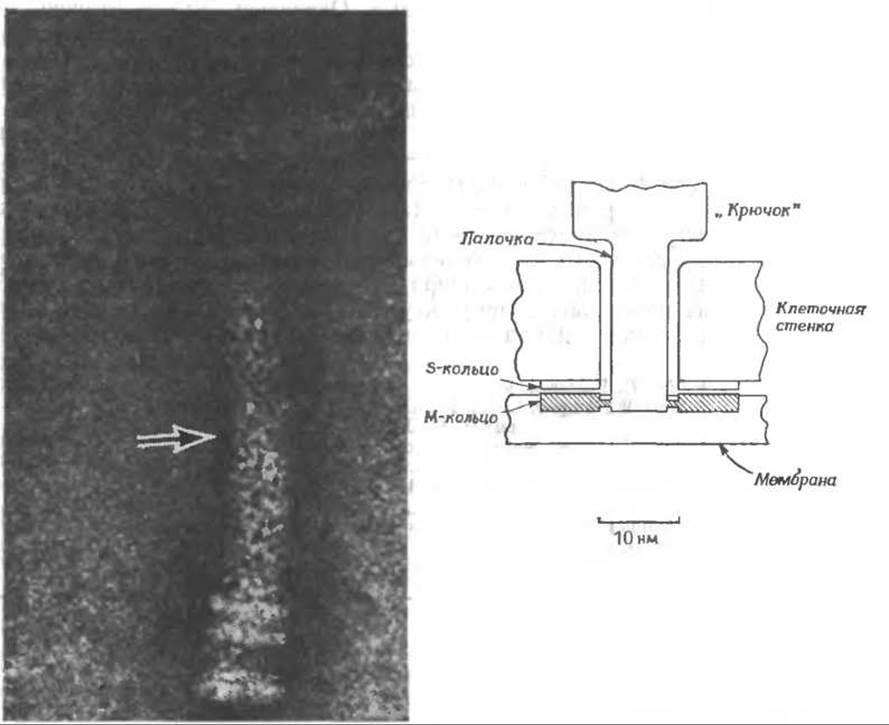
На базальных концах жгутиков грамотрицательных бактерий имеются два дополнительных кольца. На этой электронно-микроскопической фотографиии показан жгутик Е. coli (контрастирование уранилацетатом). На конце жгутика видны N- и S-кольца. Выше их имеются P-кольцо (которое служит, вероятно, для прикрепления жгутика к пептидогликановому слою) и L-кольцо (с помощью которого жгутик, по-видимому, прикрепляется к наружной мембране или к липополисахаридному слою) (рис. 5-8). Стрелка указывает место присоединения «крючка» к более тонкой части нити. Крючок часто изгибается, принимая форму угольника.
Что же за «мотор» приводит в движение бактериальные жгутики? На представленной выше электронно-микроскопической фотографии виден «крючок», прикрепленный к проходящей сквозь клеточную стенку палочке, которая в свою очередь прикреплена к тонкому диску (М-кольцу), погруженному в цитоплазматическую мембрану. Схематически это устройство у грамположительных бактерий показано выше*. По-видимому, между M-кольцом и S-кольцом, укрепленным в клеточной стенке, возникает крутящий момент. Данные о наличии в «моторе» белков типа мышечных отсутствуют, и было высказано предположение о том, что из внутриклеточного пространства бактерии на поверхность М-кольца переносятся ионы, которые, взаимодействуя с зарядами на S-кольце, создают крутящий момент.
Как жгутик растет? Линоа добавил n-фторфенилаланин к суспензии бактерий, от которых были оторваны жгутики на разном расстоянии от основания. По мере роста жгутиков, появлялись завитые концыи. Оказалось, что в отличие от волос на нашем теле жгутики растут с другого конца. Поскольку в окружающей среде отсутствовал свободный флагеллин, рост жгутиков можно было объяснить только тем, что мономеры флагеллина диаметром 4,0—4,5 нм синтезируются внутри бактерии, а затем проходят внутри жгутиков через канал диаметром ~6 нм и присоединяются к их концам. Сначала скорость роста составляет ~ 1 мкм в 2—3 мин, затем процесс замедляется и останавливается, когда длина жгутика достигает ~ 15 мкм (Salmonella). Теперь два вопроса читателю. Во-первых, почему молекулы флагеллина, проходящие сквозь канал, не выходят в окружающую среду? И во-вторых, почему жгутики прекращают расти после того, как их длина достигает приблизительно 15 мкм?
а Lino Т., Bacteriol. Rev., 33, 454—475 (1969).
б Bode W., Angew. Chem. Int. Ed. Engl., 12, 683—693 (1973).
в O’Brien E. J., Bennett D. M., JMB, 70, 133—152 (1972).
г Calladine C. R., Nature (London), 255, 121—124 (1975).
д Gonzales-Beltran C., Burge R. E., JMB, 88, 711—716 (1974).
e Harris W. F., J. Theor. Biol., 47, 295—308 (1974).
ж Berg H. C., Nature (London), 254, 389—392 (1975).
з Shimada K., Kamiya R., Asakura S., Nature (London), 254, 332—334- (1975).
и DePanthlis N. L., Adler J., J. Bacteriol., 105, 384—395 (1971).