Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Упаковка макромолекул
Квазиэквивалентность конформации субъединиц
Вполне разумное предположение о симметричной упаковке субъединиц и электронно-микроскопические данные об их квадратном, пентагональном и гексагональном расположении позволили сделать вывод, что протомеры стремятся объединяться с образованием симметричных структур. Рассмотрим представленный на рис. 4-12 процесс соединения двух молекул. Ясно, что эти молекулы могут «состыковаться», образуя изологический димер, только при условии, если они не упрутся «носами» друг в друга (рис. 4-12, А). Однако, несмотря на очевидные стерические препятствия, изологический димер может образоваться и в этом случае, если одна из субъединиц немного изменит свою конформацию (рис. 4-12, Б). В такой структуре субъединицы будут не эквивалентными, а квазиэквивалентными.
Несимметричная димеризация белков представляет собой, по-видимому, весьма распространенное явление. Например, ферменты малатдегидрогеназа [53] и глицеральдегидфосфатдегидрогеназа (рис. 2-10) являются тетрамерами и обладают симметрией, близкой к диэдрической. При установлении структуры кристаллов этих ферментов исходили из предположения о равноценности всех субъединиц. Однако неожиданно выяснилось, что они не совсем симметричны, поскольку связывать кофермент NAD+ способна только одна из двух полипептидных цепей малатдегидрогеназы.
Структура другого центра связывания, по-видимому, настолько изменена, что он не способен связывать этот необходимый кофермент. Аналогичное явление имеет место и в случае глицеральдегидрофосфатдегидрогеназы (гл. 8, разд. З 3 и 3.5).
Гормон инсулин — это небольшой белок, состоящий из двух полипептидных цепей (обозначаемых латинскими буквами А и В), которые связаны друг с другом дисульфидными мостиками (рис. 4-13, Л). На рис. 4-13,5 схематически изображена структура этого белка согласно рентгеноструктурным данным; представлены только остовы полипептидных цепей и несколько боковых групп [54, 55]. На этом рисунке В-цепь расположена за A-цепью. Начиная от N-концевого фенилаланина-1, пептидная цепь делает плавный поворот, затем примерно в центре молекулы образует три а-спиральных витка, и наконец после крутого разворота направляется в верхний левый угол рисунка, образуя почти полностью вытянутую ß-структуру. A-цепь имеет U-образную форму с двумя участками, напоминающими спирали. Эта конформация частично реализуется за счет образования дисульфидного мостика между двумя частями A-цепи. А- и В цепи связаны двумя дисульфидными мостиками (один из которых расположен в верхней части рисунка, а другой — ближе к нижней его части); стабилизирует всю структуру гидрофобное взаимодействие между боковыми группами аминокислотных остатков, расположенных во внутренней части молекулы.

РИС. 4-12. Несимметричное связывание в димере А. Две молекулы, не способные димеризоваться. Б. Проблема решена: конформация полипептидной цепи молекулы 1 немного изменилась, и теперь молекулы «состыковываются»
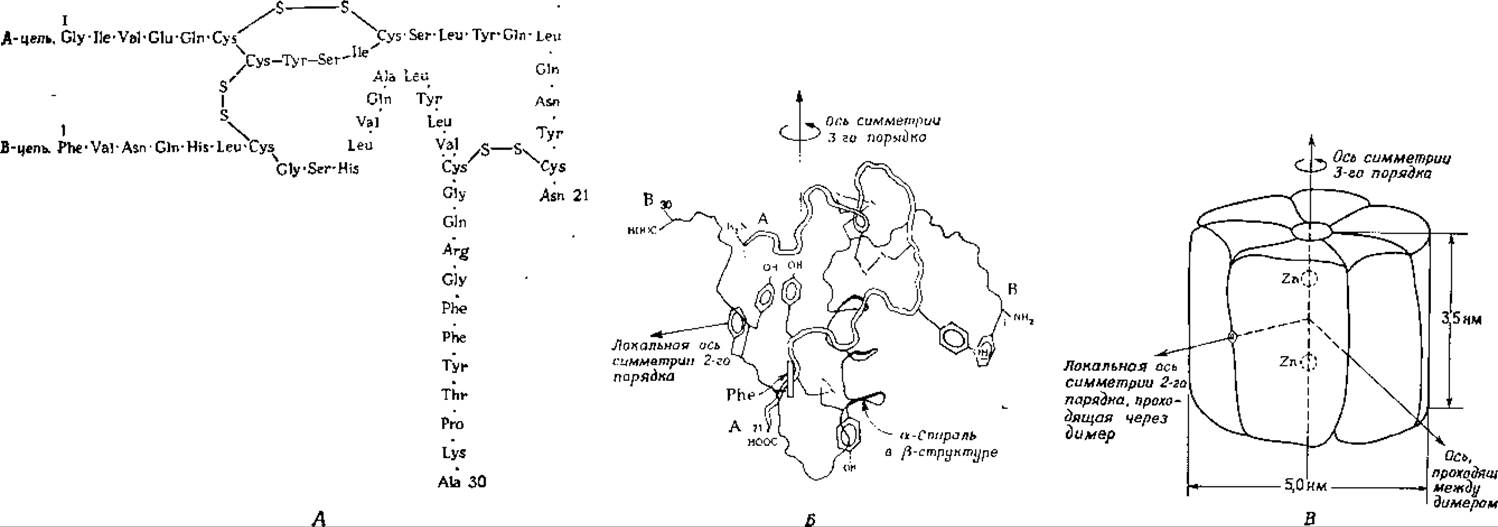
РИС. 4-13. Структура инсулина свиньи. А. Аминокислотная последовательность А- н В-цепей, связанных друг с другом дисульфиднымн мостиками. Б. Пространственное расположение остовов полипептидных цепей в молекуле инсулина по данным рентгеноструктурного анализа. На рисунке указано также расположение некоторых боковых ароматических групп (см. также рис. 4-14 и 4-15). В. Схема, иллюстрирующая упаковку шести молекул инсулина с образованием гексамера, стабилизируемого двумя атомами цинка.
В растворе инсулин легко димеризуется, причем субъединицы занимают квазиэквивалентные положения. В определенных условиях три димера образуют гексамер, обладающий симметрией, близкой к диэдрической (D3); эта структура стабилизируется двумя ионами цинка. На рис. 4-13, В приведено схематическое изображение гексамера; он обладает тремя осями симметрии 3-го порядка и двумя осями симметрии псевдо-2-го порядка, одна из которых проходит между двумя субъединицами димера, а другая — между соседними димерами.
Атомы цинка расположены на оси симметрии 3-го порядка и связаны с тремя имидазольными кольцами гистидинов В-10. Роль атомов цинка не совсем ясна. Гексамеры легко образуют ромбические кристаллы даже внутри панкреатических клеток, синтезирующих инсулин. Структура инсулина воплощает в себе основные особенности строения олигомерных ферментов, обладающих циклической или диэдрической симметрией. Как и в случае гексамера инсулина, центральные части таких молекул часто открыты и «торчащие» боковые группы аминокислотных остатков (в случае инсулина имидазольные группы) образуют как бы «гнезда», в которые могут входить ионы или молекулы, регулирующие активность белков. Однако функциональная роль цинка при действии инсулина остается пока неизвестной.
На рис. 4-14 показано более детально, как связываются между собой субъединицы в димере инсулина, если смотреть на молекулу примерно вдоль оси симметрии 2-го порядка (отмеченной крестиком в центре кольца фенилаланина-25). Видно, что С-концы В-цепей вытянуты. Две антипараллельные цепи образуют ß-структуру с двумя парами водородных связей. Если бы связывание было строго изологическим, эти две пары связей были бы полностью эквивалентными и располагались бы симметрично одна относительно другой. Прямая, проведенная через определенную точку на одной цепи и через ось симметрии 2-го порядка, должна была бы пройти через соответствующую точку на другой цепи. Однако, как показывает тщательный анализ, структура далеко не симметрична.
По-видимому, наиболее ярко асимметрия структуры, изображенной на рис. 4-14, проявляется в центре, где фенилаланин-25 правой цепи выступает из структуры вверх и влево. Если бы симметрия была идеальной, то соответствующая боковая группа левой цепи выступала бы вверх и вправо и эти два фенилаланина столкнулись бы «носами», как это схематически показано на рис. 4-12, А В действительности же в инсулине боковая группа одного из фенилаланинов как бы отклоняется, освобождая место для другой.
На рис. 4-15 представлен разрез олигомера инсулина вдоль плоскости, проходящей приблизительно через обе оси симметрии 2-го порядка (рис. 4-13, В). Обратите внимание на расположение боковых групп вдоль обеих осей. Эти группы соответствуют группам с и с' на рис. 4-9. Заметим, что они идентичны, как и необходимо при изологическом связывании, причем в основном это гидрофобные, ароматические или алкильные группы (главным образом лейцина). Симметрия оказывается не идеальной и метильные группы лейциновых остатков стремятся как бы переплестись, прилегая друг к другу более тесно, чем это должно было бы быть при полной симметрии. Таким образом, результаты детального анализа димерной и гексамерной структур инсулина, с одной стороны, могут служить наглядной иллюстрацией принципов изологического связывания протомеров, а с другой ясно показывают, что два протомера часто связываются друг с другом не строго симметрично.
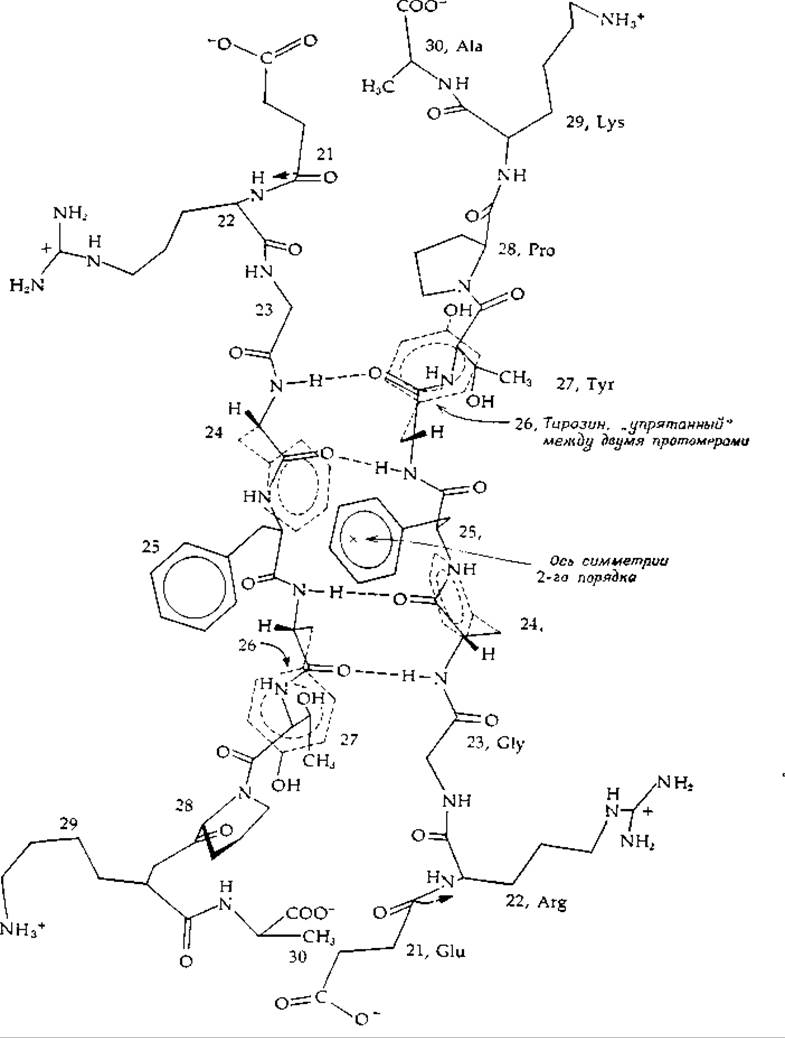
РИС. 4-14. Спаренные С-концевые участки В-цепей в димере инсулина. Вид примерно вдоль оси симметрии 2-го порядка.
Как мы уже отмечали, субъединицы оболочек икосаэдрических вирусов и некоторых ферментов могут быть квазиэквивалентными. Эта особенность ответственна за спирализацию жгутиков бактерий, она же лежит в основе некоторых интересных структурных особенностей вируса табачной мозаики. Белковые субъединицы вируса могут быть уложены либо в спираль с числом субъединиц на один виток, равным 16,3 (рис. 4-7), либо в плоские кольца из 17 субъединиц каждое [36а]. При этом конформационные различия очень малы. Кольца способны димеризоваться, однако крупных агрегатов они не образуют. Удивительно, что димерные кольца не обладают диэдрической симметрией. Все субъединицы в них ориентированы одинаково, но находятся в двух разных конформациях. Есть предположение, что такие диски являются промежуточной структурой при сборке вирусной частицы. Согласно рентгеноструктурным данным, внутренние участки квазиэквивалентных субъединиц диска играют роль своего рода ловушек, ожидающих момента, когда в состав вируса включится РНК. После этого диски меняют конформацию и образуют «завиток», инициируя рост спиральных вирусных частиц [36а]. Эти и многие другие интересные данные позволили предположить, что квазиэквивалентность белковых субъединиц в сочетании с их способностью менять свою конформацию лежит в основе многих биологических явлений.

РИС. 4-15. Разрез молекулы инсулина вдоль плоскости, проходящей через оси симметрии 2-го порядка [54]